新疆红肉苹果不同时期果皮花青苷含量变化及其合成相关基因表达
王 龙,王 芳,汤 蕾,童盼盼,张亚若,王江波,3*
(1.塔里木大学 植物科学学院,新疆 阿拉尔 843300;2.塔里木大学 南疆特色果树高效优质栽培与深加工技术国家地方联合工程实验室,新疆 阿拉尔843300;3.新疆生产建设兵团 塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
红肉苹果(MalusniedzwetzkyanaDieck)为蔷薇科苹果属果树,是我国珍贵树种,该果树开花早,结果早,丰产,抗逆性强,其花、叶、果实等器官富含花青苷,且带有不同程度的红色[1]。新疆红肉苹果是一种果肉、果皮及果核均为红色且拥有多种生物活性物质的独特苹果属果实[2]。花青苷对果实颜色的形成有着重要的作用,花青苷是新疆红肉苹果中多酚的一种,属黄酮类化合物[3]。
花青苷为苹果体内重要的次生代谢产物,由葡萄糖代谢产生的苯丙氨酸为前体物质,一步步在各种酶的催化下合成而来[4]。花青苷的合成受到结构基因与转录因子的协同调控[5],其中部分对花青苷合成起调控作用的基因表达受环境因子的影响,比如温度、光照和营养状况[6-7]。前人对花青苷合成协同作用的结构基因的研究主要集中在与花青苷合成相关酶密切相关的结构基因ANS、UFGT、F3H、PYL、DFR、CHS和对结构基因具有调控作用的转录因子MYB、bHLH、TTG1等上[8-11]。
目前,有关红肉苹果花青苷合成所涉及到的酶和调控因子已有部分研究,但对于花青苷含量及其与相关基因表达量之间的关系尚未明确,因此,本研究以新疆红肉苹果克孜阿尔玛、夏红肉及国外引进红肉品种红色之爱为试材,测定了其果实在不同发育时期果皮花青苷含量及相关基因的表达量,旨在进一步了解花青苷合成机制,为培育红肉苹果新品种提供理论参考。
1 材料与方法
1.1 试验材料
试验材料选取轮台南疆特色果树资源圃的红肉品种夏红肉、克孜阿尔玛,以及第一师阿拉尔市十二团从国外引进的红肉品种红色之爱,在盛花后30、60、90、120、150 d(红色之爱在盛花后30 d未采集样品)在树冠外围中部的4个不同方向随机选取无病虫害、大小基本相同的10个果实,各3次重复,用泡沫冰盒带回实验室,将果皮快速切成细小块状,用液氮处理后分别装入提前准备好的实验袋,放入-80 ℃超低温冰箱保存备用。
1.2 试验方法
1.2.1 花青苷提取及含量测定 花青素提取方法为pH示差法,并根据实际情况稍作调整[12]。取出部分所需样品,快速用液氮研磨充分后准确称取0.4 g,分别用2 mL的pH=1的缓冲液(含50 mmol/L KCl和150 mmol/L HCl)和pH=4.5的缓冲液(含400 mmol/L NaCH3CO2和240 mmol/L HCl)在低温下抽提4 h,直至样品基本呈白色;抽提完成后,在12000 r/min,4 ℃条件下离心15 min;取上清液测量其在510 nm的吸光度值(酶标仪)。花青素浓度计算公式为:花青素浓度(μg/g FW)=(ApH 1-ApH 4.5)×1000×484.8/24825×6。在本研究中0.4 g鲜样近似为0.4 mL体积。
1.2.2 引物设计 在NCBI上查询花青苷合成相关的候选基因,并参考An[13]和孙晓红[14]等报道的基因序列,设计花青苷合成相关基因的实时荧光定量PCR(quantitative Real Time PCR, qRT-PCR)引物。引物名称及序列见表1。

表1 qRT-PCR的引物
1.2.3 果皮RNA提取及qRT-PCR分析 按照上海生工SK8661柱式植物总RNA抽提纯化试剂盒的说明书进行样品果皮RNA的提取,实验步骤稍作变动[19]。用NanoDrop One核酸蛋白分析仪测定OD260、OD280,计算检测RNA的纯度和浓度。同时将提取的RNA样品分别加入溴酚蓝,混匀后用含有EB的1.0%琼脂糖凝胶电泳检测RNA完整性,在紫外投射仪上观察RNA分子的大小、完整性、电泳谱带的清晰度;用反转录试剂盒HiScript®Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)(cat.Z005163,Vazyme)合成cDNA,稀释备用。
以Md-Actin作为qRT-PCR内参基因,对苹果花青苷合成相关基因的相对表达量进行比较。定量PCR于美国ABI 型Q5荧光定量qPCR仪上进行,反应体系按SYBR®Green PCR Master Mix(cat. #RR820A,TaKaRa)说明书进行。PCR反应程序为:94 ℃预变性30 s;94 ℃ 5 s,60 ℃保持30 s,95 ℃延伸15 s,60 ℃ 1 min,95 ℃ 15 s,42个循环。在默认条件下读取CT值。计算2-△△CT值,进行相对表达量分析,每个发育期样品基因表达量为3种生物学重复的平均值。
1.2.4 数据统计分析 实验所得数据用DPS数据处理系统和Excel进行整理、统计、分析和绘图。
2 结果与分析
2.1 3种苹果品种果实在不同发育时期果皮的花青苷含量变化
在果实不同发育时期果皮花青苷含量变化结果如图1,在花后150 d时的外观表型见图2。红肉苹果夏红肉果皮花青苷含量在盛花后30 d达到最高,其含量为135.732 mg/g,随后开始下降,在90 d时降至最低,然后持续上升,在盛花后150 d时其花青苷含量再次有明显升高;克孜阿尔玛果皮花青苷含量变化趋势与夏红肉相同;红色之爱果皮花青苷含量在盛花后60 d达到最高,其含量为88.840 mg/g,而后持续降低,在120 d时达到最低,在150 d时有所回升。在盛花后30 d时,夏红肉与克孜阿尔玛花青苷含量存在显著差异;盛花后60 d,红色之爱与夏红肉、克孜阿尔玛的花青苷含量存在显著差异;盛花后90、120 d这3个品种之间互相存在显著差异;盛花后150 d夏红肉、红色之爱与克孜阿尔玛存在显著性差异。
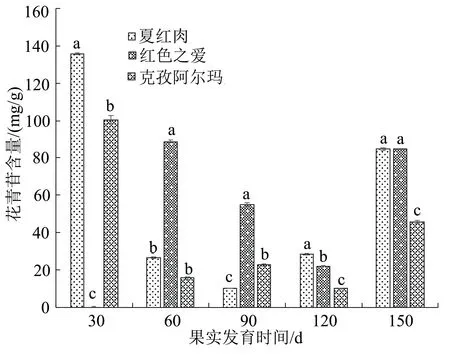
图1 3种苹果品种不同发育时期果皮花青苷含量

图2 3种红肉苹果品种花后150 d时的外观表型
2.2 3种苹果品种果实不同发育时期果皮花青苷合成相关结构基因的相对表达量分析
对3种苹果不同发育时期果皮花青苷合成结构基因进行qRT-PCR分析,结果(图3)表明:在6个结构基因中F3H在3种苹果盛花后90 d和120 d的表达量远远高于其他5个结构基因的表达量。结构基因CHI在夏红肉果实发育的后4个时期表达量都高于其他品种,其次是红色之爱、克孜阿尔玛。结构基因CHS在各红肉苹果发育的各个时期表达量呈升高、降低再回升的趋势,总体上,在盛花后60 d表达量达到最高,在盛花后120 d表达量最低。结构基因UFGT、DFR、F3H在红色之爱盛花后120 d的表达量都大幅度高于其他各品种,同时这3个基因在夏红肉盛花后90 d的表达量都高于其他时期,其中结构基因DFR在红色之爱盛花后150 d表达量最高。结构基因F3H在夏红肉盛花后90 d表达量最高,约为红色之爱、克孜阿尔玛的3~73倍。在6个结构基因中除UFGT、DFR、CHS外,其他3个基因在红肉苹果克孜阿尔玛果实发育的后3个时期的表达量都低于其他两种红肉苹果。

图3 3种苹果品种果实不同发育时期果皮花青苷合成结构基因的相对表达量
2.3 3种苹果品种果实不同发育时期果皮花青苷生物合成转录因子表达量分析
对3种苹果不同发育时期果皮花青苷合成转录因子进行qRT-PCR分析,结果(图4)表明,转录因子MYB10的表达量远高于其他转录因子。在各红肉苹果盛花后60 d与150 d转录因子bLHL3与TTG1的表达量整体低于其他3个时期,这两种转录因子在红色之爱盛花后120 d的表达量达到最高,大幅度高于其他品种和其它时期;红色之爱盛花后90 d转录因子bHLH33的表达量达到最高且大幅度高于其他各品种。在克孜阿尔玛与夏红肉发育全部时期4种转录因子的变化趋势都呈先降低再升高再降低的趋势,在红色之爱发育的各个时期呈先升高再降低的趋势。
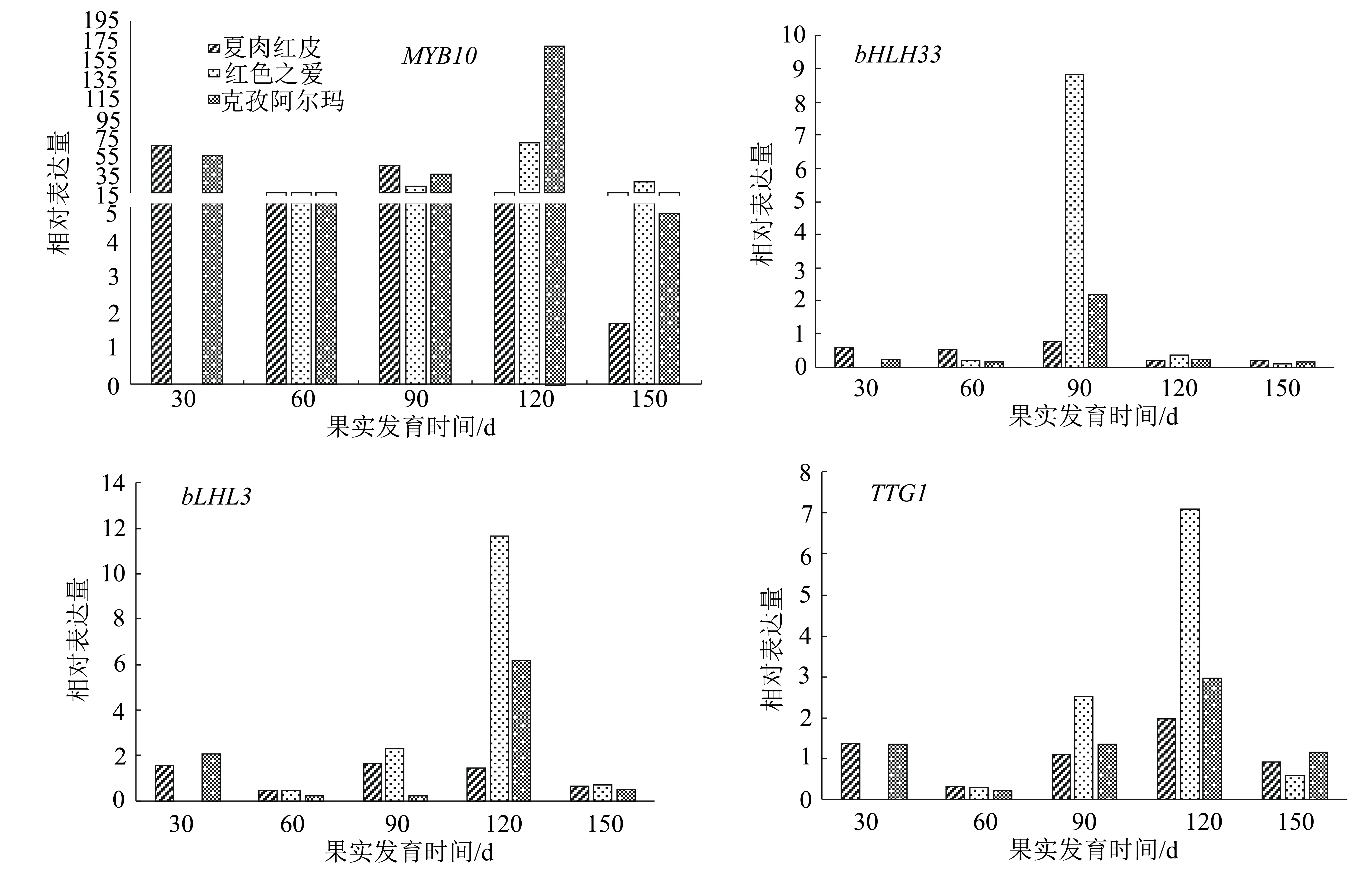
图4 3种苹果品种果实不同发育时期果皮花青苷合成相关转录因子的相对表达量
3 讨论与结论
3.1 讨论
花青苷作为植物重要的色素之一,对果皮色泽影响重大[15]。夏红肉果皮和克孜阿尔玛的果皮在盛花后30 d花青苷含量达到最高,其次是红色之爱果皮在盛花后60 d花青苷含量达到最高;随着果实的生长发育,各个品种的花青苷含量开始下降,下降至最低后持续上升,至150 d再次大幅度增高。孙晓红[16]研究发现红肉苹果果实在盛花后30 d花青苷含量达到最高,随着红肉苹果成熟度的增加果实中花青苷含量开始降低,但部分品种在120 d和150 d果实花青苷含量有所回升,这与本实验结果基本一致。
花青苷在植物特定位置上的表达水平是由结构基因和调控基因共同控制的,经过试验、数据等分析发现,新疆红肉苹果夏红肉花青苷含量在盛花后150 d时有明显升高,而结构基因在克孜阿尔玛、夏红肉盛花后120 d与150 d时表达量有明显升高。结构基因除F3H外,其他基因UFGT、ANS、DFR、CHI、CHS的表达量在各个处理之间差异较小,结构基因F3H在夏红肉盛花后90 d的表达量远高于其他品种,在盛花后120 d在红色之爱中的表达量远高于其他品种。结构基因转录因子MYB10在克孜阿尔玛和红色之爱盛花后120 d的表达量远高于其他品种。转录因子bHLH33在红色之爱盛花后90 d的表达量远高于其他品种;bLHL3在红色之爱盛花后120 d的表达量达到最高。因此,红色之爱果皮花青苷含量与结构基因F3H以及转录因子MYB10、bLHLH33的高水平表达有关,说明新疆红肉苹果花青苷的合成与其结构基因F3H、CHI关系密切,而其调控可能是由转录因子MYB10起主导作用,转录因子bHLH33和TTG1为主要协助,bHLH3转录因子作为次要协助。然而宋杨等[17]在研究中发现泽西越桔果皮中花青苷含量与CHS、F3H和UFGT的关系更为密切,在越桔花青苷合成过程中可能起更加重要的作用。而孙晓红等[18]的研究结果认为导致红勋5号和新疆1号红肉苹果花青苷含量高的主要原因可能是具有R6R6启动子基因型和高水平表达的ANS、UFGT基因及MYB10、TTG1、bHLH33转录因子。前人对花青苷的研究结果都存在着多多少少的差异,也正是这些差异说明果皮红色性状的调控机制非常复杂,具体机制的明确则需要更专业更深入的研究和实践。
3.2 结论
本试验研究结果表明:夏红肉果皮和克孜阿尔玛果皮中的花青苷含量变化趋势相同,在盛花后30 d花青苷含量均达到最高,然后持续下降至最低,在盛花后150 d其含量再次有明显升高;红色之爱果皮花青苷含量在盛花后60 d达到最高;结构基因F3H、CHI与转录因子MYB10、bLHLH33的高水平表达对花青苷合成有促进作用。

