高程对盐沼湿地互花米草生长与扩散的影响
闫振宁 ,梅宝玲,张桂萍,韩广轩,谢宝华*,张树岩,周英锋,刘展航,
1. 内蒙古大学生态与环境学院,内蒙古 呼和浩特 010021;2. 中国科学院烟台海岸带研究所/中国科学院海岸带环境过程与生态修复重点实验室,山东 烟台 264003;3. 山东新汇建设集团有限公司,山东 东营 257500;4. 山东省黄河三角洲国家级自然保护区管理委员会,山东 东营 257500;5. 鲁东大学生命科学学院,山东 烟台 264000
生物入侵是当今公认最棘手的三大环境问题之一,在入侵过程中会导致生态损失与经济损失,中国每年因生物入侵造成的经济损失超2000亿元(Pimentel et al.,2001;李大林,2014)。外来植物入侵是生物入侵的重要组成部分,已成为最严重的生态环境问题之一,对生态系统稳定性及其功能产生了严重影响(Ormerod et al.,2000;Kueffer,2017)。
互花米草(Spartina alterniflora)原产于美洲大西洋沿岸,属于禾本科米草属,在海岸、河口等广阔滩涂具有高度的生态适应性,是海岸带低位盐沼的优势植物,具有有性繁殖与无性繁殖两种极强的繁殖方式,入侵能力极强(Xie et al.,2019)。互花米草于1979年12月从美国引入中国(徐国万等,1989),凭借其强大的繁殖和适应能力,与本地物种海三棱藨草(Scirpus mariqueter)和盐地碱蓬(Suaeda salsa)等形成了强烈的竞争,也对南方红树林的生长造成威胁(陈中义等,2004;陈权等,2015),改变了滨海湿地底栖动物的群落结构(冯建祥等,2018)。
影响互花米草生长扩散的原因多样。高程、潮汐水位落差、持续淹水时间等多种因素均会影响互花米草的生长繁殖,互花米草地上生物量随高程升高在由海向陆方向上呈现出先增后减的抛物线变化模式(Morris et al.,2002;Zhang et al.,2004;Li et al.,2018)。高程在受外界环境频繁干扰的潮间带是一个制约性的环境因子,在较大尺度上甚至决定了盐沼植物的成带分布(Van Wesenbeeck et al.,2008)。高程与潮汐共同作用,则会导致潮间带土壤盐度(或以电导率指示)、土壤水分和温度等因子的变化,而土壤盐度、含水量、温度等因子是影响盐沼植物生长、繁殖和分布的重要环境因子(孙书存等,2001)。还有研究认为,过度淹水造成的土壤缺氧会限制互花米草在沿海方向的生长极限,淹水缺失造成的过度蒸腾和盐度增加则会限制其沿陆地方向的生长极限(Wijte et al.,1996;Morris et al.,2002),因此高程与潮汐的共同作用可能是决定互花米草的扩散范围的关键因素。同样,潮沟也影响着互花米草在潮间带的扩张,潮沟边缘缓坡的较低高程增加了潮汐的淹没时间,互花米草占领之后则导致潮水很难越过,进而给本地物种带来消极影响(Allen,2000;张华兵等,2020)。在相关的互花米草的控制实验中,淹水高度、淹水频率等水淹指标与互花米草生长也表现出良好的相关性(袁连奇等,2010;陈正勇等,2011)。在多种影响因素的交错中,梳理并筛选出影响互花米草生长扩散最重要的环境因素显得尤为重要。
现代黄河三角洲位于山东东营市,1989年互花米草被引种至孤东采油区黄河北侧的五号桩附近,截止至 2018年黄河三角洲互花米草总面积为4005.89 hm2(Ren et al.,2019),近 10 年的年均扩张速率高达25%。本研究在黄河三角洲潮汐湿地设置了互花米草移栽实验,探究互花米草克隆苗与实生苗在盐沼不同高程生态位的生长特征及其主要影响因素,并结合约束性排序中的冗余分析技术,进一步探究了潮间带环境因子与互花米草生长特征之间的关系,为揭示互花米草扩散机制、预测互花米草扩散动态和制定有针对性的防范控制办法提供科学依据。
1 材料与方法
1.1 研究区概况
本试验区域位于黄河入海口南侧潮间带(37°44′0″N,119°13′30″E),该地区属暖温带半湿润大陆性季风气候,年平均气温为12.1 ℃,年均降水量为555—640 mm,年平均蒸发量为1900—2400 mm。该区域潮汐类型为不规则半日潮,潮流与海岸线持平。潮间带地势由海向陆缓慢升高,植物分区明显,优势物种由海到陆方向依次为互花米草、盐地碱蓬、芦苇(Phragmites australis)、柽柳(Tamarix chinensis)。
1.2 样地设置
2019年6月,在黄河入海口南侧潮间带设置一条由海向陆方向的移栽样线,样线上包括对照点和6个移栽样点(图1)。对照点(CK)位于2年生互花米草丛中;移栽点1(Transplanting site1,以下简称 TP1)位于无植物的光滩;移栽点 2(以下简称TP2)位于光滩与盐地碱蓬种群交界处;移栽点3(以下简称TP3)位于盐地碱蓬种群中部;移栽点4(以下简称TP4)位于盐地碱蓬与芦苇共存区;移栽点5(以下简称TP5)位于芦苇种群中部;移栽点6(以下简称TP6)位于柽柳种群中部。2019年10月,用高程测量仪(千寻星矩SR1)测量移栽样点的高程,移栽点高程和相互距离见图2。

图1 研究区域Fig. 1 Map of the study area
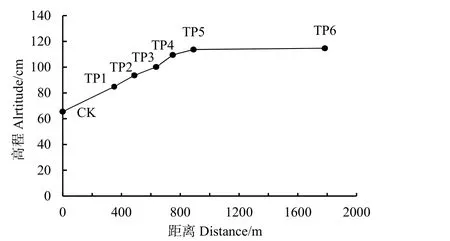
图2 各移栽点(TP1—TP6)的高程及移栽点与对照点(CK)之间的距离Fig. 2 Elevation of each transplanting site (TP) and the distance between transplanting sites and control site (CK)
对照点有互花米草根茎萌发的克隆苗和种子萌发的实生苗,2019年 6月中旬,克隆苗密度为(234.73±7.33) plant·m−2,株高为 (29.09±0.67) cm,实生苗密度为 (172.18±0.2) plant·m−2,株高为(4.08±0.12) cm。2019年6月16日在对照点挖取长势健康、株高一致的克隆苗和实生苗,移栽至各移栽点。挖取植株时,先把直径31 cm、高15 cm的PVC管插入土中,然后把PVC管连同管内的泥土和植被一起挖出,运送至移栽点,植物连同泥土被放置于各移栽点已挖好的大小合适的坑中,每个移栽点的克隆苗和实生苗均有4个重复。
1.3 植物特征监测
2019年6月—2019年10月,每个月调查一次互花米草克隆苗生长状况,记录其密度、株高、基径、叶长、叶宽的变化动态。在每个小区选取生长状况大致相同的3株克隆苗,底部用细铁丝圈住用以标记,每次测量相同植株,使用游标卡尺测量基径、叶长、叶宽,其中叶长、叶宽固定测量从地面往上第3片完全展开的叶子,在生长季末期调查互花米草结穗率(结穗株数/总株数)和穗密度。基径、叶长、叶宽每个重复每次仅调查标记的3株;密度、株高、结穗率、穗密度则调查所有植株。
互花米草实生苗适应性差,在多数移栽点迅速死亡,因此只监测其株高与密度。
2019年6月移栽克隆苗后,9月份互花米草扩散至样方外面,用2019年8月和2020年8月的互花米草株数(N1和N2),计算互花米草种群增长率R(R=N2/N1−1)。
1.4 环境参数监测
1.4.1 潮汐监测
潮汐监测包括淹水时长、平均淹水深度、淹水频率、最大淹水深度等。为了与植被调查保持一致,淹水时长、平均淹水深度、淹水频率、最大淹水深度均为相邻两次植被调查期间的数据:淹水时长指相邻两次植被调查期间的淹水总时长,平均淹水深度和最大淹水深度为相邻两次植被调查日期内淹水深度的平均值与最大值,淹水频率为相邻两次植被调查期间的有淹水天数除以该期间的总天数。试验期间,共调查植被6次。在CK、TP2、TP5处设置潮汐水位观测装置:在固定于土壤中的铁管上安装防水相机,镜头正对于一个塔尺,每隔10分钟相机自动拍摄一次塔尺刻度并保存照片,从照片可判读淹水深度。另外在低潮滩多年生互花米草群落安装一台水位计(美国Campbell CRS456),每10分钟记录一次潮位数据,可得到淹水时长、平均淹水深度、淹水频率、最大淹水深度。通过水位计位置与CK—TP6各点的高程差值,计算得出CK—TP6点位的淹水深度。将CK、TP2、TP5处实际淹水深度与计算淹水深度作差,计算3个点位的差异系数,再将TP1、TP3、TP4、TP6点位的计算淹水深度加差异系数得到实际淹水深度。
1.4.2 土壤性质监测
在每次调查植物时,用美国 Spectrum 2265FS型土壤原位电导率仪测量10 cm深土层的电导率与温度。
1.5 数据处理
用统计软件(IBM SPSS Statistics 19)对实验数据进行统计分析,采用单因子方差分析(One-way ANOVA)中的最小显著差异(LSD)对移栽后互花米草实生苗、克隆苗的密度、株高及移栽克隆苗中固定植株的基径、叶长、叶宽进行差异显著性检验(显著性水平P<0.05),用皮尔逊(Pearson)相关分析确定各指标间相关性。利用国际标准通用软件CANOCO4.5分析环境因子与互花米草生长特征的相关关系,并使用该软件制作冗余分析关系图。利用蒙特卡洛置换检验(Monte-Carlo permutation test)定量评价7个水盐因子对互花米草生态特征变化的独立解释量。
2 结果与分析
2.1 不同高程处环境因子的差异
从 CK—TP1,滩涂高程持续上升,范围为65.5—114.7 cm,TP5与TP6虽然相距近900 m,但其高程基本相同,TP1—TP6各移栽点与 CK间的直线距离从349.3 m逐渐增至1785.2 m(图2)。
试验区滩涂环境因子随高程的升高存在明显的差异(表1)。表1中数据为5个时间段数值的平均值和相应标准偏差。
随着高程不断增加,平均淹水深度显著减小,且各处理之间有显著差异(P<0.05,表1)。淹水频率、淹水时长、最大淹水深度随高程增加而降低。随着高程增加,地面淹水时间越来越短,10 cm土层温度呈现逐渐上升趋势,但只有 TP6显著高于CK、TP1和 TP2(P<0.05),其他移栽点之间的温度差异不显著。虽然对照区至TP6横跨1785.2 m,相对高程也增加了49.2 cm,但是各点的10 cm土层电导率差异非常小。
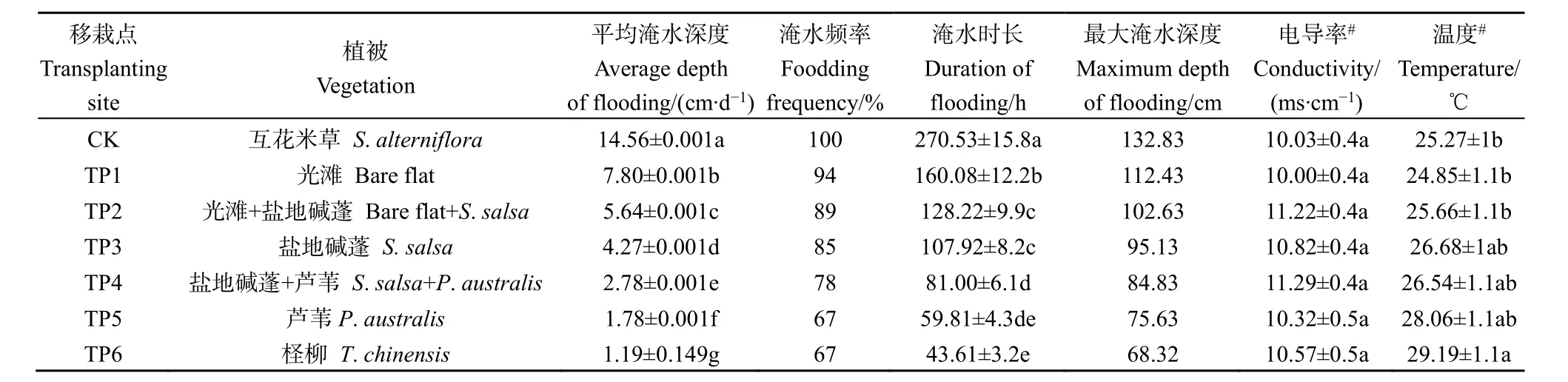
表1 不同移栽点的环境因子Table 1 Environment factors at different transplanting site
2.2 不同高程处互花米草的生长特征
互花米草实生苗是种子萌发的幼苗,环境适应性较弱,成长过程中会有大量实生苗死亡。移栽之后,调查了TP1—TP6各移栽点实生苗的密度与株高的季节变化动态。如图3a所示,TP3、TP5和TP6 3个点的实生苗在6月底第2次调查时均全部死亡,TP4的实生苗密度逐渐降低,在9月中旬的第3次调查时全部死亡。CK、TP1和TP2的实生苗存活于整个生长季,移栽后TP1和TP2的实生苗密度迅速下降,从8月开始又再度增加,TP1实生苗密度快速增加,TP2实生苗密度略有增加趋势,生长季末期TP1的实生苗密度是TP2的6.9倍。虽然TP1和TP2实生苗的密度差别很大,但其株高差异不大,生长季末期,TP1实生苗平均高度为 28.7 cm,是TP2的1.4倍(图3c)。
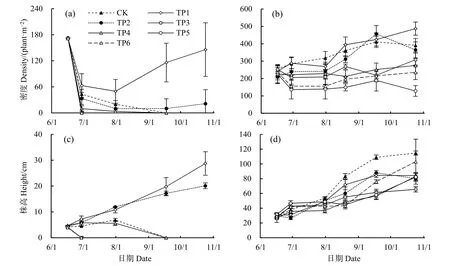
图3 不同高程处互花米草实生苗密度(a)与株高(c)、克隆苗密度(b)与株高(d)Fig. 3 Density (a) and plant height (c) of seedlings, and density (b) and plant height (d) of clonal ramets of S. alterniflora at different elevations
与实生苗相比,根茎萌发的克隆苗具有更强的生命力,各移栽点的克隆苗均大部分存活至生长季结束(图 3b)。不同高程处克隆苗密度变化形式不同,但生长季结束时,各点互花米草密度均超过128 plant·m−2,其中高程最高的TP5和TP6的克隆苗密度最小,除TP5外,其他各点的克隆苗小区中,生长季末期互花米草密度均高于移栽时,TP1密度最大,比移栽时增加了一倍。从(图3d)可以看出,存活下来的克隆苗长势良好,株高持续增加,但各移栽点的克隆苗株高均小于对照点,生长季末期TP6的克隆苗小区内互花米草的株高为 CK的89.8%,其他移栽点互花米草的株高为 CK的57.1%—73.4%。
生长旺盛期(7月末),不同高程处互花米草的叶宽基本相同,基径有随高程增加而逐渐增大的趋势,叶长随高程的增加呈先减小后增大(图4)。
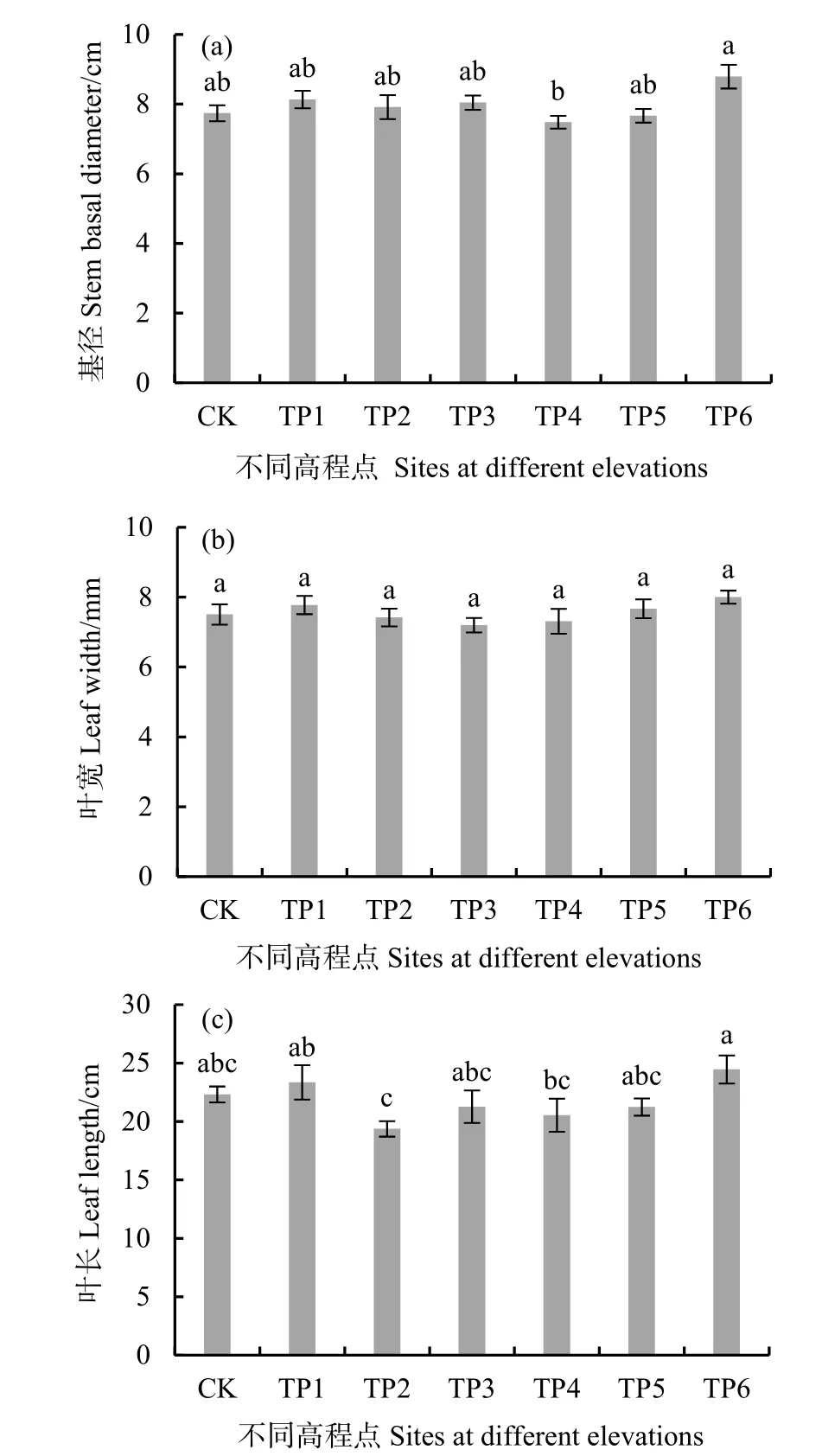
图4 生长季末期互花米草克隆分株的基径(a)、叶宽(b)和叶长(c)Fig. 4 Stem basal diameter (a), leaf width (b) and leaf length (c) of clonal ramets of S. alterniflora at the end of growing season
2.3 不同高程处互花米草的繁殖能力
TP1和TP2的实生苗虽然存活了下来,但生长季末期时平均株高小于30 cm,没有结穗。2019年生长季末调查了不同高程处克隆苗小区互花米草的结穗率(结穗率=结穗株数/总株数)和穗密度(即单位面积内穗的数量)。CK和TP4互花米草的结穗率最低,且二者数值接近,分别为35%和27%,其余移栽点互花米草结穗率很接近,在50%—56%之间,TP4结穗率显著低于TP1、TP3、TP5和TP6,其他处理间结穗率的差异没有通过显著性检验(图5a)。CK和 TP6的互花米草穗密度为中等水平,TP1的穗密度最大,随着高程的增加,TP1—TP5 5个移栽点的穗密度直线下降(图 5b),这说明,随着高程增加,互花米草种子产量将快速下降。另外,各移栽点饱满种子的千粒重差别不大,范围为2.768—3.189 g,是 3年生克隆苗种子千粒重的75%—87%,由于千粒重小于多年生互花米草,这些种子的萌发能力也很有可能小于多年生互花米草。
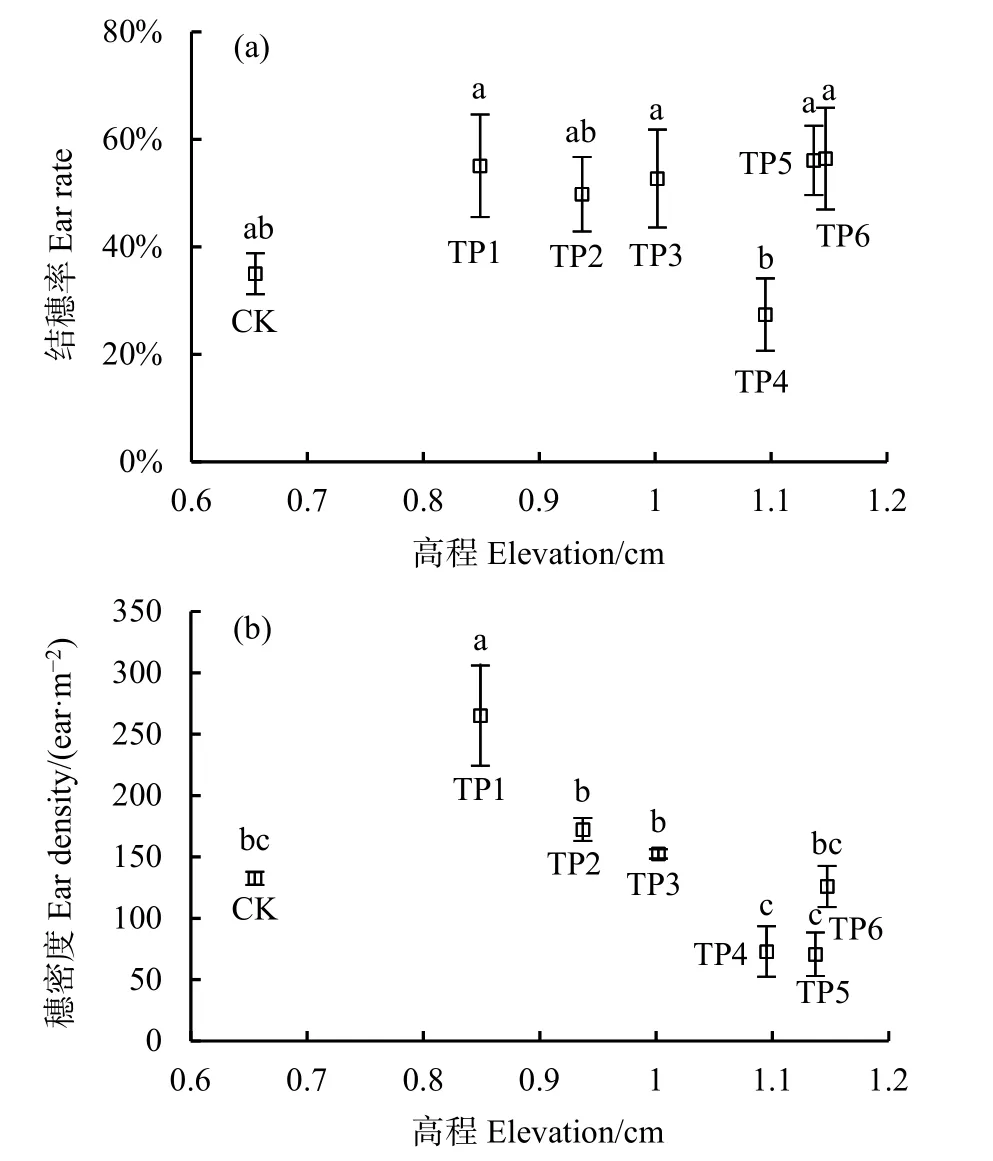
图5 不同高程处互花米草结穗率(a)和穗密度(b)Fig. 5 Ear rate (a) and ear density (b) of S. alterniflora at different elevations
2010年5月中旬,调查了不同高程处克隆苗小区内互花米草克隆苗密度(图6),这些幼苗密度可以表征互花米草无性繁殖能力。总体而言,随着高程增加,互花米草幼苗密度持续下降,从 CK的588.3 plant·m−2降至 TP6 的 222.0 plant·m−2,其中TP2—TP6的密度均显著小于CK。这些结果表明,互花米草无性繁殖能力随高程增加而显著下降。
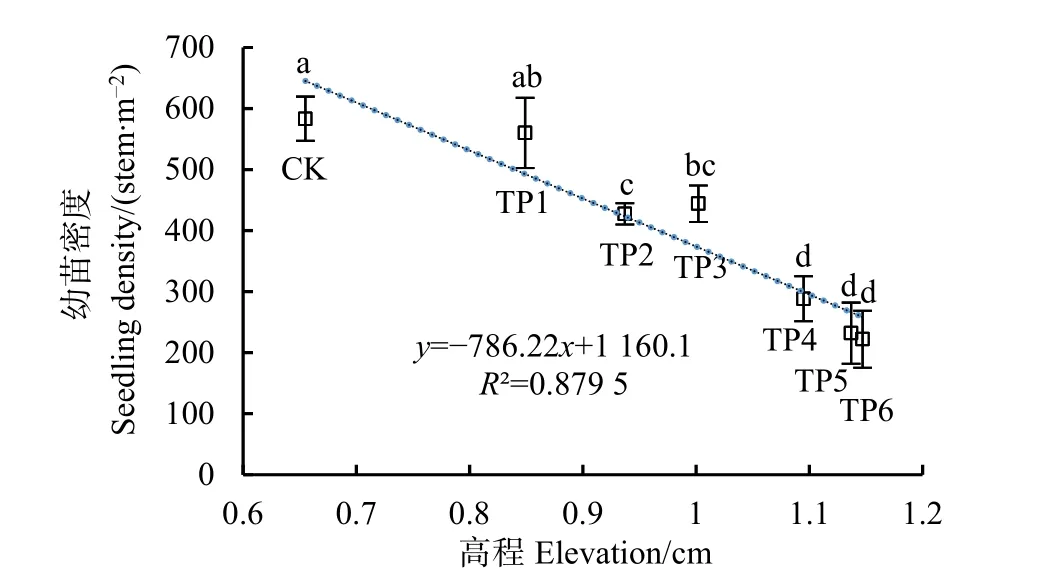
图6 2020年互花米草幼苗密度Fig. 6 Seedling density of S. alterniflora in 2020
图7为各移栽点的互花米草种群增长率,由于CK处互花米草在 2020年7月遭到破坏,未计算CK的种群增长率。互花米草种群增长率随高程增加而持续下降,只有TP1和TP2的种群增长率大于0,说明这两处互花米草成功扩散,TP3—TP5的互花米草虽然在第2年继续存活,但其种群增长率小于 0,后期能否继续存活有待继续观察,在高程最高的TP6,2020年8月时互花米草已全部死亡,种群增长率为−100%。
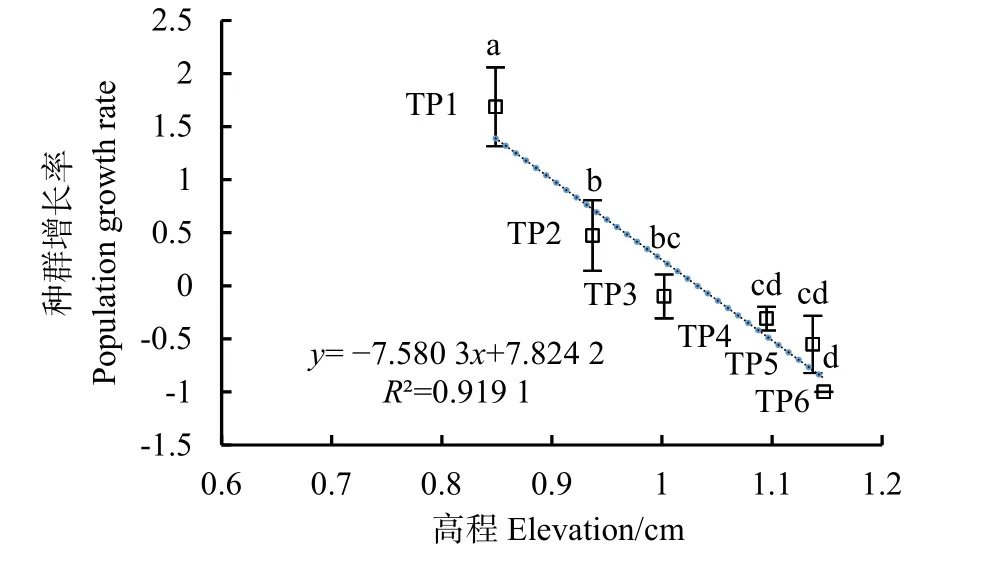
图7 不同高程处互花米草种群增长率Fig. 7 Population growth rate of S.alterniflora at different elevations
2.4 环境因子与互花米草生长特征的冗余分析
对互花米草克隆苗生长特征与环境因子进行RDA分析。互花米草克隆苗生长特征在第Ⅰ轴、第Ⅱ轴的解释量分别为72.4%和2%,累计解释互花米草克隆苗生态特征信息量为74.4%,由此可知前两轴能够很好反映互花米草克隆苗生态特征与环境因子的关系,并且主要是由第Ⅰ轴决定。
环境因子与每个排序轴的相关系数见表2。7个环境因子中,高程与第Ⅰ轴相关系数最大,达0.720,淹水时长、淹水频率、平均淹水深度均与其呈负相关关系,相关系数为0.809,说明第Ⅰ轴反映了潮汐变化导致的影响;温度与第Ⅱ轴的相关系数最大,为 0.457,说明了第Ⅱ轴是以土壤温度为主带来的影响。
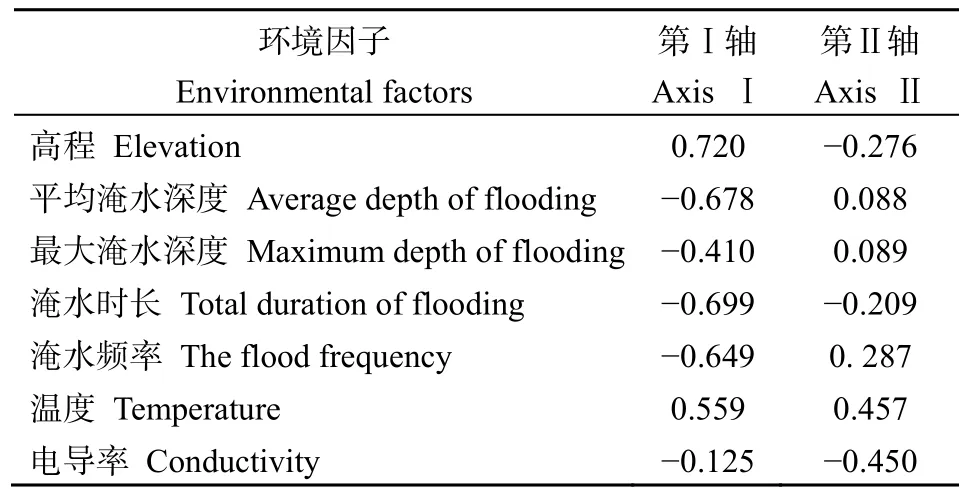
表2 环境因子与排序轴的相关关系Table 2 Correlation of environmental factors with the axes
进一步得到互花米草克隆苗生长特征与环境因子的二维排序图(图8)。在排序图中,互花米草克隆苗生长特征指标用实心三角形连线表示,环境因子用空心三角形连线表示。连线的长短表示互花米草克隆苗生长特征与环境因子关系的大小,连线越长相关性越大,反之则越小;箭头与排序轴的夹角表示相关性的大小,夹角越小,相关性越大。从图8可以看出:互花米草克隆苗密度与平均淹水深度、淹水时长、淹水频率呈正相关关系,其中与平均淹水深度相关性最大,与高程、温度呈负相关关系;互花米草克隆苗株高与淹水时长、电导率、平均淹水深度呈正相关关系,其中与淹水时长相关性最大,与温度呈负相关关系;基径、叶长、叶宽则与温度呈正相关关系。
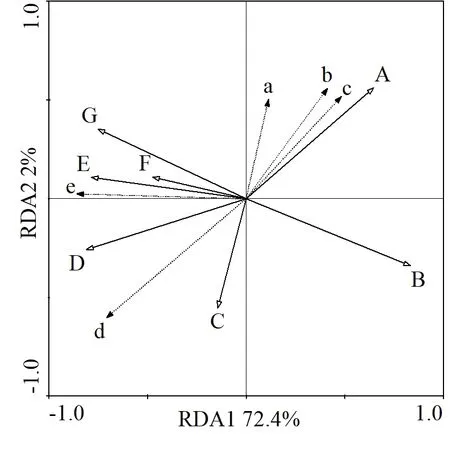
图8 互花米草克隆苗植物特征与环境因子关系的冗余分析排序图Fig. 8 Biplot of the two axes of RDA(redundancy analysis)for environmental factor with growth characteristics of clonal ramets of S. alterniflora
对7个环境因子进行蒙特卡洛检验,得到环境因子变量的重要性排序,结果如表3所示。环境因子对互花米草克隆苗影响的重要性由大到小依次为高程、淹水时长、平均淹水深度、淹水频率、温度、最大淹水深度、电导率。其中高程、淹水时长、平均淹水深度、淹水频率、温度均对互花米草克隆苗生长特征的影响极显著(P=0.002<0.01),但仅高程的解释量占所有环境因子解释量的比例超过50%。
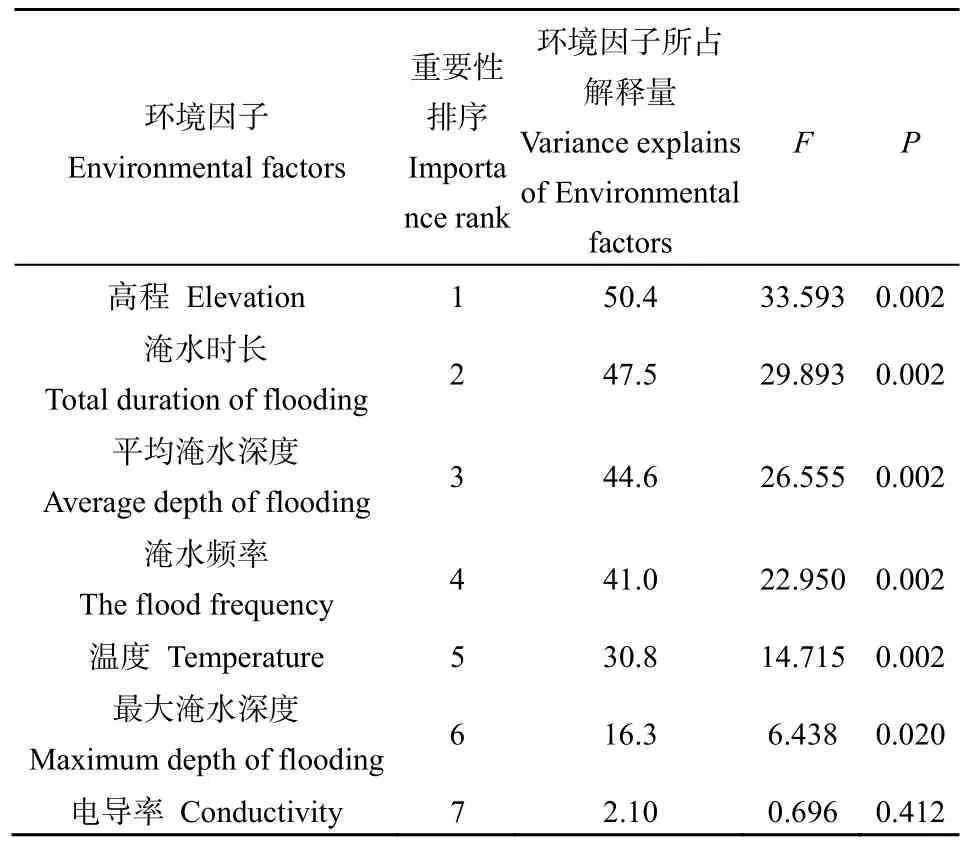
表3 环境因子变量解释的重要性排序和显著性检验结果Table 3 Importance and signification level of environmental factors
3 讨论
3.1 潮滩不同高程处的环境差异及其对互花米草的影响
高程基本决定了潮汐影响的强弱,一般来讲,高程越高,受潮汐影响越小,本研究的相关性分析表明,高程与潮汐变化数据(平均淹水深度、淹水时间、淹水频率、最大淹水深度)有良好的线性关系,不同高潮处的淹水时长有显著差异(P<0.05)。互花米草具有发达的通气组织,可以提高根系周围土壤的溶氧度,因此根系可以进行正常呼吸并吸收养分,能在潮汐浸淹的低潮区生存(Bertness,1991)。然而,互花米草的入侵和扩散仍受到潮汐淹水状况的显著制约,本研究发现,最大淹水深度和淹水频率是影响不同高程处互花米草克隆苗密度的最重要的环境因子,在上海崇明东滩的研究也发现,淹水时间和淹水深度较低的区域,互花米草的入侵力更强,存活率更高(赵志远等,2018)。另外,潮汐水动力会直接对繁殖体与幼苗产生作用力而导致幼苗衰竭,因此,潮汐水动力和潮水频率是预测盐沼植被分布必须考虑的物理扰动因素(Hu et al.,2015)。
李伟等(2018)研究发现,互花米草存活率随着淹水盐度的增加呈下降趋势,其株高和生物量都随盐度的增加呈先增后减的趋势,其生长的最适盐度为10‰,存活的耐盐阈值为43‰。也有研究发现,淹水盐度在0—35‰之间时,互花米草存活率没有显著差异,但淹水盐度升高会抑制互花米草克隆苗密度、株高和地上生物量(Xue et al.,2018)。本研究中,随着高程增加,土壤电导率变化不显著,但土壤温度呈现增加趋势,且土壤温度是影响不同高程处互花米草密度的重要环境因子。在纬度梯度上,温度是影响互花米草密度、株高、节长和生物量等性状的最主要因子(赵相健等,2015)。
本研究中,互花米草繁殖能力和种群增长率与高程呈显著负相关关系,但有研究发现互花米草存活率和株高等性状与高程呈正相关关系(刘潞等,2019;朱晓泾等,2019),这可能是因为不同研究区域的高程范围差异很大,对互花米草存活起决定性作用应该是因高程而异的潮汐淹水状况和土壤盐度等因子。
3.2 互花米草向陆扩散的高程阈值
适宜的潮水有利于互花米草的有性繁殖与无性繁殖,由于高程升高导致的有限的潮水作用及与本地物种的竞争,高潮滩互花米草种子活性与成体生长受到抑制(祝振昌等,2011),因此,互花米草的向陆扩散很可能存在高程阈值。在互花米草扩散过程中,很难将有性繁殖与无性繁殖剥离开,偶然的长距离扩散对种群快速扩散十分重要(刘会玉等,2015)。本研究中,实生苗存活区的环境条件适宜互花米草实生苗生长,只要潮水运送的种子能在此发芽定植,便可生长繁殖,因此实生苗存活区可被视为互花米草当前扩散区,而在高程更高的高潮滩,虽然目前实生苗无法存活,但克隆苗可以存活,如果经过长期适应后互花米草种子可以在这种高潮滩环境中发芽生长,那么未来互花米草便可扩散至该区域,因此克隆苗存活区可被视为互花米草潜在扩散区。大量的互花米草种子可被潮汐运送至TP6即柽柳分布区,但在2019年春季调查时,TP1—TP6各移栽点均为发现自然萌发的实生苗。TP2位于光滩与盐地碱蓬交界处,移栽于该处的实生苗和克隆苗均存活至生长季末,至次年8月时种群增长率为47%,说明TP2是互花米草适生区,互花米草可以很快扩散至TP2即盐地碱蓬种群边缘,从而与盐地碱蓬产生生态位竞争。TP3的互花米草实生苗于移栽 3个月后全部死亡,说明当前互花米草难以扩散至TP3即盐地碱蓬分布区的中间地带。TP5存活的互花米草克隆苗在第 2年继续繁殖并存活,TP6存活的互花米草克隆苗在第2年8月时已经死亡,这说明,互花米草种子如果经过长时期的适应后能在 TP5萌发存活,互花米草可从盐地碱蓬边缘继续向高潮滩扩散,直至芦苇区域。但是难以扩散至TP6即柽柳区。然而需要注意的是,由于TP3—TP5的互花米草种群增长率均小于0,这些区域目前存活下来的互花米草能否在未来几年继续存活,还有待继续跟踪调查。另外,如果互花米草根茎在特殊情况下被潮水运送至高潮滩,可能会加速互花米草的向陆扩散。
4 结论
高程会限制盐沼互花米草的有性繁殖与无性繁殖,对有性繁殖的抑制作用大于无性繁殖。在黄河三角洲,互花米草当前可通过种子的有性繁殖扩散至盐地碱蓬分布区,与盐地碱蓬产生生态位竞争,互花米草的无性繁殖的环境适应能力更强,克隆苗可在高程更高的芦苇分布区存活。因此,中国北方互花米草防控刻不容缓,首先应有效控制互花米草种子的有性繁殖,限制或阻止其通过种子进行远距离扩散,其次,应加快互花米草控制步伐,如果不进行人为控制,当互花米草种子适应了高潮滩环境,互花米草很可能向陆地方向进一步扩张,与本土植被芦苇和柽柳产生直接竞争,扩大其对潮间带生态系统的威胁。

