试值代入法计算盐水溶液的pH值
郝绍鹏
(金堆城钼业股份有限公司化学分公司,陕西渭南,714000)
在教学、科研和化工生产中经常需要计算盐水溶液的pH值,在已知各平衡常数和溶质浓度计算pH值时,通常采用消元整理后解关于[H+]一元高次方程。由于目前没有精确表达高次方程根的方法,计算方法主要分为两大类:一类是在解方程前先进行近似处理,然后由简化的近似求解公式求解的粗略计算[1,2];另一类是依托高次方程使用二分法、迭代法等并借助计算机进行精确计算[3,4]。近似公式求解采用了近似处理前置的处理方式,在缺乏大量实验数据印证的情形下,无法评估其计算结果的偏差。二分法、迭代法进行精确计算时,将化学问题高度抽象成数学运算,不易感知计算过程与化学原理之间的联系,同时采用此类方法需要较高的数学逻辑认知或专业软件辅助,在实际应用中也不易实施。
若将[H+]也看作是已知值,代入所有过程等式,则各等式应全部成立。此时的计算过程是一组数字简单、大量的混合运算以及数量比较,不再涉及复杂的高次方程解法。
1 计算原理
1.1 主要运算式
设有正盐或酸式盐MzZm的水溶液体系,碱离子Mm+进行n级水解,强碱盐n=0,弱碱盐n=m;阴离子Zz-全部以Xx-、Yy-及其水解产物的形式存在,Yy-发生y级水解;Xx-发生a级水解,同多酸根体系a=x,体系无同多酸根a=0;Xx-、Yy-、Zz-中特征元素原子个数分别为s、t、r(如碳酸根、碳酸氢根中的碳元素)。建立其物料平衡式(MBE)和电荷平衡式(CBE),并将两式中的各平衡浓度用[Xx-]、[Yy-]、[H+]表示,整理出方程组及其解的表达式;建立[Xx-]、[Yy-]之间关系式的通式(以下简称试算式)。如图1。

图1 主要算式及说明
对于给定的盐,各参数和试算式确定。各平衡常数和溶质浓度已知时,每试选一个[H+]的猜测值,可算出方程组的解,代入试算式中可算出k的一个试算值(为了避免混淆,称平衡常数k的实际值为目标常数,试值代入计算所得的k值称为试算值)。与目标常数最接近的试算值所对应的[H+]猜测值,即为所要计算的氢离子平衡浓度,进而算得pH值。
1.2 试值选择
分组选取pH值实现对[H+]的试值选择。选取p组pH值,各组内pH值为等差数列,各组的公差依次减小且成等比数列,公比为1/q。第二组及其后各组均有2q-1个pH值,最后一组的公差小于所需精度,第一组结合第二组使全部选值可覆盖pH值1至14。从第一组开始依次代入计算,选取最接近目标常数的试算值对应的pH值,作为后一组pH值的中位数。
第一组在理论pH值附近捕获一个节点,其后各组在捕获的节点附近提高计算精度并逼近理论值。上述选值中的重复取值,是为了便于文字描述和电子表格编辑,实际应用中可合理避免。
2 计算的实现
使用EXCEL电子表格作为工具,对水解不高于7级、pH值1至14范围内的体系进行计算,计算流程、中间辅助计算值、主要函数公式见图2。图中指数差指试算值常用对数与目标常数常用对数的差的绝对值;获得计算结果与获取中位数所用函数相同,改变其计算单元格范围即可。

图2 软件计算流程示意图
3 计算示例
示例中第一组9个pH值,中位数为7,公差1.458;各组公差之间的比例为3,共8组;pH值精度±0.000667。
3.1 同多酸盐计算示例
鉴于同多酸盐在水溶液中的平衡状态比较复杂,这里将(NH4)6Mo7O24水溶液体系视为仅有两种同多酸根,以此为模型介绍同多酸盐水溶液pH值的计算,参数设置和水解见表1[5,6]。对1mol/l、0.1mol/l、0.01mol/l、0.001mol/l、0.0001mol/l(NH4)6Mo7O24水溶液pH值的计算结果分别约为5.855、5.461、5.045、4.614、4.26。

表1 同多酸盐水解
3.2 正盐、酸式盐计算示例
分别以Na3PO4、Na2HPO4、NaH2PO4水溶液pH值的计算为例,参数设置和水解见表2[6],计算结果见表3[1]。

表2 正盐、酸式盐水解
计算多元弱酸正盐和酸式盐水溶液的pH值,不仅可以获得相对精确的结果,而且从计算过程可以观察到一些现象。如表2中三种盐的参数设置只有z(阴离子价态)不同,结合表3数据可知,浓度相同时,参数z的变化引起计算结果的变化。再如表3中,比较指数差可以发现,在相同精度内,NaH2PO4的指数差明显较大;通过增加计算行提高计算精度,pH值精度达到约±3.76×10-9时,指数差分别为0.03(1mol/l)、0.06(0.01mol/l)、0.003(0.0001mol/l)。
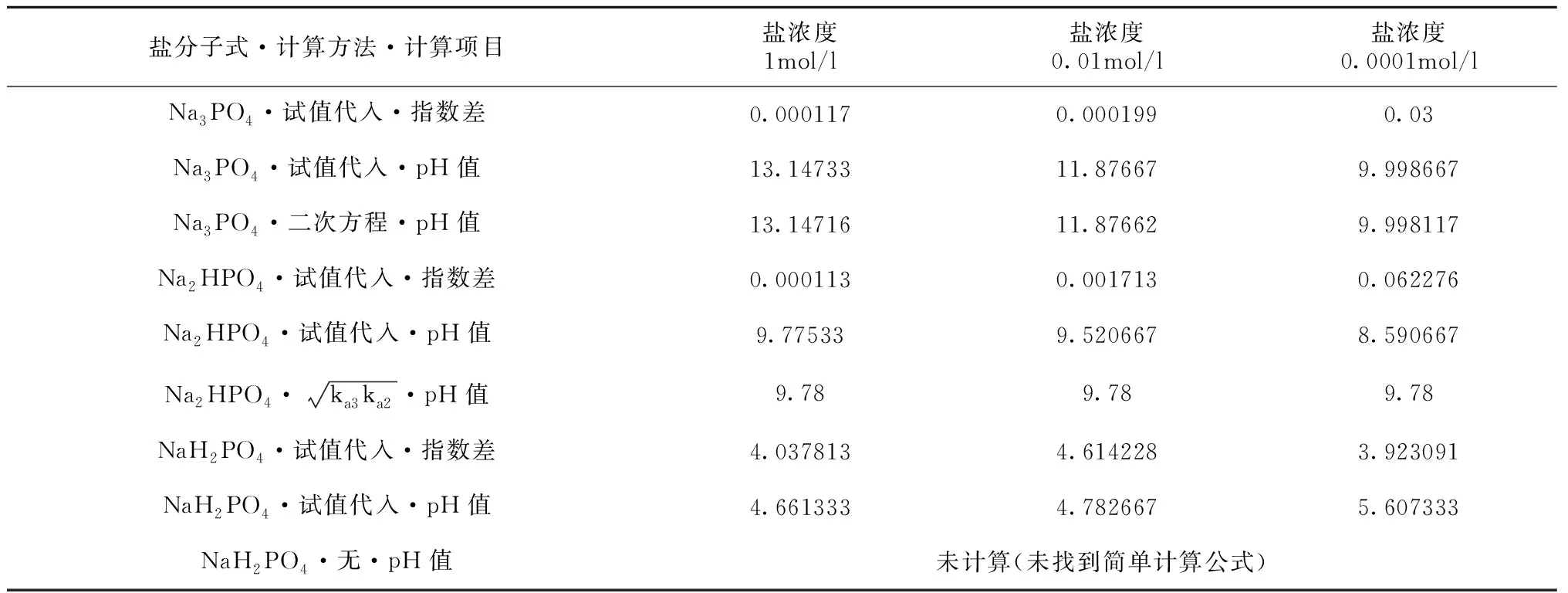
表3 正盐、酸式盐水溶液pH值计算对比
4 总结与结论
试值代入法为计算pH值提供了一种新的思路,将推导高次方程求根公式的难点转化为大量简单计算,再利用电子表格实现求值,获得了良好的效果。
此方法计算范围广泛,可以完整地实现对正盐、酸式盐水溶液pH值的计算,可以尝试对同多酸盐水溶液pH值的计算。虽然在电子表格中的编辑和设置比较复杂,需要足够的耐心和细致;但此方法的过程原理简单,且可用日常办公软件实施,不需要高深的理论知识和专业软件即可实现对pH值的高精度计算,仍然适用于广大教学和技术研究人员使用。
除计算结果在所需精度内做近似处理外,计算过程中不做其他近似,完整考虑了水的离解和酸碱的各级水解,使计算结果获得较高的精度。且从过程中可观察到一些现象,如阴离子价态对pH值计算结果有影响;观察指数差用以评估偏差等。

