黑苦荞茎叶对2型糖尿病小鼠的治疗作用及其对肝脏的影响
肖敏 项伟玲 包其郁 高国辉



【摘要】目的:观察黑苦荞茎叶(BBL)对2型糖尿病小鼠肝脏影响,并探讨其作用机制。方法:将40只SPF级雄性C57/BL6小鼠随机分为正常对照组(NC组,n=10)和实验组(n=30),正常对照组全程给予普通饲料喂养,实验组给予高糖高脂饲料喂养1个月后,通过腹腔注射链脲佐菌素的方法建立糖尿病小鼠模型。成功建立2型糖尿病(T2DM)小鼠模型后,随机分为3组(n=10):模型对照组(DM组),低剂量黑苦荞茎叶治療组(DM+L)组,高剂量黑苦荞茎叶治疗(DM+H)组。4组小鼠分别每日给予生理盐水、生理盐水、黑苦荞茎叶(0.21g/kg.d-1)、黑苦荞茎叶(0.42g/kg.d-1)灌胃14天。实验结束后,全自动生化分析仪检测血清中丙氨酸转氨酶(ALT)、天门冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、甘油三酯(TG)、游离脂肪酸(FFA)的变化;ELISA试剂盒检测血清胰岛素(INS)、葡萄糖-6-磷酸酶(G-6-P)蛋白含量;HE染色镜下观察肝组织的形态学变化;实时荧光定量PCR法检测肝脏中磷酸烯醇式丙酮酸羧激酶(PEPCK)mRNA的相对表达变化;western-blot检测肝脏组织内胰岛素受体p-IRS-1蛋白的表达。结果:黑苦荞茎叶(BBL)治疗组可以显著降低小鼠血清ALT、AST、ALP、FFA、TG、INS水平;肝组织HE染色结果显示,与正常组比较,DM组肝小叶结构紊乱,肝细胞明显脂肪变形,肝细胞胞浆内出现大量小空泡,而BBL治疗组有不同程度的减轻;肝组织PCR结果显示,与DM组比较,BBL治疗组小鼠肝脏PEPCKE mRNA表达量明显增加,肝脏组织内胰岛素受体p-IRS-1蛋白表达明显上升。结论:黑苦荞茎叶(BBL)对糖尿病小鼠有显著的治疗效果,对糖尿病小鼠的肝脏有一定的保护作用。
【关键词】黑苦荞茎叶;2型糖尿病; IRS-1;INS;胰岛素敏感性;
【中图分类号】 R587.1 【文献标识码】 A 【文章编号】
2型糖尿病,一个复杂的代谢紊乱性疾病。近年来,糖尿病患病率、发病率和糖尿病患者数量急剧上升[1]。胰岛素抵抗( insulin resistance,IR)[2]是2型糖尿病发病的重要原因和主要特征,它的存在使机体糖代谢器官对葡萄糖摄取和利用的效率下降( 主要是肝脏、肌肉和脂肪组织)[3],进而代偿性分泌更多的胰岛素。胰岛素的敏感性主要用于描述胰岛素抵抗的程度,当器官对胰岛素敏感性越低,胰岛素越难以发挥作用,分解糖类的能力也越低。糖尿病病程进展中,当血糖水平得不到有效控制,会引起多脏器的微血管病变和大血管病变、糖尿病足、神经系统并发症、口腔及眼科并发症。如何预防糖尿病发生、控制血糖水平及延缓糖尿病并发症发生的治疗方法引起了人们越来越多的关注。黑苦荞茎叶在中国是一种非常重要的具有可食用和医用价值的植物,已经有许多研究证明黑苦荞茎叶与高血糖症的低发病率和改善糖尿病患者的糖耐量有关[4,5]。黑苦荞茎叶提取物[6]对身体有益影响与它有高含量的黄酮类物质有关,特别是槲皮素和芦丁等成分[7]。芦丁,作为黑苦荞茎叶的有效成分之一,因为它能保护胰岛β细胞的完整性,增加GLUT-4的转移,从而使2型糖尿病小鼠血糖下降,进而发挥降糖活性[8]。槲皮素,作为芦丁糖苷配基,通过促进胰岛素分泌,抑制肝脏葡萄糖产生和促进葡萄糖吸收利用[9]。本课题主要阐明黑苦荞茎叶对糖尿病的治疗作用及对肝脏的保护作用。
1 材料与方法
1.1材料
1.1.1实验动物
SPF级雄性C57/BL6小鼠40只,周龄8-9周,购自上海斯莱克试验动物责任有限公司。
1.1.2 实验仪器
WETRUST康麟血糖仪(讯映光电有限公司),全自动生化分析仪( 日本日立公司),CT15RE型台式微量高速离心机(日本日立公司),NanDrop2000核酸蛋白分析仪(Thermo),S1000TM Thermal Cycler梯度PCR仪(Bio-Rad),CFX Connect TM荧光定量PCR检测仪 (Bio-Rad)。
1.1.3 实验试剂
黑苦荞茎叶(购自西安利时生物科技有限公司),链脲佐菌素(购自台州艾明康生物有限公司),蛋白裂解液RIPA(碧云天),逆转录试剂盒(诺维赞),Trizol(invitrogen),SYBR Green(Bio-Rad),SYBR Premix Ex Taq II(Takara), Insulin and actin Primers(上海生工设计) ,小鼠INSR、G-6-P的ELISA试剂盒(购自上海源叶生物科技有限公司),PVDF膜(Millipore Corp,USA),一抗稀释液(Beyotime,China), ECL-化学发光试剂盒(ECL-plus,ThermoScientific), p-IRS-1抗体(华安生物技术有限公司),胎牛血清( 购买于Gibco 公司) ,马血清( 购买于Gibco 公司) ,胰蛋白酶( 购买于Gibco公司) ,,LY294002 ( 购买于碧云天公司),DEPC水(购买于碧云天公司),PEPCK 及β-actin 引物(上海生工公司),CCK8 试剂盒( 购买于日本同仁公司) 。
1.2实验方法
1.2.1 小鼠模型建立及分组
40只SPF级雄性C57/BL6小鼠,经适应性喂养1周后随机分为正常对照组(NC)10只和实验组30只,NC组喂养普通饲料,实验组喂养高糖高脂饲料常规饲料66.5% +20%红糖+ 10%猪油+ 2.5% 胆固醇+ 1% 胆酸盐)。喂养35d后,将小鼠禁食12h后,使用腹腔注射法注射40mg/kg链脲佐菌素(STZ,临用前用 0.1 mol/L 柠檬酸钠缓冲液配成 1%、pH 4.2 的溶液),72h后禁食6h,断尾取血测空腹血糖(( fasting blood glucose,FBG),FBG大于11.6mmol/L)且小鼠出现三多(多饮、多食、多尿)症状,则成功构建糖尿病小鼠模型。NC组腹腔注射等量柠檬酸钠缓冲液。建模成功后将模型小鼠随机分为三组:模型对照(DM)组、低剂量黑苦荞茎叶治疗(DM+L)组、高剂量黑苦荞茎叶治疗(DM+H)组。
1.2.2干预及标本采集
使用生理盐水溶解黑苦荞茎叶(浓度为0.04g/ml),DM+L组小鼠灌胃0.21g/kg.d-1黑苦荞茎叶,DM+H组小鼠灌胃0.42g/kg.d-1黑苦荞茎叶,NC、DM组则灌胃等量生理盐水。14d后,将小鼠禁食6h,称量小鼠体重,断尾取血测量空腹血糖(FBG),摘眼球取血0.6ml血样,离心后取上清于干净的离心管中,利用全自动生化分析仪检測ALT 、AST、ALP、TG、FFA。取各组肝脏标本并编号。部分肝脏组织组织使用4%多聚甲醛固定用于组织包埋,部分肝脏组织液氮速冻后保存于-80℃冰箱冷冻保存。
1.2.3各组小鼠血清中INS和G-6-P蛋白含量的测定
使用ELISA试剂盒检测小鼠血胰岛素含量(INS)、肝脏组织中G-6-P蛋白含量的测定。
1.2.4 肝脏组织的病理学观察
取各组肝脏标本放入对应编号的包埋盒并编号,部分组织使用4%多聚甲醛固定的肝脏标本24-48h,经梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋,切成4μm切片,将切片后的肝脏组织进行HE染色,镜下观察并拍照各组肝脏组织形态变化。
1.2.5 肝组织中胰岛素受体底物P-IRS-1蛋白的表达
通过含有苯甲基磺酰氟的RIPA裂解缓冲液裂解小鼠肝组织,使用增强的BCA蛋白质测定试剂盒测量蛋白质浓度。分离等量的蛋白质并通过SDS-PAGE凝胶电泳并转移到PVDF膜上。5%BSA封闭,一抗(1:1000 稀释)4℃ 过夜。辣根过氧化物酶标记的二抗(1:5000稀释)室温孵育2h,用ECL-化学发光试剂盒使蛋白质条带显影。
1.2.6 肝脏组织IRS-1 mRNA表达量测定
采用Trizol一步法提取小鼠肝脏组织总RNA,逆转录合成cDNA,操作严格遵照试剂盒说明书,用实时荧光定量PCR测定PEPCK mRNA表达量,以β-actin为内参。PEPCK mRNA 上游引物序列5’-TGAAAGGCCGCACCATGTAT-3’;下游引物序列5’- GCACAGATATGCCCATCCGA-3’。反应体系:反应体系20μl:SYBR Green(2×)10μl,10μmol/L上下游引物各0.4μl,ddH2O 7.2μl,模板0.2μl。反应条件: 95℃变性30s;循环40次:95℃变性5 s,55℃退火30 s,72℃延伸34s;融解:95℃15s,60℃ 1min,95℃ 15s;冷却:60℃ 15s。
1.3 统计学处理
结果表示为平均值±SEM。 数据通过SPSS 19.0软件分析,在方差分析的基础上采用q检验,当p <0.05时有统计学意义。
2 结果
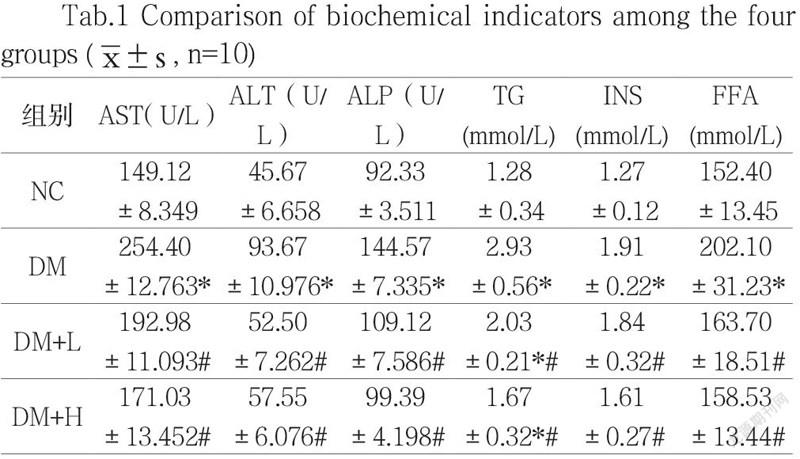
2.1 四组小鼠生化指标比较
与NC组比较,DM组血清中ALT、AST、ALP含量均升高(P<0.05,表1);与DM组比较,DM+L组、DM+H组ALT、AST、ALP均下降(P <0.05),与DM+L组相比,DM+H组小鼠ALT、AST、ALP下降无显著差异(P>0.05)。与NC组相比,DM组血清TG、INS、FFA水平均明显升高(P<0.05);与DM组比较,DM+H组TG、INS、FFA水平均有所下降, DM+L组TG、INS、FFA水平均显著下降(P<0.05,表1)。
2.12四组小鼠血清G-6-P的ELISA结果
与NC组相比,DM组血清G-6-P水平均明显升高;与DM组比较, DM+L组G-6-P水平均显著下降(P<0.05,图1),DM+H组G-6-P水平无明显差异(P>0.05,图1)。
2.2 ; 四组小鼠肝脏组织病理学检查
肝脏组织切片光镜下观察,正常对照组肝小叶结构清晰,肝细胞索排列整齐,肝窦规则,肝细胞无糖原积蓄,无空泡变性,未见明显脂肪变性及炎细胞浸润;模型组肝小叶结构紊乱,肝细胞的胞浆内可见大量小空泡,有的肝细胞内见多个小空泡融合成大空泡,空泡变性,肝细胞核被挤于一边,肝细胞明显脂肪变性,血窦变窄;高剂量组小鼠,肝小叶结构较清晰,肝细胞胞浆内空泡明显减少,仅肝小叶周边少数肝细胞呈脂肪变性改变,只有个别细胞水肿,空泡变性;低剂量组,部分细胞水肿,空泡变性,轻度脂肪变性;与DM组相比,DM+H组和DM+L组相比有不同程度的减轻。(图2)
2.3 四组肝脏组织PEPCK mRNA表达比较
与NC组比较,DM组小鼠肝脏PEPCK mRNA 表达均升高;与DM组比较,DM+L组、DM+H组小鼠肝脏PEPCK mRNA表达均下降(P<0.05,图3),DM+L组与DM+H组PEPCK mRNA表达无显著性差异(P>0.05,图3)。
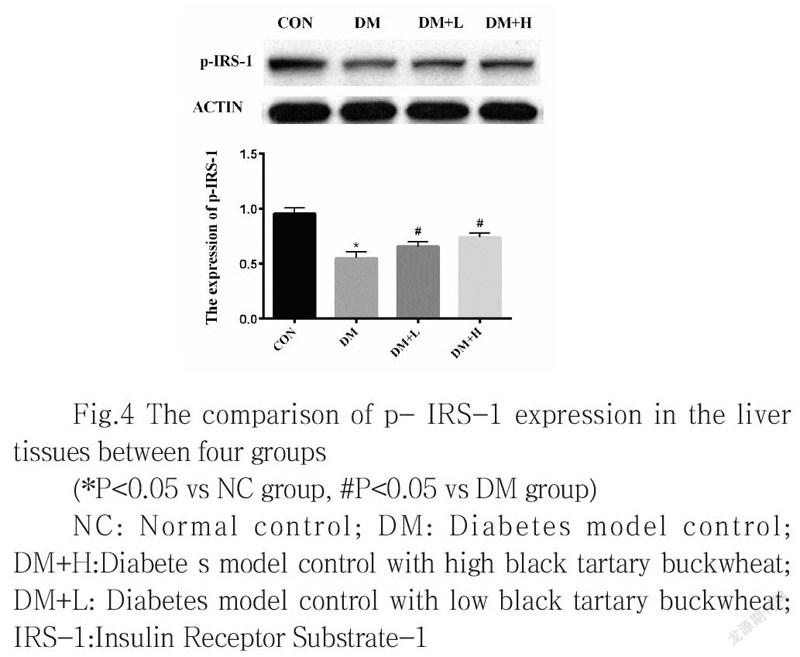
2.4 四组小鼠肝脏组织中胰岛素受体底物p-IRS-1蛋白表达的检测
与NC组比较,DM组小鼠肝脏组织中p-IRS-1的蛋白水平均降低(P<0.05);与DM组比较,DM+H组、DM+L组小鼠肝脏组织中的p-IRS-1的蛋白表达水平升高,其差异均有统计学意义(P<0.05), 与DM+L组相比,DM+H组p-IRS-1蛋白表达无显著性差异(P>0.05,图4)。
3.讨论
糖尿病是内科慢性常见疾病,由多病因引起以慢性高血糖为特征的代谢相关性疾病,是由于胰岛素分泌和(或)利用缺陷所引起。2型糖尿病是从以胰岛素抵抗为主伴胰岛素进行性分泌不足,到以胰岛素进行性分泌不足为主伴胰岛素抵抗,它与氧化应激增加,氧自由基增加以及抗氧化防御系统降低密切相关。黑苦荞茎叶被证实与高糖症的低发病率和改善糖尿病患者的糖耐量有关,这与它有高含量的黄酮类物质有关,特别是槲皮素类和芦丁等有效成分,可以促进循环中葡萄糖利用,促进胰岛β细胞分泌胰岛素,经ERK1/2通路保护胰腺β细胞对抗氧化应激,从而发挥拟胰岛素活性和抗氧化作用[10]。
本研究的结果表明,黑苦荞茎叶对C57/BL6糖尿病小鼠有显著的治疗效果。表现为经黑苦荞茎叶治疗后C57/BL6糖尿病小鼠糖耐量改善,谷丙转氨酶(ALT)、谷草转氨酶(AST)、碱性磷酸酶(ALP)、甘油三酯(TG)、游离脂肪酸(FFA)均降低,肝细胞中的PEPCK mRNA均明显降低,p-IRS1蛋白的表达也显著降低,血清中的INS、G-6P分泌增加。表明黑苦荞茎叶可以增加C57/BL6糖尿病小鼠的血糖耐受能力,保护肝脏避免高糖环境下引起的氧化应激损伤[11]。2型糖尿病发病通常经过两个阶段,一开始是糖耐量减低的发生,此时IR起主要作用,之后IR和β细胞的胰岛分泌受损同时加重导致直接发展成为临床DM。胰岛素抵抗包括糖利用障碍,胰岛素作用的靶细胞(如肝细胞、骨骼肌细胞和脂肪细胞等) 摄取和利用葡萄糖受阻,骨骼肌细胞是利用葡萄糖进行有氧代谢,产生ATP,当肌细胞对糖的吸收和利用受阻,同时没有其他外界刺激促使骨骼肌细胞重新对葡萄糖进行摄取和利用,此时便会发生胰岛素抵抗。
综上所述,黑苦荞茎叶提取物可以提高糖尿病小鼠的糖耐量,降低血清肝脏转氨酶,保护肝功能,降低血脂,促进胰岛素分泌,显著上调PEPCK mRNA表达,上调p-IRS1蛋白的表达,减少高糖带来的对肝脏的损伤,从而发挥其治疗糖尿病和保护肝脏的作用。
1. Uloko, A.E., E.N. Ofoegbu, S. Chinenye, et al., Profile of Nigerians with diabetes mellitus - Diabcare Nigeria study group (2008): Results of a multicenter study. Indian J Endocrinol Metab, 2012. 16(4): p. 558-64.
2. Mechanism of resveratrol on improving insulin resistance in adipose tissue of mice with hyperlipidemia. Acta Universitatis Medicinalis Anhui, 2014. 49(8): p. 1104-1109.
3. Guo, S., Insulin signaling, resistance, and the metabolic syndrome: insights from mouse models into disease mechanisms. J Endocrinol, 2014. 220(2): p. T1-T23.
4. Karki, R., C.H. Park,D.W. Kim, Extract of buckwheat sprouts scavenges oxidation and inhibits pro-inflammatory mediators in lipopolysaccharide-stimulated macrophages (RAW264.7). J Integr Med, 2013. 11(4): p. 246-52.
5. Zhang, H.W., Y.H. Zhang, M.J. Lu, et al., Comparison of hypertension, dyslipidaemia and hyperglycaemia between buckwheat seed-consuming and non-consuming Mongolian-Chinese populations in Inner Mongolia, China. Clin Exp Pharmacol Physiol, 2007. 34(9): p. 838-44.
6. Okada-Iwabu, M., T. Yamauchi, M. Iwabu, et al., A small-molecule AdipoR agonist for type 2 diabetes and short life in obesity. Nature, 2013. 503(7477): p. 493-9.
7. Fabjan, N., J. Rode, I.J. Kosir, et al., Tartary buckwheat (Fagopyrum tataricum Gaertn.) as a source of dietary rutin and quercitrin. J Agric Food Chem, 2003. 51(22): p. 6452-5.
8. Niture, N.T., A.A. Ansari,S.R. Naik, Anti-hyperglycemic activity of rutin in streptozotocin-induced diabetic rats: an effect mediated through cytokines, antioxidants and lipid biomarkers. Indian J Exp Biol, 2014. 52(7): p. 720-7.
9. Babu, P.V., D. Liu,E.R. Gilbert, Recent advances in understanding the anti-diabetic actions of dietary flavonoids. J Nutr Biochem, 2013. 24(11): p. 1777-89.
10. Hu, Y., Z. Hou, D. Liu, et al., Tartary buckwheat flavonoids protect hepatic cells against high glucose-induced oxidative stress and insulin resistance via MAPK signaling pathways. Food Funct, 2016. 7(3): p. 1523-36.
11. Alam, F., M.A. Islam, M.I. Khalil, et al., Metabolic Control of Type 2 Diabetes by Targeting the GLUT4 Glucose Transporter: Intervention Approaches. Curr Pharm Des, 2016. 22(20): p. 3034-49.
(1.溫州医科大学检验医学院 生命科学学院,浙江 温州325035)

