启发思维在化学实验设计及评价中的应用
李玉亮



摘 要:本文采用分割问题启发、递进启发、假设启发与对比启发等方法对苏教版必修一专题4《硫、氮和可持续发展》中的化学实验设计进行教学,发现启发思维在化学实验设计及评价中的应用,教学效果很好。
关键词:启发思维;实验设计验证;评价
化学是一门以实验为基础的自然科学,是可以提高生活和生命质量的科学。自“3+1+2”高考方案实施以来,据调查,选择化学科目的学生大量减少,这个现象令人担忧。作为一名高中化学老师,我们要不断调整自己的教学方法,让化学课堂更加生动、有趣;让学生想学化学、爱学化学!
高考对化学实验内容的考查要求:①设计实验方案;②正确选用实验装置;③掌握控制实验条件的方法;④预测或描述实验现象、分析或处理实验数据,得出实验结论;⑤评价或改进实验方案。对于高一新生,个体化学水平参差不齐,遇上综合性较强的题目往往无从入手,这样就容易产生对化学的恐惧心理,觉得化学很难,这就需要教师在平时的教学中善于设计启发性问题,由易到难,层层深入,逐一解决问题,启发思维与实验设计的有机结合,能帮助学生攻克化学难题,这对于培养学生的综合能力也是十分重要。
启发教学是指教师对学生的思维进行的引导行为。它可以指导学生思考、深层领悟。
启发性原则就是教师在课堂上要承认学生的主体地位,千方百计想方设法调动学生学习的积极性主动性,引导学生合作互助积极思考,勇于探索,提高学生分析问题和解决问题的能力。本文主要谈谈启发思维在化学实验设计及评价中的应用。
一、分割问题启发与递进启发
启发教学重在启发,以学生为主体,对困难的问题进行分割啟发,设立问题情境,引导学生质疑问题,合作释疑,归纳总结,最终将问题逐一击破。最后教师引导学生对同种类型的问题进行类推启发,在学生理解的基础上,进一步深挖,达到理解透彻的目的。
案例一:C+2H2SO4 (浓)=加热==CO2↑+2SO2 ↑+2H2O
思考:如何设计实验,逐一验证上述反应产物?
(教学背景:对于初学含硫化合物性质的高一学生来说,设计实验逐一验证碳与浓硫酸的反应产物,有一定困难,我首先提供出一些实验装置,以抛出问题的形式,把设计实验分割成一套套独立的检验装置,启发学生主动思考)
分割启发思维:
1.让学生说说每个装置在检验过程中所起的作用?
2.验证产物时应有怎样的前后顺序?若装置顺序改变,对验证结果是否有影响,为什么?
3.CO2和SO2都能使澄清石灰水白色浑浊,检验CO2时如何排除SO2的干扰?
学生积极参与,逐一解决问题,最终成功的把整套实验装置完美的链接起来。
递进启发思维:
①能否把装有无水硫酸铜的干燥管移到装有澄清石灰水的试剂瓶后连接呢?请说明理由?
②能否把酸性高猛酸钾溶液和澄清石灰水间的品红溶液省掉?若可以,应该符合什么条件?
③酸性高猛酸钾的作用是用来除去二氧化硫,能否用氯水或溴水替代酸性高猛酸钾呢?
如果可以,分别会有怎样的实验现象?
④证明有二氧化碳产生的实验现象应该怎样表述?
教师通过递进启发性问题引领学生不断思考不断探究,让学生觉得化学课堂太有趣了,就像是在解决“十万个为什么”,而老师那里好像永远都有无数个“为什么”,化学老师就像是神奇的魔术师。教师通过一个个启发性问题的抛出和引导学生不断地解决问题,使得师生间、学生间的情感产生碰撞,拉近了彼此间的距离,进而有效地提高教学质量,建立了化学老师在学生心中的偶像地位。
案例二:设计一套实验装置,逐一验证二氧化硫的性质。
(教学背景:在学生学习完二氧化硫的物理性质与化学性质之后,引导启发学生,设计一套实验装置,逐一验证二氧化硫各个化学性质。)
分割启发思维:
1.验证SO2各化学性质分别需要选择什么装置?验证过程中能观察到什么实验现象?
2.这些装置需要有怎样的先后顺序?
3.SO2有毒,验证实验结束,是否需要尾气处理,选择什么试剂对SO2进行吸收处理?
有了以上经验,问题一抛出,学生马上开始罗列各个实验装置,①验证SO2是酸性氧化物可选择紫色石磊试液;②验证SO2的漂白性可选择品红溶液③SO2通入硫化钠溶液中产生黄色沉淀可验证SO2氧化性④SO2使酸性高猛酸钾褪色、SO2使氯水、溴水褪色都可用来验证SO2的还原性。学生负责设计,教师负责在黑板上把装置图画出来,师生齐力合作,共同完成实验设计。此时教师可以采用提问的方式,让学生自己组织语言,把各个装置的作用及实验现象描述出来,而老师只需在一旁做必要的补充,如此递进启发,反复强调,加深了学生对实验的理解。
二、假设启发与实验验证
在设计化学实验方案时,教师可以鼓励学生大胆做出假设,讨论实验方案,设计实验步骤,依据实验操作,观察实验现象,做好实验记录,实验结束时,学生可以根据实验事实验证实验假设,最终得出结论。
案例三:SO2使滴有酚酞的NaOH溶液红色褪去原理探究。
教师演示实验:将新制的SO2通入滴有酚酞的NaOH溶液中,观察到溶液红色褪去。
启发问题:产生上述现象原因可能有两种:①酚酞遇碱变红,将SO2通入滴有酚酞的
NaOH溶液中,SO2消耗NaOH,削弱溶液碱性,使得溶液红色褪去。②SO2有漂白性,可能使指示剂失效,能否设计实验证明是哪一种原因产生的褪色现象?如何设计实验?
学生讨论结果:继续向褪色的溶液中滴加NaOH,若溶液恢复红色则说明SO2是酸性氧化物,若溶液仍为无色说明SO2有漂白性;教师可以邀请一位学生上台演示实验:往褪色的溶液中继续滴加NaOH溶液。
实验证明:往褪色的溶液中继续滴加NaOH溶液,溶液重新恢复红色。说明SO2不能漂白酸碱指示剂。
三、对比启发,谨防混淆
对比启发常用于易混淆知识的教学,可通过对知识内容的概念,研究对象,本质特征进行比较,提高学生对易混知识的鉴别能力,进而更好的掌握所学知识。
案例四:浓硫酸吸水性与脱水性性质判断。
高一新生容易混淆浓硫酸吸水性和脱水性,此时可应用对比启发教学。首先概念对比:吸水性是指浓硫酸吸收现成游离的水分子。脱水性是指浓硫酸将有机物中的H、O按原子个数比2:1(即水的组成比例)脱去。对比结论:吸水性的对象原来就有水;脱水性的对象原来没有水。吸水性的本质特征:对象由潮湿变干燥;脱水性的本质特征:即是碳化,对象由干燥状态变黑(有碳生成)。在学生已有的理论基础上,辅以实验分析,能收获意想不到的效果。
随堂检测:下图所示三种实验方案,能验证浓硫酸吸水性质的是:
解析:A、饱和硝酸钾溶液中的水被浓硫酸吸收,导致溶剂减少,溶液过饱和,故有白色晶体析出,体现浓硫酸的吸水性。B、苹果块中的水分被浓硫酸吸收,苹果块会干瘪,体现浓硫酸吸水性。C、pH试纸本身是干燥的,不含水分。但因为试纸是有机物,含有碳、氢、氧等元素,浓硫酸能将pH试纸中的氢和氧元素按水的组成脱去,使试纸变黑,体现浓硫酸的脱水性。对比启发,重在对比,越比较越清楚。
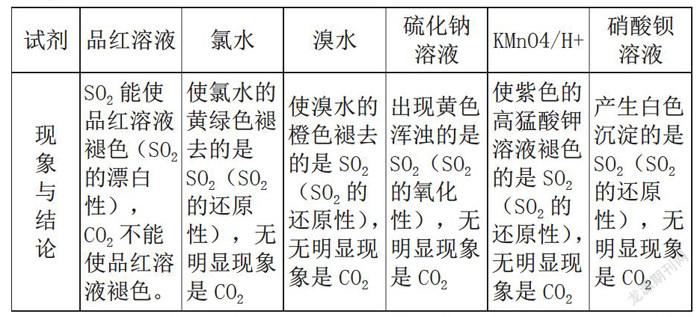
又如:SO2与CO2都是酸性氧化物,二者都能使澄清石灰水变浑浊,并且如果通入过量气体,则生成的沉淀可以再溶解。为了使学生能更好区别掌握这两种气体。我们可以对比归纳如下:
通过对知识点的归纳比较,能帮助学生把学过的知识联系起来,形成知识网络,固化知识;还能帮助学生辨析差异,谨防混淆。教师通过设计启发性问题,或是对复杂问题进行分割,或是大胆提出实验假设,或是对比启发教学,能激发学生学习兴趣,引导学生更好地完成实验设计,学生探索性、参与性强;突出了以学生为主体,教师为主导的授课方式。在交流互动中,学生的思维方式和思维能力均得到了提高,有利于培养学生的创新能力,有利于落实“双主模式”的教学。
四、教学反思
授课过程中,发现学生在处理实验设计和评价时,一般会存在以下问题:①对实验原理理解不够深入;②对仪器选择,实验操作不够自信;③对“题眼”入手,把控不够精准;④对实验现象的描述不够规范化。这也说明在实验设计及评价的教学中,我们还有很大的挖掘空间。
参考文献
[1] 朱志慧.巧设情镜,让学生发现问题并解决问题[J].化学教与学,2014(11).
[2] 李玉炫.化学实验题的评析及实证[J].化学教学, 2016(2).
[3] 程遇玲.淺谈高中化学学科核心素养的培养[J].中学化学教学参考,2017(7).
[4] 教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018.

