过度抗凝与心脏瓣膜置换术后肾功能损伤的相关性研究
巢璟帆 王珺 周钇宏 沈振亚
摘要: 目的:探讨心脏瓣膜置换术后过度抗凝与术后发生肾功能损伤的相关性。方法:选取32例行心脏瓣膜置换术后经抗凝治疗后出现肾功能损伤的患者纳入肾功能异常组,随机选取34例同期心脏瓣膜置换术后肾功能正常的患者纳入对照组,收集两组病例的临床资料,并对两组病例的过度抗凝情况进行对比分析。结果:①单因素分析显示,两组患者的性别、既往病史、术前口服ACEI或ARB类药物、术前EF%值、术中体外循环时间等因素差异无统计学意义(P > 0.05);肾功能异常组中术前尿常规异常情况、多个瓣膜置换、术后过度抗凝治疗(INR > 3.0)等因素相较于肾功能正常组,差异具有统计学意义(P < 0.05)。②多因素Logistic回归分析显示术后过度抗凝治疗(INR > 3.0)是心脏瓣膜置换术后肾功能损伤的独立危险因素(P < 0.05)。结论:心脏瓣膜置换术后过度抗凝治疗是术后发生肾功能损伤的高危因素。
关键词:过度抗凝 心脏瓣膜置换 肾功能损伤
【中图分类号】S941.42+7 【文献标识码】A 【文章编号】1673-9026(2021)09-089-02
肾功能损伤是心脏术后常见的并发症之一,严重者需行血液透析治疗,可导致多脏器功能衰竭甚至死亡,大大增加了术后住院时间及死亡率。心脏术后发生肾功能损伤有许多危险因素,包括年龄、既往病史、术前使用ACEI或ARB类药物、术前心功能情况、术中体外循环(CPB)时间等等。近年,美国俄亥俄州立大学中心病理部报道了一种由于使用华法林及其他抗凝剂过度抗凝引起的急性肾损伤[1],该中心研究表明,接受抗凝治疗的患者血清肌酐值(Scr)的升高与凝血酶原时间(PT - INR)的升高有相关性,且Scr与华法林呈剂量相关性[2];同时,在过度抗凝的条件下,有慢性肾功能不全的患者较正常患者肾功能更容易发生损害。本文通过随机选取2019年1月至2020年12月苏州大学附属第一医院部分行心脏瓣膜置换术的病例,旨在分析过度抗凝治疗与心脏瓣膜术后肾功能损伤的相关性。
1 材料与方法
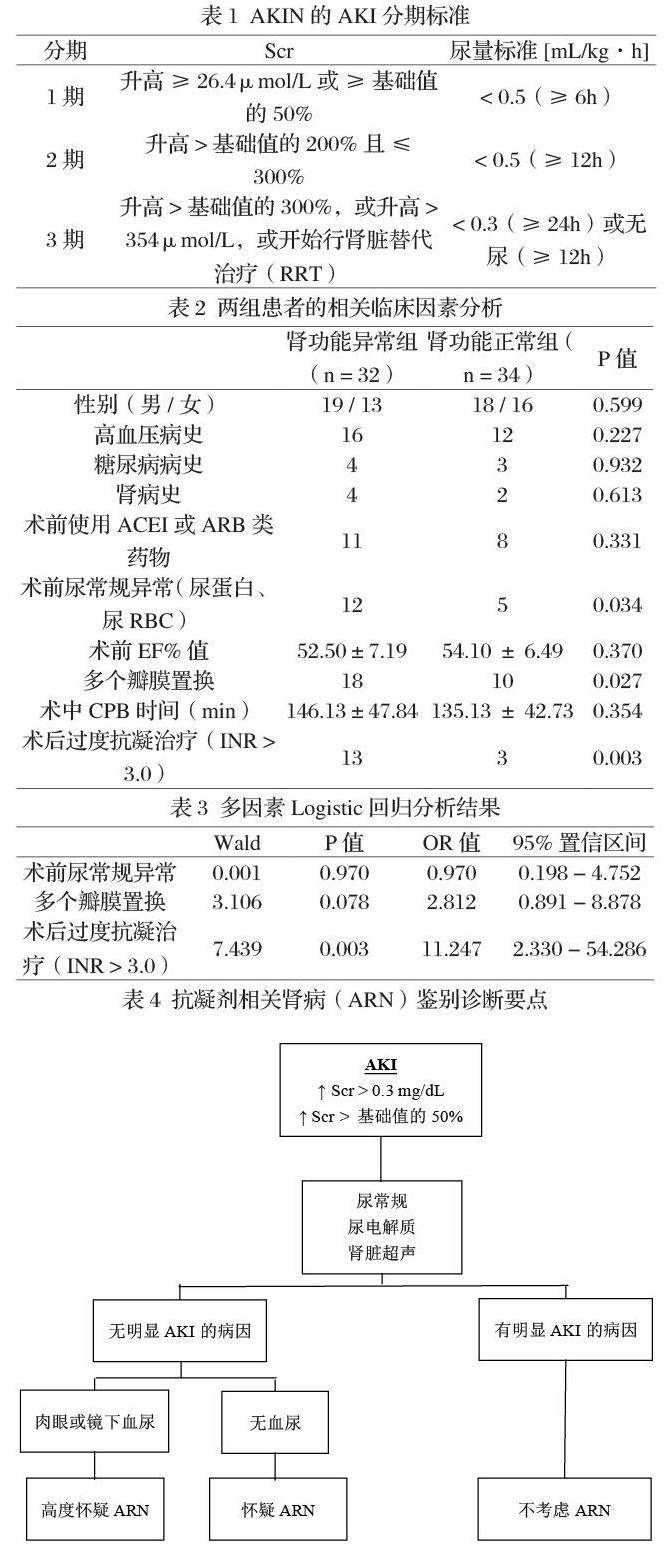
1.1临床资料 选取苏州大学附属第一医院2019年1月至2020年12月行心脏瓣膜置换术的患者66例,其中男性37例,女性29例,年龄30 - 77岁,平均(61 ± 10)岁。2005年,急性肾损伤网络(Acute Kidney Injury Network, AKIN)对急性肾功能损伤(AKI)的诊断及分级标准进行了修订,是目前使用最为广泛的诊断标准。AKIN对AKI的定义如下[3-4]:①48小时内至少两次Scr升高的绝对值≥ 26.5?mol/L或Scr较基础值升高 ≥ 50%;②尿量< 0.5ml/kg·h,时间超过6h。按照AKIN的标准进行AKI分期(表1)。根据该标准选取本研究术后经抗凝治疗后肾功能异常组病例32例,其中男性19例,女性13例,年龄49-77岁,平均(64 ± 9)岁。对照组病例34例,其中男性18例,女性16例,年龄30-75岁,平均(59 ± 12)岁。
1.2方法 对于术前心功能Ⅲ - Ⅳ级或有心功能不全的病人,常规予以口服呋塞米、安体舒通、地高辛行强心利尿治疗,术前积极控制原发基础疾病如高血压、糖尿病等,积极调整心肺功能。所有病例均为心脏直视下的体外循环手术,术中常规予以静脉全身麻醉并行气管插管,在中低温CPB(鼻咽温30-32℃)下进行手术。术中间断予以停搏液灌注保护心肌,术中平均动脉压维持在60 - 75mmHg。术后返回ICU后予以血管活性药物维持循环、呼吸机辅助通气等支持治疗,予以低分子肝素皮下注射桥接抗凝治疗,拔除心包纵膈引流管后予以口服华法林抗凝治疗。对于术后出现肾功能损伤的病人,积极予以强心、利尿、护肾、扩血管等治疗。
1.3统计学方法 采用SPSS 25.0软件进行统计学分析,计量资料以表示,计数资料以例数表示,采用T检验或者卡方检验,选取相关有临床意义的因素进行多因素Logistic回归分析。P < 0.05为差异有统计学意义。
2 结果
单因素分析显示,两组患者的性别、高血压病史、糖尿病病史、肾病病史、术前使用ACEI或ARB类药物、術前EF%值、术中CPB时间等因素无明显差别;术前尿常规异常情况、多个瓣膜置换、术后过度抗凝治疗(INR > 3.0)在两组之间有明显差别。在肾功能异常组中,术后过度抗凝治疗(INR > 3.0)的例数共有13例,而在肾功能正常组中共有3例,两组比较差异具有统计学差异(P = 0.003)(表2)。选取单因素分析中具有统计学意义(P < 0.05)的因素进行多因素Logistic回归分析,结果显示心脏瓣膜置换术后接受过度抗凝治疗可明显影响术后肾功能,提示过度抗凝治疗(INR > 3.0)是心脏瓣膜置换术后肾功能损伤的独立危险因素(P < 0.05)(表3)。
3 讨论
肾功能损伤是心脏体外循环手术后常见的并发症之一,可造成多器官功能衰竭甚至死亡等严重后果,不仅增加了住院时间及住院费用,也大大提高了术后的死亡率。而影响心脏瓣膜置换术后肾功能的因素也有很多:包括血流动力学的不稳定、肾脏缺血再灌注损伤、炎症反应、溶血反应、酸碱失衡及药物毒性等[5]。上述因素可引起肾小管的水肿、变性、坏死,从而引起肾功能损伤。
本研究单变量分析表明了多个瓣膜置换、术前尿常规结果异常、术后过度抗凝(INR > 3.0)可对心脏瓣膜置换术后的肾功能产生影响。术前尿常规结果异常提示了尿蛋白及尿RBC阳性,表明术前肾功能即有一定程度的损伤,相较于术前肾功能正常的患者,术后发生肾功能损伤的几率更高。而多个瓣膜的置换则增加了手术流程,并延长了术中CPB时间,有研究表明,体外灌注时间越长,肾小球滤过率减少的程度越明显,从而对术后肾功能产生影响[6]。而本研究中两组病例中CPB时间差异并无统计学意义,可能与本研究的样本量不足有关。多因素Logistic回归分析表明术后过度抗凝(INR > 3.0)治疗是心脏瓣膜置换术后发生肾功能损伤的独立危险因素。
2009年,美国俄亥俄州立大学中心病理部的一项临床研究取了5年期间2801个肾脏活检标本,其中35个标本为接受华法林治疗的AKI患者,而其中有9位患者出现了无法解释的AKI,并发现与过度升高的INR有关[1]。病理结果显示,这些AKI患者的肾小管和肾小囊腔中发现了许多红细胞,同时在电镜下发现肾小管内有红细胞管型,提示肾小球滤过屏障受到损伤。该中心将这种与过度抗凝相关的AKI命名为抗凝剂相关肾病(Anticoagulant - Related Nephropathy, ARN)。目前对于ARN的机制仍不清楚,相关文献阐述了其可能机制[7]:①从病理生理学角度来说,肾小球滤过屏障的损伤导致出血进入了肾小囊腔和肾小管中,肾小管中形成了红细胞管型,从而引起梗阻、缺血并最终闭塞;②从分子机制上来说,可能是抗凝剂的使用降低了凝血酶原的水平,从而引起了血管内皮屏障的破坏,导致了肾小球出血。研究表明[8],ARN多出现在在华法林治疗的8周内,且INR > 3.0后1周内Scr增加≥ 0.3mg /dl;部分患者可能出现血尿,随后发现Scr异常增高;尿常规可发现变形的红细胞,偶尔出现红细胞管型;肾小球影像学无特征性改变,肾脏超声结果通常正常。因此,对于任何接受抗凝治疗且近期发生AKI且INR > 3.0的患者,在鉴别诊断时应考虑ARN(表4)。但是此类肾功能损伤在临床上极易被忽视和漏诊,主要原因是临床医生通常不会对正在行抗凝治疗的患者开展肾脏活检,同时AKI可出现在基础CKD和心血管疾病的患者中,故会被临床医生忽视[9]。华法林作为心脏瓣膜置换术后患者长期甚至终生口服的基石类抗凝药物,对其影响的PT-INR值的定期监测显得尤为重要。相较于欧美的心脏瓣膜置换术后的抗凝标准,我国患者却表现出较高的出血率和较低的栓塞率[10],这可能是由于东西方人种凝血功能的差异所致。近年来,国内医院普遍采用低强度抗凝治疗,将INR值的大致范围控制在1.5 - 2.5,但尚无统一的抗凝标准。有研究系统评价探讨了华人心脏瓣膜置换术后的抗凝标准,建议将抗凝标准控制在INR 1.5 - 2.0[11]。由于华人的体质原因,我国心脏瓣膜置换术后的患者在临床中过度抗凝的情况更应被予以重视。
本研究结果提示了在心脏瓣膜置换术后的过度抗凝可能是导致术后肾功能损伤的独立因素之一。因此,术后密切监测患者血凝指标、积极行护肾及扩血管等内科治疗、尽快将血凝指标调整至治疗水平等一系列临床措施是心脏瓣膜置换术后肾功能损伤预防中需要重点关注的因素。
参考文献:
[1]Brodsky SV, Satoskar A, Chen J, et al.Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a report of 9 cases.Am J Kidney Dis.2009;54(6):1121-1126.
[2]Ozcan A, Ware K, Calomeni E, et al. 5/6 nephrectomy as a validated rat model mimicking human warfarin-related nephropathy. Am J Nephrol. 2012;35(4):356-364.
[3]Warnock D G.Towards a definition and classification of acute kidney injury [J].J Am Soc Nephrol. 2005,16(11):3149-3150.
[4]Mehta R L, Kellum J A, Shah S V, et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury [J]. Crit Care, 2007, 11(2): R31.
[5]Wang Y, Rinaldo Bellomo. Cardiac surgery-associated acute kidney injury: risk factors, pathophysiology and treatment. Nature Reviews Nephrology, 13,697-711(2017).
[6]Suen W S, Mok C K, Chin S W, et al.Risk factors for development of acute renal failure(ARF) requiring dialysis in patients undergoing cardiac surgery. Angiology, 1998,49(10):789-800.
[7]Wheeler DS, Giugliano RP, Rangaswami J.Anticoagulation-related nephropathy.J Thromb Haemost. 2016 Mar;14(3):461-7.
[8]Richard J. Glassock. Anticoagulant-related nephropathy: Its the real McCoy. Clin J Am Soc Nephrol. 2019, 7;14(6):935-937.
[9]Brodsky S, Eikelboom J, Hebert LA. Anticoagulant-Related Nephropathy. J Am Soc Nephrol. 2018;29(12):2787-2793.
[10]董力, 石應康, 赵雍凡, 等. 心脏瓣膜替换术后126例抗凝治疗随访[J]. 中华胸心血管外科杂志, 1996, 12(3): 149-151.
[11]王斌, 徐志云, 叶小飞. 华人心脏机械瓣膜置换术后华法林抗凝强度标准的系统评价. 国际心血管病杂志, 2010, 37(06): 1673-6583.

