2株寒地黑土解无机磷青霉菌的分离鉴定
霍孝平 杜春梅 董锡文 李玉婷 韩笑 王文宣

摘要 [目的]从北方寒地种植的农作物根系土壤中分离遗传性能稳定、安全可靠、亲和性好、高效解无机磷的真菌,为微生物磷肥的开发提供适于该地区优良菌种。[方法]从北方寒地种植的农作物水稻、玉米和大豆根系土壤中分离解无机磷的真菌,对其进行鉴定及解无机磷能力的测定。[结果]通过PVK平板初筛和NBRIP平板复筛法,从种植大豆和玉米的根系土壤分离得到2株解无机磷真菌。显微观察初步鉴定为青霉属真菌。溶磷指数(SI)为2.65~2.80。采用钼锑抗比色法对发酵液进行解无机磷能力测定,在试验条件下青霉菌1和2发酵上清液中可溶性磷含量分别高达281.46和238.67 μg/mL。[结论]该试验得到2株解无机磷的青霉菌有望应用于生物磷肥的开发、生物防治和盐碱地的改良。
关键词 黑土;青霉菌;分离鉴定;解磷能力;寒地
中图分类号 X172 文献标识码 A
文章编号 0517-6611(2021)17-0001-04
doi:10.3969/j.issn.0517-6611.2021.17.001
Abstract [Objective]To isolate fungi with stable genetic properties,safety and reliability,good compatibility,and high efficiency in dissolving inorganic phosphorus from the root soil of crops grown in the northern cold regions,and to provide excellent strains suitable for the development of microbial phosphate fertilizers in this area.[Method]The fungi that dissolve inorganic phosphorus were separated from the root soils of crops of rice,corn and soybean grown in the northern cold regions,and the fungi were identified and the ability to dissolve inorganic phosphorus was determined.[Result]Two strains of inorganic phosphorus solubilizing fungi were isolated from the root soil of planting soybeans and corns by the methods of PVK plate primary screening and NBRIP plate secondary screening.Microscopic observation was preliminarily identified as Penicillium fungus.The phosphate index (SI) was 2.65-2.80.The molybdenum-antimony anti-colorimetric method was used to determine the ability of the fermentation broth to dissolve inorganic phosphorus.Under the test conditions,the soluble phosphorus content in the fermentation supernatant of Penicillium 1 and 2 was 281.46 and 238.67 μg/mL,respectively.[Conclusion]The experiment obtained 2 strains of Penicillium which can dissolve inorganic phosphorus and is expected to be used in the development of biological phosphate fertilizer,biological control and improvement of saline-alkali soil.
Key words Black soil;Penicillium;Isolation and identification;Phosphate-solubilizing;Cold region
磷是植物生長发育必需的主要营养元素之一,又是植物体内有机化合物的重要组成成分,参与光合作用、生物氧化、营养吸收和细胞分裂等重要代谢途径,对农作物的生长和产量具有直接影响[1-4]。土壤中通常含有1.32×10-2%~ 15.50×10-2% 磷和不溶性磷酸盐,占地球上总磷含量的95%~99%[5],由于磷的溶解度低、化学固定和复合螯合作用造成磷的迁移率低,不能直接供植物或微生物利用[6]。在我国,土壤中约95% 的磷是顽固性磷,传统上通过添加磷肥来克服。然而,重复而不当地施用化学磷肥其成本是昂贵的,并可通过干扰微生物多样性和降低作物产量而导致土壤肥力的丧失[7]。微生物积极参与土壤磷的矿化、溶解和转化等生物地球化学过程[8]。国内外大量的研究表明,土壤中存在许多能够将植物难以吸收利用的磷转化为可吸收利用状态的解磷菌或溶磷菌(phosphate solubilizing microorganisms,PSM),包括细菌、放线菌和真菌[9-10]。它们不仅产生有机酸,还通过分泌吲哚乙酸和铁氧体来促进植物生长[11]。解磷真菌(phosphate solubilizing fungi,PSF)种类和数量都少于解磷细菌,但传代培养后遗传性状更稳定,解磷能力明显优于解磷细菌和放线菌;此外,PSF被观察到比细菌分泌更多的有机酸,显示出更大的溶磷活性[12]。由于溶磷真菌在促进肥料中磷的释放方面具有巨大的潜力,倍受人们的关注。该研究拟从北方寒地种植的农作物水稻、玉米和大豆根系土壤中分离解无机磷的真菌,对其进行鉴定及解无机磷能力的测定,筛选出遗传性能稳定、安全可靠、高效解无机磷的真菌,为适于该地区微生物磷肥的开发提供优良菌种。
1 材料与方法
1.1 材料
1.1.1 样品来源。土壤样品采自黑龙江寒地生长状态良好的大豆、玉米和水稻根系土壤,去除植物根系表层土壤,用无菌铲采集5 ~ 15 cm深的根系土壤,每个样点2份土样,装于有编号的自封袋中,带回实验室。将样品分成两部分,一部分进行风干处理,用于土壤pH、电导率的测定,另一部分放在冰箱中作新鲜样品,用于解磷真菌的分离。
1.1.2 培养基。PVK培养基[13]、NBRIP培养基[14]、PDA培养基、磷矿粉培养基(NBRIP培养基中磷源改成磷矿粉)。上述固体培养基加入1.8% 或2.5% (磷矿粉培养基)琼脂粉,115 ℃灭菌30 min。
1.1.3 主要试剂。钼锑抗贮存溶液,1.5%钼锑抗显色剂(现用现配),5 mg/L磷标准溶液和0.2% 2,4-二硝基酚指示剂。
1.1.4 仪器。GZX-9076M型烘箱,LDZX-75KYS型立式压力灭菌锅,GZX-150B型光照培养箱,BS-2F型振荡培养箱,SW-CJ-2DF型双人超净工作台,722型分光光度计,PHS-2C型数显酸度计,DDS-LLA型数显电导率仪,生物显微镜,移液枪。
1.2 方法
1.2.1 土壤理化性质测定。
采用烘干法测定土壤的绝对含水量,以土壤中所含水分重量占烘干土重的百分数表示。计算公式:土壤含水量=(原土重-烘干土重)/烘干土重×100%=水重/烘干土重×100%[15];将土样按土水比为1∶2.5浸提,用PHS-2C型数显酸度计测量土壤pH;将土样按土水比为1∶5浸提,用DDS-LLA型数显电导率仪测定土壤的电导率(EC)[16]。
1.2.2 解无机磷真菌的筛选与保藏。称取10 g新鲜土样,放入90 mL装有玻璃珠的无菌水中,25 ℃ 振荡30 min,使土样充分打散,按10倍稀释法制成10-1~10-3的土壤稀释液。吸取0.1 mL稀释液涂布于PVK初筛培养基上,28 ℃ 培养,直至长出真菌菌落。
挑取产生褪色圈或透明圈的菌丝划线接种到NBRIP复筛平板上,反复纯化多次,挑取溶磷圈较大的菌落转接到PDA斜面培养基,28 ℃ 培养,直至菌丝体长满试管并生孢。向已生孢的PDA斜面培养基中加入适量无菌的生理盐水,振荡洗脱,离心沉淀,沉淀的孢子加入30% 无菌的甘油,混匀后于-20 ℃ 冰箱保存待用。
1.2.3 菌丝体外观特征及显微观察。取2 μL 孢子悬液(106 个孢子),滴加到PVK、NBRIP、PDA平板的中央,同时用镊子夹取灭菌的盖玻片,以倾斜45° 插入培养2 d 后的接种平板,每板插入3个盖玻片。每个处理设6个重复,其中3个重复观察菌丝体生长状况,3个重复插片用于显微观察,28 ℃ 培养5 d。观察菌丝组织外观特征,包括菌丝密度、长势、孢子颜色和产色素情况等。用游标卡尺测量菌落直径和溶磷圈(或褪色圈)直径,计算菌丝平均日长速(cm/d)和磷酸盐溶磷指数(SI),SI=(菌落直径+溶磷圈直径)/菌落直径。
取出爬有菌丝的盖玻片,置于10 × 40倍显微镜下观察记录菌丝和孢子形态特征,用显微测微尺测量孢子大小。
1.2.4 真菌解无机磷能力的测定。
取1 mL 真菌孢子转接于100 mL NBRIP和磷矿粉液体培养基中,28 ℃、140 r/min摇床培养10 d,同时以不接菌的培养基为空白对照,重复3次。取3 mL发酵液12 000 r/min离心5 min,钼锑抗比色法[17]测定上清液中可溶性磷含量,数显酸度计测量pH。
1.3 数据分析 试验数据采用SPSS 17软件进行统计分析,用GraphPad作图。
2 结果与分析
2.1 样地信息及理化性质
土壤是生态系统的一部分,其中含有大量的微生物,微生物是衡量土壤肥力的重要指标,寒地黑土的理化性质也会影响土壤微生物的生长。由表1可知,种植大豆和玉米的旱地采样点含水量分别为12.99%和12.87%,pH分别为5.86 和5.52,有利于解无机磷真菌的生长,但是取样地区土壤出现了不同程度的酸化现象,不利于农业生产的进行;2个样地土壤的电导率约为30 μS/cm。
2.2 解无机磷真菌的分离筛选
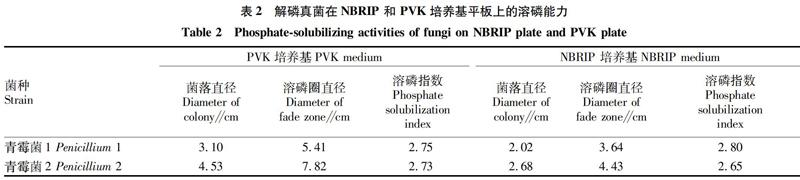
加了溴酚蓝的PVK培养基是一种基于视觉观察的快速评价磷酸盐溶解水平的检测方法[18-19],利用该培养基从寒地黑土中筛选解无机磷真菌,并用NBRIP固体培养基复筛,得到2 株具有溶磷圈的解无机磷能力的青霉菌株。青霉菌1来自大豆根系土壤,青霉菌2来自玉米根系土壤(表1)。由图1和表2可知,青霉菌1和2在PVK平板上均出现黄色的褪色圈,溶磷指数分别为2.75和2.73;在NBRIP平板上均产生透明的溶磷圈,青霉菌1和2的溶磷指数分别为2.80 和2.65。试验结果表明,用PVK和NBRIP培养基均能很好地反映解磷真菌的解磷能力。
2.3 解无机磷真菌的菌落形態与显微结构鉴定 从图1可以看出,106 个真菌孢子悬液滴加到培养基上,28 ℃培养 5 d后,青霉菌1 在PVK和NBRIP平板上菌丝不扩散生长,白色,生孢较快,初为橘色,后变成绿色,平均日长速分别为0.62 和0.45 cm/d;在PDA平板上菌丝扩散生长,产长势最快(日长速0.82 cm/d)。青霉菌2 在PVK、NBRIP和PDA平板上菌丝不扩散生长,菌丝由白转鸭黄色,生孢较慢,菌丝上有少量绿色孢子,日长速分别为 0.89、0.63和0.46 cm/d。2种菌在磷矿粉平板上长势最慢,也未出现溶磷现象。由此可见,解无机磷真菌在不同培养基上的菌落生长状态不同,其解无机磷的能力和长势存在一定的关系并随环境条件的改变而改变。
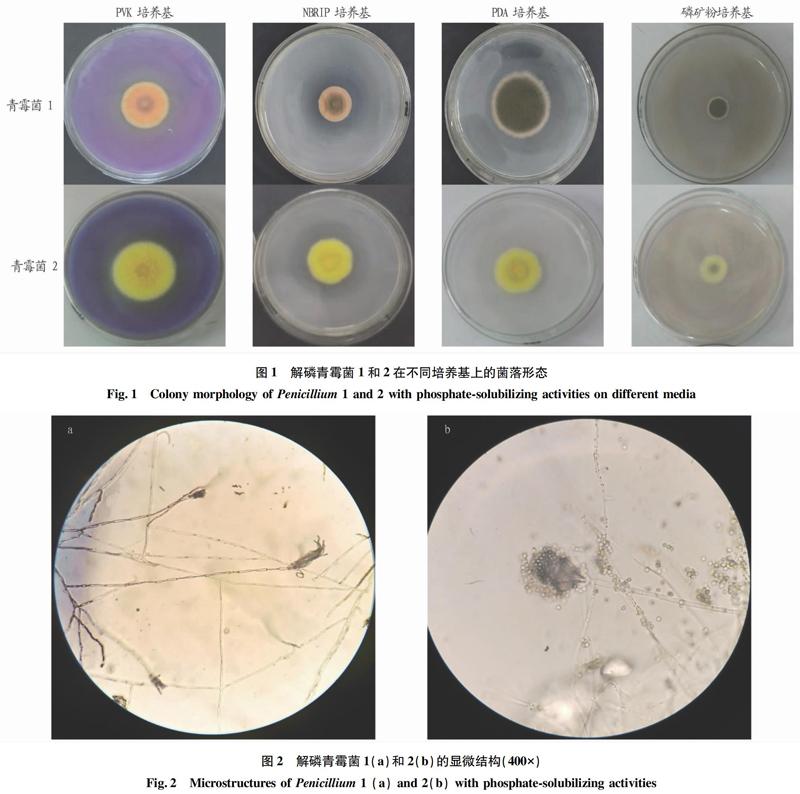
图2表示青霉菌1和2均在400×镜下的显微照片。青霉菌1和2营养菌丝分支、有横隔,气生菌丝形成分生孢子梗,分生孢子梗经过多次分枝,产生几轮对称或不对称的帚状体,青霉菌1帚状体较长,青霉菌2帚状体短粗;产生不同程度绿色圆形的分生孢子,大小分别为2.125和2.725 μm。由显微结构可以初步鉴定青霉菌1和2均属于青霉属。
2.4 解无机磷真菌解磷能力测定
对复筛纯化的青霉菌1和2进行发酵培养,测定其解磷能力及pH 变化,结果见图3。从图3可以看出,在NBRIP液体培养基中连续发酵培养10 d,青霉菌1和2解磷能力随培养时间的增加呈先升后降的趋势,分别在第6天和第8天时解磷能力最高,发酵上清液中可溶性磷含量分别达281.46和238.67 μg/mL。与初始pH 6.0相比,2种青霉菌发酵液pH都是下降趋势,pH均在5以下。在磷矿粉液体培养基中连续发酵培养10 d,青霉菌1和2解磷能力微乎其微。在发酵培养第2天,发酵液的pH就有显著的下降,最低达到2左右。
3 讨论
根系有益植物-微生物相互作用是植物健康和土壤肥力的决定因素。青霉菌和曲霉是根系主要的解磷丝状真菌。为了筛选出适合三江平原寒地土壤理化性质及环境条件,具有种属专一性、多功能的解磷菌,该研究从种植大豆、玉米和水稻的根系取样,从中分离得到2株遗传稳定的青霉属真菌,固体平板溶磷指数约2.7 左右,与Elias等[20]的研究结果一致;液体发酵可溶性磷含量约280 μg/mL,比Zheng等[8]从黑龙江省海伦市农田土壤分离的解磷细菌的最高溶磷能力高2倍。据报道,溶磷菌的溶磷能力通常与培养中酸化生长介质和释放低分子量有机阴离子的能力有关,有机酸可以通过羟基和羧基竞争性地螯合与磷结合的阳离子,并将其转化为可溶性形式[21]。该采样地pH在5.5 ~ 5.8,发酵过程中发酵液pH从初始6.0降至4.5左右,有利于解磷真菌的生存与发挥溶磷作用。解磷真菌磷释放能力不仅取决于微生物的遗传特征,还受到环境条件影响,如培养基的碳氮源的种类和比例、微生物群落的互作等。
Kucey[22] 研究表明,与溶磷细菌相比,溶磷真菌即使在实验室条件下反复传代培养仍具有溶磷活性。此外,这些真菌具有很强的竞争能力,对重金属、化学物质、杀菌剂和温度具有较强的耐受性,在土壤中更容易定植和迁移。在后续的研究中发现,分离得到的2株青霉菌与高溶磷的细菌[23]具有很好的协同作用和一定的纤维素降解能力。
4 结论
该研究利用PVK和NBRIP琼脂平板法,从东北寒地黑土分离得到2株解无机磷的青霉属真菌。在试验条件下发酵上清液可溶性磷最高含量分别为281.46和238.67 μg/mL,与初始pH 6.0相比,发酵液的pH均呈下降趋势。该研究结果表明,东北寒地黑土农田三大类作物玉米、大豆和水稻的根系土壤能够使自然发生的潜在溶磷真菌生存,均能在PVK和NBRIP培养基中激活磷酸三钙。由此可见,该试验得到的与植物伴生的溶磷真菌可能成为潜在的生物肥料。
参考文献
[1] ILLMER P,SCHINNER F.Solubilization of inorganic phosphates by microorganisms isolated from forest soils[J].Soil Biol Biochem,1992,24:389-395.
[2] 孟祥坤,于新,朱超,等.解磷微生物研究与应用进展[J].华北农学报,2018,33(S1):208-214.
[3] 王春红,武志海,孙合美,等.大豆根际溶无机磷细菌Klebsiella sp.wj6的分离鉴定与溶磷特性分析[J].南京农业大学学报,2015,38(4):560-567.
[4] 侯云鹏,孔丽丽,李前,等.不同施磷水平下水稻产量、养分吸收及土壤磷素平衡研究[J].东北农业科学,2016,41(6):61-66.
[5] KATIYAR V,GOEL R.Solubilization of inorganic phosphate and plant growth promotion by cold tolerant mutants of Pseudomonas fluorescens[J].Microbiol Res,2003,158(2):163-168.
[6] LI Z,BAI T S,DAI L T,et al.A study of organic acid production in contrasts between two phosphate solubilizing fungi.Penicillium oxalicum and Aspergillus niger[J].Sci Rep,2016,6(1):323-331.
[7] ZHANG H S,WU X H,LI G,et al.Interactions between arbuscular mycorrhizal fungi and phosphate-solubilizing fungus (Mortierella sp.) and their effects on Kostelelzkya virginica growth and enzyme activities of rhizosphere and bulk soilsat different salinities[J].Biol Fertil Soils,2011,47(5):543-554.
[8] ZHENG B X,IBRAHIM M,ZHANG D P,et al.Identification and characterization of inorganic-phosphate-solubilizing bacteria from agricultural fields with a rapid isolation method[J].AMB Expr,2018,8(1):1-12.
[9] 郝晶,洪堅平,刘冰,等.石灰性土壤中高效解磷细菌菌株的分离、筛选及组合[J].应用与环境生物学报,2006,12(3):404-408.
[10] 王光华,赵英,周德瑞,等.解磷菌的研究现状与展望[J].生态环境,2003,12(1):96-101.
[11] ZAIDI A,KHAN M S,AHEMAD M,et al.Plant growth promotion by phosphate solubilizing bacteria[J].Acta Microbiol et Immunol Hung,2009,56(3):263-284.
[12] 宰学明,张焕仕,王欢.AM真菌和解磷真菌对低磷土壤滨梅插条生根和生长的影响[J].北方园艺,2014(14):1-5.
[13] 朱培淼,楊兴明,徐阳春,等.高效解磷细菌的筛选及其对玉米苗期生长的促进作用[J].应用生态学报,2007,18(1):107-112.
[14] 于群英,马忠友,汪建飞,等.磷细菌筛选及其对土壤无机磷转化的影响[J].水土保持学报,2012,26(5):103-107.
[15] 杜春梅,董锡文,吴玉德,等.长期旱改水对黑土微生物类群及酶活性的影响[J].北方园艺,2018(4):127-132.
[16] 顿圆圆,杜春梅,董锡文,等.旱田改水田对黑土pH、电导率及几种微生物的影响[J].湖北农业科学,2017,56(3):459-461,470.
[17] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:166-169.
[18] GEORGE T S,SIMPSON R J,HADOBAS P A,et al.Accumulation and phosphatase-lability of organic phosphorus in fertilised pasture soils[J].Aust J Agric Res,2007,58(1):47-55.
[19] BNEMANN E K.Enzyme additions as a tool to assess the potential bioavailability of organically bound nutrients[J].Soil Biol Biochem,2008,40(9):2116-2129.
[20] ELIAS F,WOYESSA D,MULETA D.Phosphate solubilization potential of rhizosphere fungi isolated from plants in jimma zone southwest Ethiopia[J].Intnt J Microbiol,2016(3):1-11.
[21] ANWAR M S,SIDDIQUE M T,VERMA A,et al.Multitrait plant growth promoting (PGP) rhizobacterial isolates from Brassica juncea rhizosphere:Keratin degradation and growth promotion[J].Commun Integr Biol,2014,7(1):1-9.
[22] KUCEY R M N.Phosphate-solubilizing bacteria and fungi in various cultivated and virgin Alberta soils[J].Can J Soil Sci,1983,63(4):671-678.
[23] 朱德旋,杜春梅,董锡文,等.一株寒地高效解无机磷细菌的分离鉴定及拮抗作用[J].微生物学报,2020,60(8):1672-1682.

