绿萝离体快繁体系的建立及其甲基磺酸乙酯诱变条件
陆玉建 张永磊

摘要:为了探究绿萝离体再生的最适条件和甲基磺酸乙酯(ethyl methane sulphonate,简称EMS)诱变绿萝的合适剂量,首先以绿萝叶柄为材料进行离体培养。结果表明,用叶柄诱导愈伤组织的最适培养基为MS+0.5 mg/L噻苯隆(TDZ)+0.3 mg/L萘乙酸(NAA),不定芽分化最适培养基为MS+3.0 mg/L 6-苄氨基嘌呤(6-BA)+0.5 mg/L NAA,生根最适培养基为1/2MS+0.05 mg/L NAA。然后设置不同剂量的EMS诱变绿萝叶柄愈伤组织,并对其存活率、致死率进行统计,初步获得EMS诱变绿萝愈伤组织的半致死条件:0.6%EMS诱变处理4 h或0.8%EMS诱变处理2 h。研究结果对于今后利用EMS诱变绿萝愈伤组织、筛选性状优良的突变体具有重要意义。
关键词:绿萝;叶柄;愈伤组织;甲基磺酸乙酯(EMS);诱变
中图分类号: S687.904+.3 文献标志码: A 文章编号:1002-1302(2021)14-0055-06
绿萝(Eipremnum aureum)为天南星科绿萝属多年藤本植物,其形态优美,具有较高的观赏价值[1]。绿萝吸收室内甲醛的能力较强,深受人们喜爱[2]。此外,绿萝对铅、镉、铬等重金属具有一定的富集能力,并能够通过特定机制将根部积累的重金属运输到不同部位,因此在净化低浓度重金属污染的水体方面效果良好[3-5]。目前绿萝多采用压条和扦插的方式进行繁殖,繁殖系数低、速度慢、遗传稳定性差,无法在短期内得到大量优质的植株[6]。组织培养是实现绿萝快速繁殖的有效途径,近年来的研究主要以绿萝茎段为外植体,通过愈伤组织分化或直接诱导生芽的方式获得绿萝再生植株[7-8]。由于外植体选材的局限性和植物生长调节剂对绿萝离体再生影响的复杂性,现阶段还存在离体再生频率低的缺点。此外,绿萝还存在种质资源单一的不足。化学诱变育种是丰富植物种质资源的有效途径,化学诱变剂甲基磺酸乙酯(ethyl methane sulphonate,简称EMS)因其诱变频率高、成本低廉、操作简便,已成为获得突变体、创制新种质的有效手段[9-11]。鑒于此,为丰富绿萝种质资源、培育出观赏价值更高和污染清除效果更好的绿萝新品系,本研究在建立绿萝高频离体再生体系的基础上,通过EMS对绿萝愈伤组织进行诱变,探究EMS诱变绿萝愈伤组织的最佳剂量,研究结果对于下一步通过化学诱变、筛选性状优良的绿萝突变体具有重要意义。
1 材料与方法
1.1 试验材料
绿萝于2019年春购自山东省滨州市花卉市场,在滨州学院生物与环境工程学院人工气候室内进行培养。
1.2 试验方法
1.2.1 培养基的配制 根据前期试验结果,重新优化培养基组合并配制培养基,所有培养基均添加3%蔗糖和1%琼脂。绿萝叶柄愈伤组织诱导培养基C1~C5的配方如下:(1)C1,MS+0.5 mg/L 6-苄氨基嘌呤(6-BA)+0.3 mg/L萘乙酸(NAA)+1.0 mg/L 2,4-二氯苯氧乙酸(2,4-D);(2)C2,MS+0.2 mg/L噻苯隆(TDZ)+0.3 mg/L NAA+0.5 mg/L 6-BA;(3)C3,MS+0.2 mg/L TDZ+0.3 mg/L NAA+0.5 mg/L 6-BA+0.5 mg/L激动素(KT);(4)C4,MS+0.5 mg/L TDZ+0.3 mg/L NAA+0.5 mg/L 6-BA+1.0 mg/L 2,4-D;(5)C5,MS+0.5 mg/L TDZ+0.3 mg/L NAA。绿萝带节茎段培养和不定芽分化培养基B1~B5的配方如下:(1)B1,MS+1.5 mg/L 6-BA+0.15 mg/L NAA;(2)B2,MS+1.5 mg/L 6-BA+0.5 mg/L NAA;(3)B3,MS+2.5 mg/L 6-BA+0.25 mg/L NAA;(4)B4,MS+3.0 mg/L 6-BA+0.15 mg/L NAA;(5)B5,MS+3.0 mg/L 6-BA+0.5 mg/L NAA。绿萝不定芽诱导生根培养基R1~R5的配方如下:(1)R1,1/2MS+0.03 mg/L NAA;(2)R2,1/2MS+0.05 mg/L NAA;(3)R3,1/2MS+0.1 mg/L NAA;(4)R4,1/2MS+0.2 mg/L NAA;(5)R5,1/2MS+0.5 mg/L NAA。
1.2.2 材料消毒及无菌苗的获得 剪取绿萝带芽茎段,分别用自来水冲洗30 min、蒸馏水冲洗2次、70%乙醇消毒30 s、0.1%氯化汞处理15 min、无菌水冲洗5~6次后接种于B1~B5培养基上,2周后统计茎段芽的增殖系数。将茎段产生的芽切下,转入新鲜培养基中培养30 d,获得绿萝无菌苗,相关计算公式:
芽的增殖系数=产生的芽数/接种的茎段数。
1.2.3 叶柄愈伤组织的诱导 选取绿萝无菌苗的叶柄接种到愈伤组织诱导培养基中进行培养,30 d后按下式统计愈伤组织诱导率:
愈伤组织诱导率=(产生愈伤组织的外植体数/接种数)×100%。
1.2.4 不定芽的分化 先将绿萝叶柄诱导产生的愈伤组织进行继代培养,然后转入分化培养基中进行不定芽诱导,30 d后进行不定芽分化率的统计,计算公式:
不定芽分化率=(产生不定芽的外植体数/接种数)×100%。
1.2.5 不定芽的生根 选取绿萝不定芽接种于生根培养基上进行生根诱导,30 d后按下式统计不定芽的生根率、根增殖系数:
生根率=(产生不定根的外植体数/接种数)×100%;
根增殖系数=产生的根数/接种数。
1.2.6 绿萝愈伤组织的EMS诱变 用0.1 mol/L磷酸缓冲液(pH值为5.8)分别配制0、0.4%、0.6%、0.8%EMS溶液,过滤除菌后备用。选取生长良好的绿萝愈伤组织,放入上述不同浓度的EMS溶液中,分别于100 r/min振荡培养2、4、6 h。取出绿萝愈伤组织,用无菌水反复冲洗后转入愈伤组织诱导培养基中进行继代培养。
1.2.7 EMS诱变半致死剂量的确定 得到用EMS诱变处理的绿萝愈伤组织后,继代培养30 d并观察统计,根据愈伤组织的褐化程度和生长状态,统计存活率、致死率。将致死率接近50%时的EMS浓度和诱变时间作为绿萝愈伤组织EMS诱变的合适剂量,用于突变体的诱导,相关计算公式:
存活率=(外植体的存活数/接种数)×100%;
致死率=(外植体的致死数/接种数)×100%。
1.2.8 数据分析 用Excel 2007和SPSS 17软件进行数据统计,通过Duncans多重比较进行样本间的差异显著性分析。
2 结果与分析
2.1 带节茎段芽的诱导
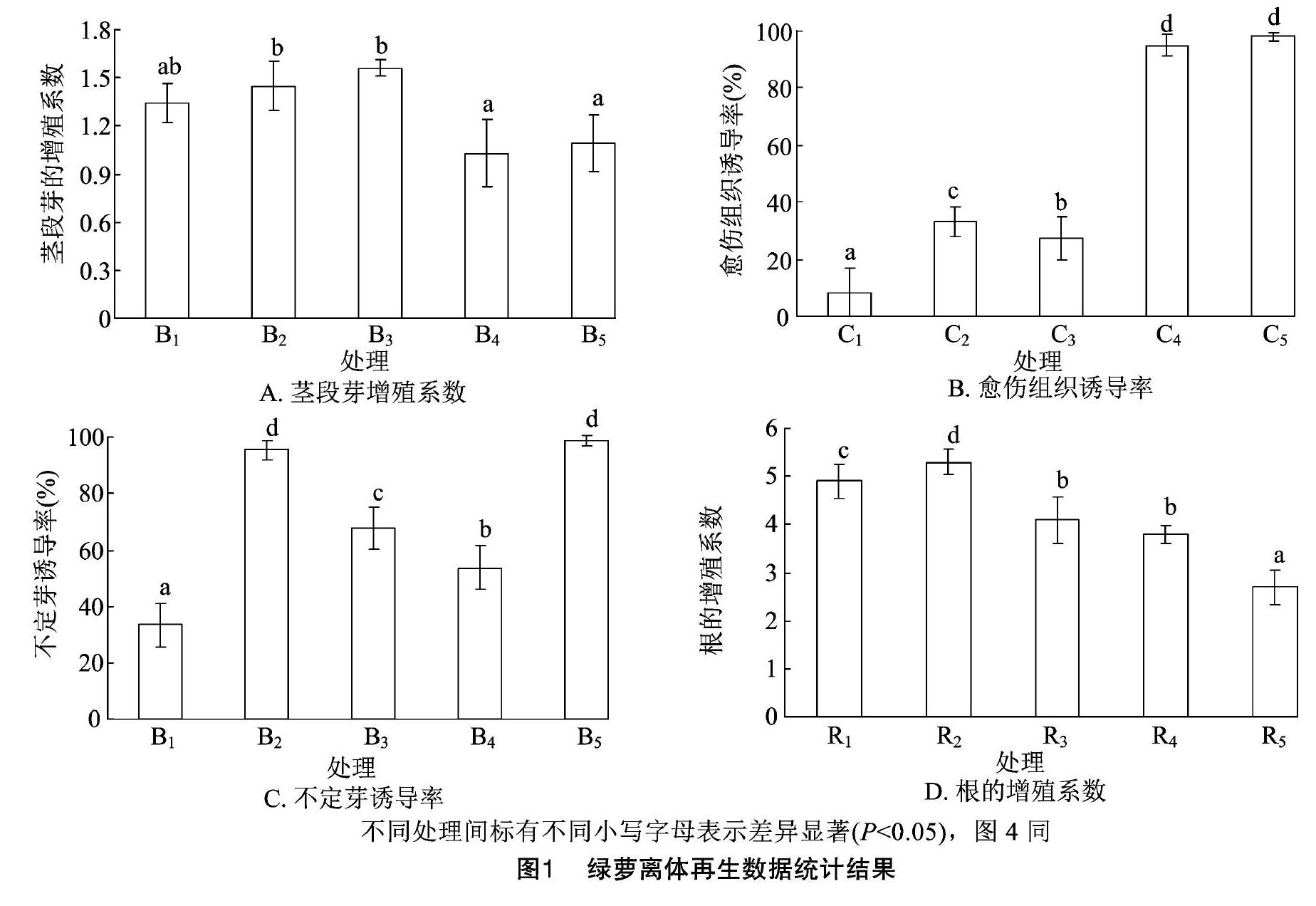
将绿萝带节茎段接种于B1~B5培养基上,接种后1周左右,茎段开始抽芽,接种后2周左右茎段长出明显的芽,然后进行芽的增殖系数统计。由图 1-A、图2-A、图2-B可以看出,在这5种培养基中,茎段均可产生芽,且芽生长迅速,但数量较少。其中B3培养基中芽的增殖系数最高,达到1.54,B4培养基中芽的增殖系数最低,仅有1.05,其他3种培养基中芽的增殖系数介于上述2个数据之间。根据芽的增殖系数和芽的生长情况,初步确定B3培养基作为带节茎段芽诱导的培养基。将芽切下后转入B3培养基中继续培养30 d,芽不断生长发育,获得无菌苗(图2-C、图2-D)。
2.2 叶柄愈伤组织的诱导
选取叶柄为材料进行愈伤组织诱导。由图1-B可以看出,叶柄在这5种培养基中均可产生愈伤组织,但诱导率存在明显差异,其中诱导效果最好的为C5培养基,愈伤组织诱导率约为98%,且产生愈伤组织的量较多,生长比较旺盛(图2-E、图2-F);其次是C4培养基的诱导效果较好,愈伤组织诱导率接近C5培养基;诱导效果最差的为C1培养基,愈伤组织诱导率不到10%,叶柄不仅极易褐化,而且愈伤组织产生的量很少。C2、C3培养基的诱导效果一般,愈伤组织诱导率约为30%。根据叶柄愈伤组织诱导率及其生长情况,初步确定C5培养基作为叶柄愈伤组织诱导的最适培养基。将愈伤组织转接入C5培养基中进行继代培养,发现2周后愈伤组织的量明显增加(图2-G)。连续继代培养2次后,愈伤组织继续增殖,并有少量芽点产生(图2-H)。
2.3 愈伤组织不定芽的诱导
将叶柄诱导产生的愈伤组织继代培养后转入不定芽诱导培养基B1~B5中。由图1-C可以看出,在这5种培养基中,叶柄愈伤组织均可分化产生不定芽。在B5培养基中,愈伤组织分化率接近100%,不定芽数量较多,生长较好。其次为B2培养基,不定芽分化率超过95%。分化效果较差的为B1培养基,芽的分化率只有30%左右,且芽的数量相对较少。B3、B4培养基的效果一般,不定芽分化率为50%~60%。根据不定芽分化率及其生长情况,初步确定B5培养基作为绿萝不定芽分化最适培养基。在B5培养基中,愈伤组织培养1周即可分化出少量不定芽(图2-I),3周后不定芽明显继续增多、增大(图2-J)。随着培养时间的延长,愈伤组织继续分化培养,培养30 d后叶柄两端产生较多不定芽(图2-K)。将带芽叶柄转入B5培养基中继续培养,发现不定芽生长比较旺盛(图2-L)。切取叶柄两端的不定芽进行增殖培养,发现不定芽数量继续增多(图2-M、图2-N)。
2.4 不定芽生根诱导
不定芽生根培养30 d后进行数据统计,由图 1-D 可以看出,在这5种培养基中,不定芽的基部均有根生成,且根的长势较好,生根率十分接近,其中R2培养基的生根率达到98%,但根的增殖系数存在一定差别。在R2培养基中,不定芽的生根系数最高,约为5.3,且根数量较多、生长旺盛。在R5培养基中,不定芽的生根系数最低,约为2.7,且根数量少、生长较差。在其他3种培养基中,不定芽的生根系数介于上述2个数据之间。根据根的增殖系数和根的生长情况,初步确定R2培养基是不定芽诱导生根的最适培养基。选取健壮的不定芽接种于R2培养基中,培养30 d即可获得试管苗(图2-O、图2-P)。
2.5 EMS处理对绿萝愈伤组织生长的影响
选取生长良好的愈伤组织进行EMS诱变,培养30 d后进行观察统计,试验结果见图3、图4-A。
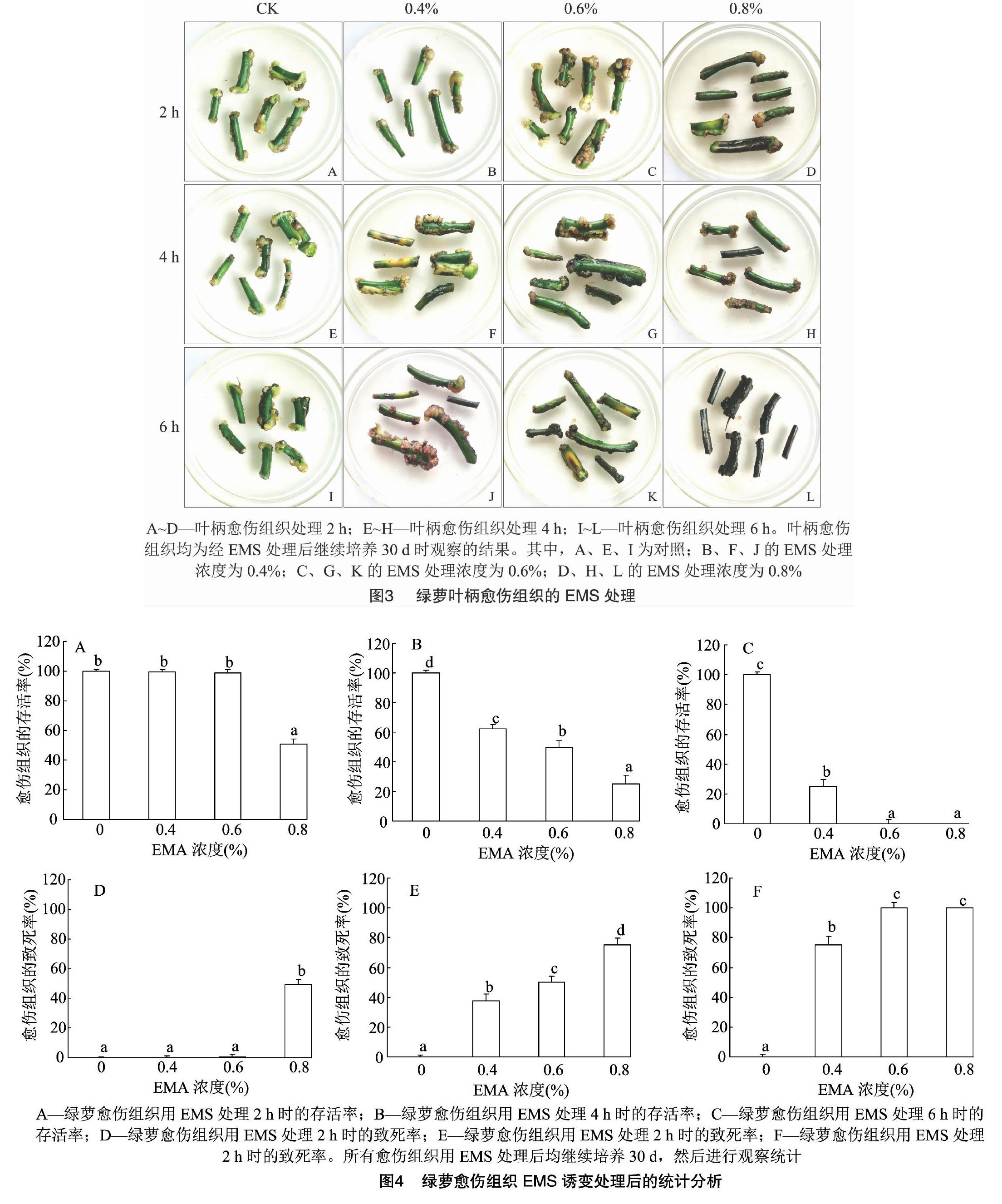
当磷酸缓冲液中不含EMS时,无论处理2、4 h还是 6 h,绿萝愈伤组织均生长正常,叶柄呈现青绿色,几乎没有褐化,部分还生出芽点,存活率约为100%(图3-A、图3-E、图3-I)。
用0.4%EMS诱变剂处理愈伤组织2 h时,愈伤组织生长基本正常,与对照没有明显区别,存活率接近100%(图3-B);用0.4% EMS诱变剂处理愈伤组织4 h时,愈伤组织轻微褐化,生长受到一定抑制,存活率约为62.5%(图3-F);用0.4% EMS诱变剂处理愈伤组织6 h时,愈伤组织褐化较深,生长受到明显抑制,存活率为30%左右(图3-J)。用0.6% EMS诱变剂处理愈伤组织2 h时,愈伤组织生长受到一定抑制,褐化比较明显,存活率约为98%(图3-C);用0.6% EMS诱变剂处理愈伤组织4 h时,愈伤组织生长受到的抑制程度较大,叶柄、愈伤组织褐化程度较深,愈伤组织存活率为50%左右(图3-G);用0.6% EMS诱变剂处理愈伤组织6 h时,愈伤组织生长几乎完全受到抑制,叶柄完全褐化,存活率不到3%(图3-K)。用0.8% EMS诱变剂处理愈伤组织2 h时,愈伤组织生长受到明显抑制,叶柄、愈伤组织褐化程度较深,愈伤组织的存活率接近52%(图3-D);0.8% EMS诱变剂处理愈伤组织4 h时,愈伤组织生长受到严重抑制,愈伤组织褐化严重(图3-H);0.8% EMS诱变剂处理愈伤组织6 h时,愈伤组织生长完全抑制,叶柄变黑,愈伤组织完全褐化,存活率为0(图3-L)。
2.6 EMS半致死剂量的确定
由图4-D可以看出,用EMS处理2 h时,0.4%、0.6% EMS处理组的愈伤组织致死率与对照相比没有明显区别,然而当EMS浓度提高到0.8%时,愈伤组织致死率接近50%;当EMS处理时间为4 h时,0.4%、0.6%、0.8% EMS处理愈伤组织的致死率分别为38%、50%、80%,与对照存在显著性差异;当EMS处理时间为6 h时,0.4% EMS处理愈伤组织的致死率已经超过70%,0.6% EMS处理愈伤组织的致死率达到97%,0.8% EMS处理的愈伤组织完全褐化,无法正常生长,致死率为100%。上述统计结果表明,0.8% EMS处理2 h或0.6% EMS处理4 h时,愈伤组织致死率约为50%。由此可见,0.8% EMS处理2 h、0.6% EMS处理4 h这2种组合可作为半致死條件,用于绿萝愈伤组织的EMS诱变处理。
3 结论与讨论
3.1 绿萝的离体快繁
本研究以绿萝叶柄为外植体,当在MS培养基中添加0.5 mg/L TDZ、0.3 mg/L NAA时,愈伤组织诱导效果最佳,诱导率接近100%。张盛圣研究发现,以茎段为外植体时,绿萝愈伤组织诱导的最适培养基为MS+2.0 mg/L TDZ+0.2 mg/L 2,4-D[12]。叶柄和茎段愈伤组织诱导之间存在一定的差异,表明外植体的选择和植物生长调节物质的种类都会对绿萝愈伤组织的诱导产生影响。植物生长调节物质对外植体不定芽的诱导具有重要的调节作用。试验结果表明,叶柄产生的愈伤组织在 MS+3.0 mg/L 6-BA+0.5 mg/L NAA中的分化率接近100%,其芽分化明显,数量较多,生长旺盛。这和张瑜等的研究结果有所不同,张瑜等以带节茎段为外植体进行试验发现,最佳不定芽诱导培养基为MS+2.0 mg/L 6-BA+0.1 mg/L NAA[7],這很可能是由外植体类型和诱导方式不同所造成的。崔小丽等经研究证实,绿萝生根的最佳培养基为 1/2MS+0.1 mg/L NAA+0.2 mg/L IBA[13]。而本研究结果表明,在1/2MS+0.05 mg/L NAA培养基中,绿萝不定芽的生根率达到98%,生根系数较高,根数量较多。由此可见,植物生长调节物质的种类和浓度对不定芽生根的影响明显。本研究建立了绿萝高频离体再生体系,将为其工厂化繁殖种苗奠定基础,也为诱导绿萝突变体等研究提供了条件。
3.2 绿萝的EMS诱变
将植物组织培养与诱变技术相结合的离体诱变技术,在选育性状优良突变体的过程中,逐渐受到人们的关注[14]。EMS是目前应用较多且最为有效的一种化学诱变剂[15-16]。目前,尚无关于绿萝诱变育种的相关报道。通过EMS诱变剂处理绿萝愈伤组织,有助于扩大绿萝变异谱,丰富种质资源,培育出观赏价值更高和污染清除效果更好的绿萝新品系。在绿萝愈伤组织EMS诱变过程中,当诱变时间相同时,随着EMS浓度的增加,叶柄褐化程度逐渐加深,愈伤组织生长所受的抑制程度逐渐加深,存活率逐渐降低。当EMS浓度相同时,诱变处理时间越长,愈伤组织褐化程度越深,受到的抑制程度越重,存活率越低。上述结果表明,绿萝愈伤组织对于EMS处理表现出明显的剂量效应和时间效应。通过分析绿萝愈伤组织的存活情况可知,0.8% EMS处理2 h或0.6% EMS处理4 h时,绿萝愈伤组织致死率接近50%,因此这2种组合可作为EMS诱变绿萝愈伤组织的半致死条件,用于绿萝愈伤组织的EMS诱变处理。以上研究结果对于筛选性状优良的绿萝突变体具有重要的意义。
参考文献:
[1]陈广玉. 绿萝的组织培养及快速繁殖的研究[J]. 北京农业,2011,4(3):16-17.
[2]林 茂,王华新,唐遒冥,等. 绿萝组织培养与快繁技术[J]. 南方农业学报,2012,43(10):1447-1451.
[3]解淑娟. 绿萝对重金属的富集特性及相关机制的研究[D]. 青岛:中国海洋大学,2015.
[4]李海婷,迟宝明,贺存哲,等. 水培条件下绿萝对铜、铬滤除特征[J]. 科学技术与工程,2015,15(26):221-225.
[5]周佳栋,马丹丹,刘 敏,等. 三种水生植物对重金属的富集及净化能力研究[J]. 杭州师范大学学报,2020,19(1):57-63.
[6]伍席军,张 鹏,袁云香. 绿萝的组织培养研究进展[J]. 农产品加工,2017,6(5):77-78,81.
[7]张 瑜,关 力,杨晓贺. 花叶绿萝的组织培养与快速繁殖[J]. 北方园艺,2012(12):155-157.
[8]陈佳丽,张 红,刘思家,等. 绿萝的组培水培快繁技术研究[J]. 德州学院学报,2019,35(6):30-33.
[9]崔清志,刘晓虹,陈惠明. EMS诱变技术研究进展[J]. 湖南农业科学,2013,4(5):7-9,13.
[10]Souza P F,Silva F D,Carvalho F E,et al. Photosynthetic and biochemical mechanisms of an EMS-mutagenized cowpea associated with its resistance to cowpea severe mosaic virus[J]. Plant Cell Rep,2017,36(1):219-234.
[11]Wang D W,Wang S M,Chao J T,et al. Morphological phenotyping and genetic analyses of a new chemical-mutagenized population of tobacco (Nicotiana tabacum L.)[J]. Planta,2017,246(1):149-163.
[12]张盛圣. 绿萝离体快繁与影响叶色变异因素的研究[D]. 银川:宁夏大学,2016.
[13]崔小丽,刘伟清,刘建荣,等. 绿萝组培快繁技术研究[J]. 现代农业科技,2020(1):120-121,125.
[14]周立名. EMS定向诱导猕猴桃耐盐突变体筛选[D]. 杨凌:西北农林科技大学,2009.
[15]程 丽,胡茂龙,浦惠明,等. M342抗除草剂基因CAPS标记的开发与应用[J]. 江苏农业学报,2019,35(2):241-247.
[16]陈 帅. EMS处理唐菖蒲无性系变异的研究[D]. 哈尔滨:东北农业大学,2014.

