生物等效性试验中药代动力学报表自动输出的SAS实现
孟娜 张糈 胡建华

[摘要]目的为满足药物一致性评价中药代动力学(PK)参数生物等效性分析计算以及结果报表规范化自动输出。方法将 SAS 的数据处理功能与输出交付系统相结合,编写自动输出 PK 参数统计分析报表的 SAS 宏程序%AbeTable。结果以加拿大卫生部发布有关文件中的 PK 数据为实例,程序计算结果准确,输出的统计报表格式规范,符合临床试验统计分析报告的基本要求。结论宏%AbeTable具有较好的通用性,结果可靠,生成报表效率高,可以满足生物等效性分析的统计需要。
[关键词]生物等效性试验;WinNonlin;药代动力学参数; SAS 制表
[中图分类号] R285 [文献标识码] A [文章编号]2095-0616(2021)22-0216-04
Realization of automatic output of pharmacokinetic reports for bioequivalence test by SAS
MENG Na ZHANG Xu HU Jianhua
Department of Pharmaceutical Information and Biostatistics, School of Science of China Pharmaceutical University, Jiangsu, Nanjing 210000, China
[Abstract] Objective To satisfy the analysis and calculation of bioequivalence and pharmacokinetics (PK) parameters for drug consistency evaluation, and to realize the standardized automatic output of result reports. Methods The data processing function of Statistical Analysis System (SAS) was combined with the output delivery system to program the SAS macro program, %Abe Table, for automatic output of statistical analysis reports of PK parameters. Results Taking the PK data in the relevant documents released by Health Canada as an example, the output statistical reports was standardized in format if the results calculated by the program were accurate, which met the basic requirements of statistical analysis reports of clinical trials. Conclusion The macro program %Abe Table has good generality with reliable results, and high efficiency in generating reports, which can meet the statistical requirements of bioequivalence analysis.
[Key words] Bioequivalence test; WinNonlin; Pharmacokinetic parameters; SAS tabulation
截止至2017年11月底,我國生产的仿制药占全部药品数量的95%以上[1]。为保证仿制药的疗效与安全,监管部门对药物的一致性评价工作愈发重视[2-5]。制药企业使用WinNonlin进行生物等效性评价。WinNonlin输出结果的格式固定,冗余内容多,报告撰写人员需人工完成数据整理工作。此过程耗时长、错误率高,违背了数据结果的可重复性原则[6-7]。针对上述问题,编写 SAS 宏程序%AbeTable,自动输出规范化统计报表,提高统计工作效率与质量。
1生物等效性研究的药代动力学(PK)分析
1.1生物等效性计算
本研究以2×2交叉设计展开研究。试验的终点指标一般为峰浓度(Cmax ),血药浓度0到 t 下面积(area under the curve from zero to t time point, AUC0-t ),血药浓度0到∞下面积(area under the curve from zero to infinity, AUC0-∞)[8-9]。2×2试验的生物等效性评价是在方差分析的基础上进行置信区间计算与双单侧 t 检验。
1.1.1方差分析方差分析将给药顺序、药物、周期作为固定效应,受试者(顺序)作为随机效应[10-11]建立模型。通过方差分析可以得出统计量与 P 值,但不能得出等效性结论,双单侧 t 检验与置信区间法实质性地解决了该问题。
1.1.2置信区间利用方差分析的结果,计算置信区间,其上下限计算公式分别为:
式中,S是方差分析误差项均方的平方根; t1-α,v是检验水平为α,自由度为 v = n -2时 t 分布的界值;L T、LR 分别是两制剂 P K 参数取对数后的算数均值。若计算出100(1-2α)%的置信区间介于80%~125%范围,可判定为生物等效。
1.1.3双单侧 t 检验利用方差分解后获得的均方误差(mean square error,MSE)进行双单侧 t 检验计算。双单侧 t 检验的检验假设为:
H0:InμT - InμR≤ Inr1或 InμT - InμR ≥ Inr2 H1:Inr1< InμT - InμR < Inr2
其中, In μT In μR 分别为两制剂 P K 参数取对数后的算术均值,r 1和 r 2取值一般为0.8和1.25。
两次单侧检验的统计量分别为:
式中,InXT -InXR ~ N (In μT - In μR ,σInXT -InXR ),其标准误为SInXT -InXR =。
若两次检验的 P 值均<0.05,两次检验均拒绝H0,可推断两种制剂具有生物等效性。
1.2生物等效性评价结果输出
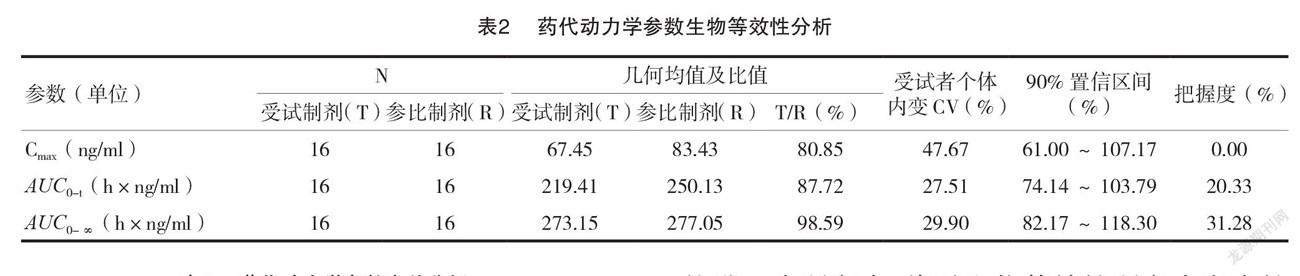
在等效性试验中,统计分析报告包含方差分析、100(1-2α)%置信区间与双单侧 t 检验的 PK 分析结果。方差分析的目的是展示出 PK 参数的给药顺序、受试者(顺序)、周期与制剂的变异信息。100(1-2α)%置信区间分析结果中需要提供各参数的几何均值及比值、变异系数、置信区间和把握度。最后,列出双单侧 t 检验的统计量与 P 值。
2 SAS宏程序%AbeTable
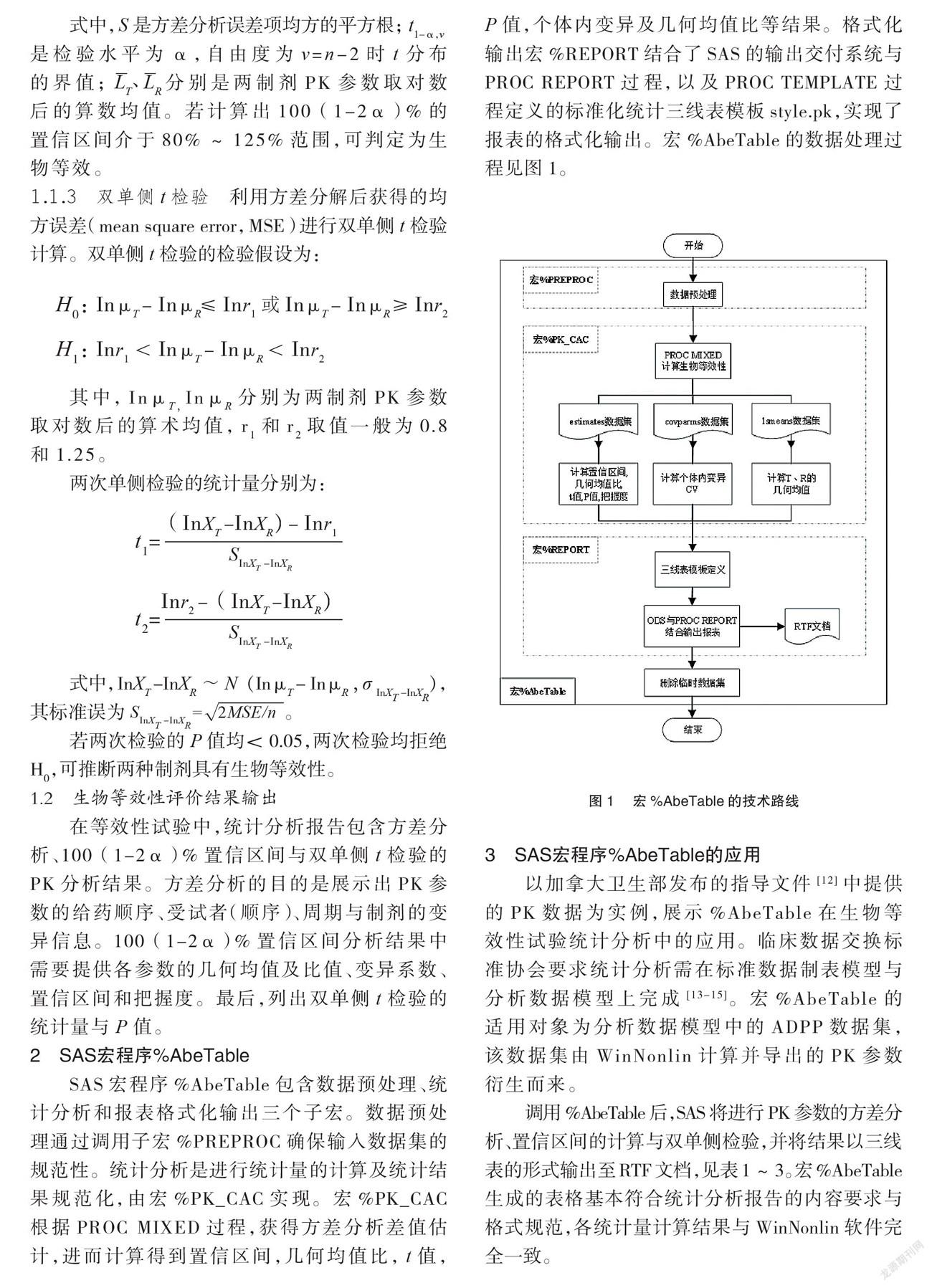
SAS 宏程序%AbeTable包含数据预处理、统计分析和报表格式化输出三个子宏。数据预处理通过调用子宏%PREPROC 确保输入数据集的规范性。统计分析是进行统计量的计算及统计结果规范化,由宏%PK_CAC 实现。宏%PK_CAC 根据 PROC MIXED 过程,获得方差分析差值估计,进而计算得到置信区间,几何均值比,t 值,P 值,个体内变异及几何均值比等结果。格式化输出宏%REPORT 结合了 SAS 的输出交付系统与 PROC REPORT 过程,以及 PROC TEMPLATE 过程定义的标准化统计三线表模板 style.pk,实现了报表的格式化输出。宏%AbeTable的数据处理过程见图1。
3 SAS宏程序%AbeTable的应用
以加拿大卫生部发布的指导文件[12]中提供的 PK 数据为实例,展示%AbeTable在生物等效性试验统计分析中的应用。临床数据交换标准协会要求统计分析需在标准数据制表模型与分析数据模型上完成[13-15]。宏%AbeTable的适用对象为分析数据模型中的 A DPP 数据集,该数据集由 W i n N o nli n 计算并导出的 P K 参数衍生而来。
调用%AbeTable后,SAS 将进行 PK 参数的方差分析、置信区间的计算与双单侧检验,并将结果以三线表的形式输出至 RTF 文档,见表1~3。宏%AbeTable生成的表格基本符合统计分析报告的内容要求与格式规范,各统计量计算结果与WinNonlin软件完全一致。
4讨论
临床试验统计分析的核心体现于统计分析报告中,在保证质量的前提下提升工作效率是临床试验工作者长期追求的目标。吴正宇等用 R 语言计算药动学参数和生物等效性分析[16],张露等分别用 SAS 及stata实现2×2生物等效性检验,王建峰研究了Ⅰ期临床中分析报告规范化结果输出[17]。本研究根据医药公司现存的统计分析工作情况,结合该领域常用统计软件的独特优势,编写了一套自动生成 PK 参数统计分析报表的 SAS 宏程序,提升了工作效率。但仍存在一定不足:首先,本文仅研究了生物等效性 PK 参数的 SAS 宏生成,还未对统计分析报告中安全性结果报表生成进行探索;其次,本文还未实现用 SAS 对半重復或重复交叉设计等效性分析进行相应报告输出。在今后的进一步研究中,将对生物等效性研究中安全性结果报表输出及部分重复或完全重复的试验类型展开讨论。
[参考文献]
[1]曾俊芬,宋金春.仿制药质量和疗效一致性评价思考[J].医药导报,2019,38(7):884-887.
[2]张露,郑倩雯,李亚文,等.生物等效性检验在 SAS 及stata中的实现及对比[J].中国卫生统计,2019,36(2):306-308.
[3]王可莹,刘平.我国仿制药一致性评价现状及展望[J].福建医科大学学报(社会科学版),2018,19(3):16-20.
[4]刘冬,哈莉莉,李芳,等.我国化学仿制药一致性评价进展与展望[J].中国临床药理学杂志,2020,36(16):2381-2385.
[5]胡宇,宗欣,于淼,等.我国仿制药一致性评价政策环境现状分析[J].中国药物评价,2020,37(5):321-326.
[6]STODDEN V,LEISCH F,PENG R D.Implementing Reproducible Research[M].Boca Raton:CRC Press,2014:1-29.
[7]EMMERT-STREIB F,DEHMER M,YLI-HARJA O.Ensuring Quality Standards and Reproducible Research for Data Analysis Services in Oncology: A Cooperative Service Model[J].Frontiers in Cell and Developmental Biology,2019,7(349):1-5.
[8]隋鑫,王华伟,李晓斌,等.盐酸特比萘芬片在中国健康受试者体内的生物等效性研究[J].中国临床药理学杂志,2021,37(2):99-103.
[9]国家药品监督管理局.总局关于发布药物临床试验数据管理与统计分析的计划和报告指导原则的通告(2016年第113号)[EB/OL].(2016).[2021-04-22]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/ggtg/ qtggtg/20160729184001935.html
[10]王晖,崔畅,杨双,等.琥珀酸索利那新片在中国健康受试者的生物等效性研究[J].中国临床药理学与治疗学,2021,26(3):299-304.
[11]魏敏吉,单爱莲,赵艺璇.不依赖专业软件的药代动力学参数的计算方法 [J]. 中国临床药理学杂志,2016,32(23):2199-2202.
[12]CANADA G O. Guidance Document: Conduct and Analysis of Comparative Bioavailability Studies[EB/OL].(2018).[2021-04-18].https://www.canada.ca/en/health-canada/services/drugs-health-products/drug-products/applicationssubmissions/guidance-documents/bioavailabilitybioequivalence/conduct-analysis-comparative.html.
[13] 沈健 .ADaM应用于临床试验的研究与探讨 [D]. 南京:东南大学,2017:1-118.
[14] 王崇旭 . 临床试验数据管理电子化和 CDISC 数据自动化的实现 [D]. 南京:东南大学,2018:1-97.
[15] 朱天一,蔡晶晶,黄家俊,等 .ADaM在仿制药生物等效性试验安全性分析中的应用 [J]. 中国临床药理学与治疗学,2020,25(6):658-63.
[16] 吴正宇,方文韬,栾迪,等 .R 语言计算药动学参数及生物等效性分析 [J]. 中国现代应用药学,2020,37(3):308-313.
[17] 王建峰 . Ⅰ期临床药物试验统计分析报告规范化图表输出 [D]. 南京:东南大学,2018:1-8.
(收稿日期:2021-06-21)

