杜鹃红山茶ACO1的克隆及其表达分析研究
王江英 朱朋波 葛金涛 惠林冲 李纪元 孙明伟 赵统利 邵小斌 汤雪燕


摘 要:根据山茶(Camellia japonica)同源序列设计特异性引物,利用同源克隆和3,5-RACE技术,从杜鹃红山茶(C. azalea)花芽组织中克隆出ACC氧化酶(ACC-oxidase, ACO)基因,命名为CaACO1,基因全长1232 bp,开放阅读框963 bp,编码320个氨基酸。实时荧光定量PCR分析发现,ACO1在杜鹃红山茶不同组织中均得到表达,其中茎尖ACO1表达量最低,其次花芽、叶芽、根尖,表达量较高的是真叶和花器官,随着叶片成熟和花器官发育ACO1表达量均逐渐增加。结果表明,该基因可能参与杜鹃红山茶叶片发育,并且与花器官衰老密切相关。ACO1在参试的8个山茶品种花器官发育过程中的表达模式基本一致,但不同品种间的表达量存在差异。相关性分析发现ACO1表达量与花型、花色、花径和花瓣数4个形态指标均无显著相关性。
关键词:山茶;ACC氧化酶;基因克隆;表达分析;形态指标
Abstract: On the basic of homologous sequences of Camellia japonica, an ACC-oxidase (ACO) gene was cloned from the floral bud of C. azalea by the 3,5-RACE technology named CaACO1. The full-length cDNA of CaACO1 was 1232 bp, containing a 963 bp ORF which encoding 320 amino acids. Expression of ACO1 in the four development periods of the floral organ in C. azalea were analyzed by fluorescent quantitative real-time PCR. ACO1 was expressed in twelve samples differently, where the expression level of ACO1 in shoot tip was the lowest, medium in flower bud, leaf bud and root tip, the highest in true leaves and flower, which indicated that ACO1 may be involved in the leaf development of C. azalea and associated with flower senescence. The trends of expressions of ACO1 were almost the same as in the four development periods of the eight camellias, but the expression levels were different. Correlation analysis found that the expression of ACO1 was not significantly correlated with four morphological indexes of flower type, flower color, flower diameter and petal number.
Keywords: Camellia japonica; ACC-oxidase; gene clone; expression analysis; flower organ characteristics
山茶(Camellia japonica)树形优美,叶色浓绿,花形多样,色彩丰富,花期较长,从10月到翌年5月都有开放,盛花期1—3月,具有极高的观赏价值[1]。近年来新发现的杜鹃红山茶(C. azalea)是山茶属中能够四季开花的奇特原种,是中国独有的宝贵山茶种质资源[2]。然而单朵花开放时间因不同山茶品种存在差异,但盛花期7~ 10 d后花朵均衰老败落。通过分子生物学技术研究花器官发育相关基因可为花期延长提供依据。
乙烯是植物衰老的主要调控因子,参与植物的种子萌发、生根、茎叶生长、花芽分化以及叶片和花器官衰老等不同的生理发育过程[3-4]。ACC氧化酶(ACO)是乙烯生物合成途径中的最后一个酶,抑制ACO活性可以降低乙烯生成,从而延缓切花衰老和提高盆花品质[5-6]。切花衰老期间,ACO在花器官不同部位表达量急剧增加,乙烯释放量也对应升高,而反义表达ACO基因,能降低转基因植株中的乙烯含量,从而延迟花瓣的衰老[7-8]。目前已从多种观赏花卉(如香石竹、百合及水仙)中克隆出ACO,反义ACO转化香石竹后瓶插寿命延长,实时荧光定量PCR表明,ACO在水仙花瓣中的表达均随着花器官衰老而逐渐上升[9-13]。
本研究以杜鹃红山茶为材料,分离出ACO1基因,通过实时荧光定量PCR技术分析其在杜鹃红山茶不同组织中的表达量,以及探究ACO1基因在叶片生长和花器官发育过程中的表达模式。另外,测定8种山茶花器官不同发育时期CaACO1基因表达量与花的形态指标进行相关性分析,为研究CaACO1基因在山茶乙烯合成及花器官形态建成中的功能研究提供理论基础。
1 材料与方法
1.1 材料
2017年4月从浙江金华引进5年生杜鹃红山茶实生苗,2017年夏季能正常开花,2018年夏季采集根尖、茎尖、叶芽、第3片真叶、第5片真叶、第7片真叶、第10片真叶,以及花芽萌动、现蕾期、孕蕾期、开花期、衰老期的花器官组织,共12个样本。2018年10月从山东青岛引进3年生且立地条件相同的110份山茶種质,2019年3月大部分品种处于盛花期,从中选择花型、花色和花径等性状特征不同的8份种质(表1),分别采集现蕾期、孕蕾期、始花期、盛花期的花器官组织。所有采集样本液氮速冻,-80 ℃冰箱保存备用。
1.2 CaACO1的克隆
按照EASY Spin Plus植物RNA快速提取试剂盒说明书提取总RNA。根据GenBank公布的ACO1同源基因序列进行保守区片段扩增,再按照TaKaRa 5-Full RACE Kit、3-Full RACE Kit说明书进行目的片段5和3末端的扩增,所用引物见表2。
1.3 生物信息学分析
DNAMAN 8.0软件序列拼接后在NCBI上进行Blast同源性比对,选择同源性较高的8种植物,运用DNAMAN 8.0软件和MEGA 6.0软件进行氨基酸多序列比对和系统进化树分析。利用ProtParam软件(http://cn.expasy.org)分析蛋白质的理化特性,HNN软件(http://npsa-pbil.ibcp.fr/)进行蛋白二级结构分析;采用Swiss-model同源建模方法预测蛋白质相应的三级结构。
1.4 CaACO1在杜鹃红山茶不同组织中的表达分析
利用实时荧光定量PCR方法,检测CaACO1在杜鹃红山茶12个组织样品包括根尖、茎尖、
叶芽、第3片真叶、第5片真叶、第7片真叶、第10片真叶,以及花芽萌动期、现蕾期、孕蕾期、开花期、衰老期花器官中的表达量,以山茶GAPDH为内标(所用引物见表2),生物学试验重复3次。运用2?Ct法求得相对表达量。
1.5 CaACO1在花器官中的表达分析
利用实时荧光定量PCR方法,检测CaACO1在8个参试山茶品种现蕾期、孕蕾期、始花期和盛花期整个花器官中的表达量,以山茶GAPDH为内标(所用引物见表2),生物学试验重复3次。
运用Y=10?Ct/3法计算实际表达量[14]。
1.6 CaACO1表达量与山茶的花器官形态指标相关性分析
应用模糊数学隶属分析法计算ACO1表达量的综合隶属值和8种山茶的形态指标(花径、花瓣数)的平均隶属值[15],利用SPSS 19.0软件对不同山茶形态指标的平均隶属值和盛花期ACO1表达量隶属函数值进行相关性分析。
2 结果与分析
2.1 CaACO1全长cDNA序列克隆
以杜鹃红山茶小花芽RNA反转录的cDNA为模板,保守区片段扩增,经测序获得长388 bp的序列(图1A),NCBI Blast同源序列比对显示,与其他物种的基因序列同源性高达90%,确认此序列为杜鹃红山茶ACO1基因的一段序列。利用5-RACE和3-RACE技术,从杜鹃红山茶小花芽总RNA中分别获得ACO1 cDNA的5和3端序列。测序结果表明5-RACE产物长度为741 bp(图1B),3-RACE产物长度为774 bp(图1C)。DNAMAN 8.0软件拼接序列获得基因全长1232 bp,命名为CaACO1,利用ORF Finder分析CaACO1的CDS区为963 bp(图1D),编码一条含320个氨基酸,分子量为36.164 kD,等电点为5.40的蛋白质。
2.2 CaACO1的生物信息学分析
利用NCBI Blast和DNAMAN 8.0软件对杜鹃红山茶及同源性较高的8个物种(茶树登录号:ABI33224.1,光皮桦登录号:ADK39027.1,咖啡树登录号:AGM48542.1,猕猴桃登录号:AEM62884.1,芍药登录号:AEK70335.1,柿子登录号:BAB89351.1,桃树登录号:AAL26910.1和天竺葵登录号:AAC48977.1)的ACO氨基酸序列进行多序列比对,结果(图2)表明,CaACO1编码的CaACO以α-螺旋和无规则卷曲作为主要骨架,延伸链所占比例较小,无β-转角;序列分析显示,CaACO在序列中部保守性较高,具有1个PcbC superfamily保守结构域。应用MEGA 6.0软件中的邻位相连法构建了9种高等植物的ACO系统发育树(图3),从归类结果可以看出,杜鹃红山茶和茶树同为山茶属植物,在亲缘关系上相对较近,与植物分类结果一致。
2.3 CaACO1在杜鹃红山茶中的表达分析
CaACO1在杜鹃红山茶不同组织中均有转录表达(图4A),其中茎尖中表达量最低,花芽、叶芽和根尖中的表达量分别是茎尖的2.29倍、4.04倍和9.27倍;第3片真叶、第5片真叶、第7片真叶、第10片真叶的表达量分别为叶芽的4.71倍、8.41倍、11.08倍、15.49倍(图4B);现蕾期、孕蕾期、开花期、衰老期的表达量分别为花芽萌动期的5.07倍、11.74倍、42.27倍、23.23倍(图4C)(P<0.05)。结果表明,CaACO1在茎尖、花芽、叶芽和根尖等幼嫩组织中的表达量较低,随着叶片的不断成熟以及花器官不断发育,CaACO1的表达量逐渐增加,且表达模式基本一致。
2.4 CaACO1在不同山茶中的表達分析
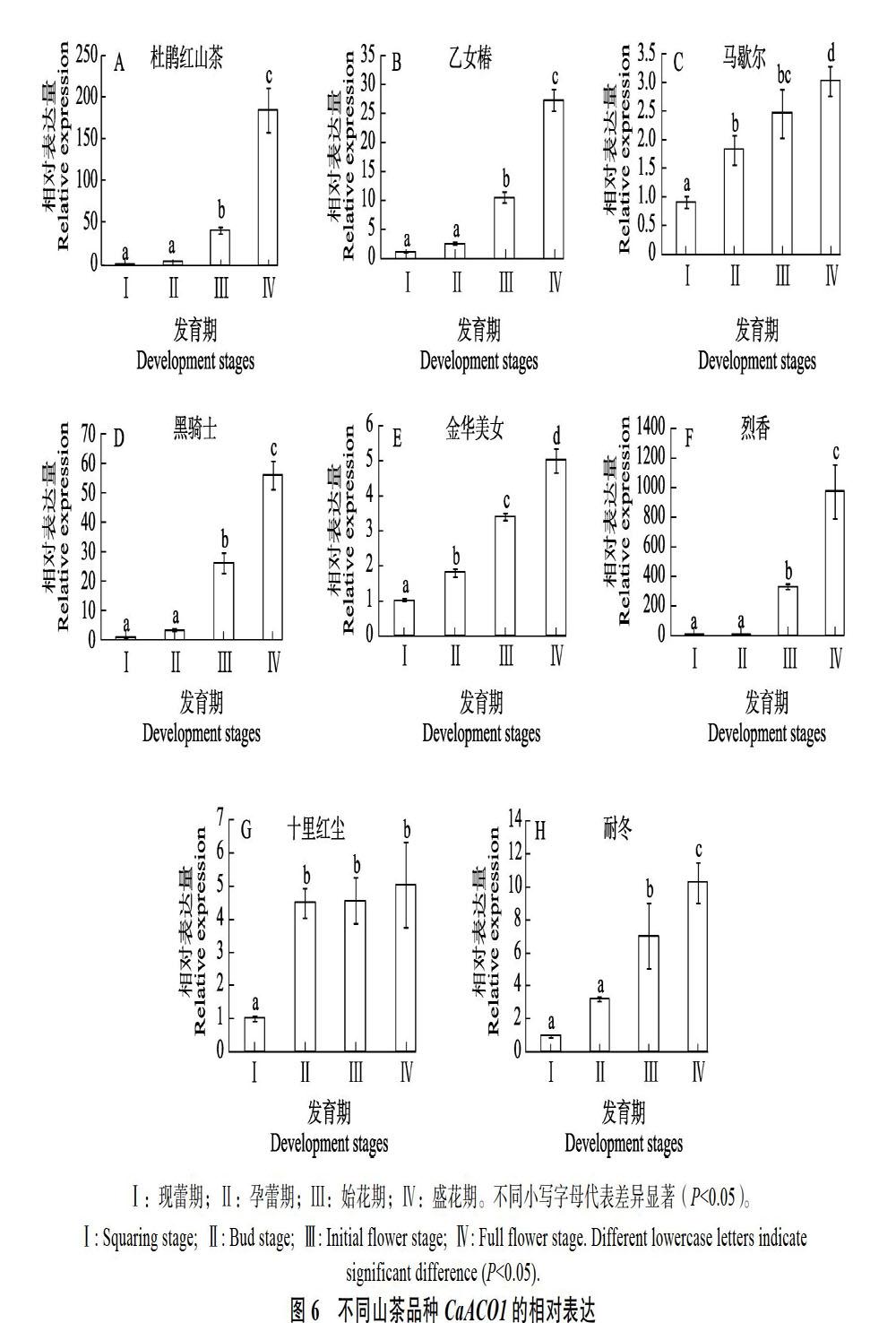
杜鹃红山茶的花器官4个发育时期(图5A)中,CaACO1在现蕾期和孕蕾期表达量差异不显著,与始花期和盛花期差异显著,其中现蕾期中的表达量最低,孕蕾期和始花期的表达量分别是现蕾期的4.59倍和22.89倍,盛花期表达量最高,高达35.09倍(图6A)。CaACO1在‘乙女椿(图5B、图6B)、‘马歇尔(图5C、图6C)、‘黑骑士(图5D、图6D)、‘金华美女(图5E、图6E)、‘烈香(图5F、图6F)、‘十里红尘(图5G、图6G)和‘耐冬(图5H、图6H)中的表达情况与杜鹃红山茶相似。8种山茶的花器官4个发育时期CaACO1表达量均随着花器官的成熟而增加(P<0.05)。比较发现,现蕾期CaACO1表达量最低,孕蕾期的表达量约为花苞期的2.60~5.78倍,平均3.71倍;始花期的表达量约为花苞期的7.52~22.89倍,平均12.97倍;盛花期的表达量约为花苞期的18.38~35.09倍,平均25.02倍(图6),表明CaACO1在幼嫩的花器官组织中表达水平较低,随着花器官的不断成熟,始花期表达量骤升,盛花期表达量达到最高,由此推测,CaACO1可能参与山茶的花器官发育,并且与花衰老密切相关。
2.5 CaACO1表达量与花器官形态指标相关性分析
利用SPSS Pearson对花径/花瓣数平均隶属函数(△)和盛花期ACO1表达量的隶属函数(RE-MFV)进行双变量相关性分析,结果显示,8种山茶的花径、花瓣数与盛花期ACO1表达量无相关性。
8种山茶中,根据花型可以分为4类(表3),第1类T1为单瓣(杜鹃红山茶、‘耐冬)、第2类T2为半重瓣(‘黑骑士)、第3类T3为玫瑰重瓣至松散牡丹型(‘马歇尔)、第4类T4为牡丹型(‘烈香)、第5类T5为完全重瓣型(‘乙女椿‘金华美女‘十里红尘)。T1类的杜鹃红山茶和‘耐冬的RE-MFV值排序分别为2和6,T2类的‘黑骑士排序为4,T3类的‘马歇尔为8,T4类的‘烈香为1,而T5类的‘乙女椿‘金华美女和‘十里红尘则分别为3、7、5,由此说明8种山茶的RE-MFV值與花型不存在明显的相互关系。根据花色指标从浅至深的排序结果与RE-MFV的排序结果不完全一致,说明RE-MFV值与花色也无明显关系。
综上可以看出,8种山茶盛花期的ACO1表达量与花型、花色、花径、花瓣数都无显著相关性。
3 讨论
杜鹃红山茶组织特异性表达分析显示,CaACO1在12个组织样品中均表达,表达量差异显著,其中幼嫩组织茎尖、花芽、叶芽和根尖表达量较低,而叶片和花器官中的表达量则相对较高,并且随着叶片的不断成熟和花器官的发育,表达量基本呈递增趋势,说明CaACO1基因在叶片和花器官衰老过程中具有重要作用。其中,相对于开花期,衰老期的表达量有所下降可能是随着花的衰老,细胞活性降低所造成。周露等[16]发现SmACO1在丹参不同组织中均有表达,根、茎、叶中的表达量较低,花中的表达量最高;NtACOY2基因在花瓣和副冠中的表达均随着‘云香水仙花的衰老而逐渐上升[11]。田晓岩等[7]通过研究发现,在文心兰切花衰老期间,OnACO2在唇瓣、花萼、侧瓣和蕊柱中表达水平都急剧升高,认为OnACO2基因是一个对花衰老发挥功能的基因。本研究可以推测,ACO1对花器官衰老起负调控作用[17],康乃馨转入反义ACO后,抑制其内源ACO基因的表达,从而降低乙烯的生物合成,并且可以延迟花瓣衰老[8, 18]。转化反义ACO的‘黄星香石竹在隔离条件下栽培开花正常,其切花在25 ℃条件下瓶插寿命延长了4 d[10],吴晓庆等[19]也发现反义ACO转基因石竹瓶插花期和单朵花期比对照延长1倍,盆栽群体花期比对照延长15 d。
CaACO1在其他7种参试山茶的花器官中的表达模式与杜鹃红山茶基本一致,但4个发育时期8种山茶的ACO1表达量排序存在差异。现蕾期和孕蕾期,‘十里红尘表达量均最高,‘烈香表达量最低;而始花期和盛花期表达量最高的则均为‘烈香,表达量最低的分别为‘金华美女和‘马歇尔。由此推测,8种山茶花器官的ACO1表达模式虽然相似,但不同品种间随着花器官衰老表达量增长的幅度却不一致。一方面可能与山茶品种差异有关,也可能因为样品采集时花的发育程度不一致有关。
8种山茶的花器官4个形态指标中,可量化的2个指标花径、花瓣数与ACO1表达量的MFV值都不存在相关性,通过花型分类和花色排序也显示与之无相关性,本研究可以推测,ACO1基因可能参与山茶的花发育,并且与花器官衰老密切相关,而不参与花的形态结构与建成过程。
参考文献
张宏达. 山茶属植物的系统研究[M]. 中山大学学报编辑部, 1981.
管开云, 李纪元, 王仲朗. 中国茶花图鉴[M]. 杭州: 浙江科学技术出版社, 2014: 375.
Woltering E J, van Doorn W G. Role of ethylene in senescence of petals-morphological and taxonomical relationships[J]. Journal of Experimental Botany, 1988, 39(11): 1605-1616.
van Doorn W G. Categories of petal senescence and abscission: a re-evaluation[J]. Annals of Botany, 2001, 87(4): 447-456.
Nooden L D, Jones M L. Changes in gene expression during senescence[M]. Plant Cell Death Processes. Amsterdam: Elsevier, 2004: 51-71.
Hoeberichts F A, van Doorn W G, Vorst O, et al. Sucrose prevents up-regulation of senescence-associated genes in carnation petals [J]. Journal of Experimental Botany, 2007, 58(11): 2873-2885.
田晓岩, 石乐松, 潘英文, 等. 文心兰OnACO2基因的克隆及表达分析[J]. 分子植物育种, 2015, 13(7): 1602-1610.
Savin K W, Baudinette S C, Graham M W, et al. Antisense ACC oxidase RNA delays carnation petal senescence[J]. HortScience, 1995, 30(5): 970-972.
余义勋, 张俊卫, 孙振元, 等. 香石竹ACC氧化酶基因的克隆与植物表达载体构建[J]. 林业科学研究, 2002, 15(3): 256-260.
余义勋, 余义勋, 包满珠. 反义ACO基因导入获得瓶插寿命长的香石竹植株[J]. 园艺学报, 2004, 31(5): 633-636. d
刘鲜艳, 刘雅莉, 王跃进, 等. 百合ACC氧化酶基因全长cDNA的克隆及序列分析[J]. 西北植物学报, 2008, 28(4): 4651-4656.
许洁婷. 百合LlACO1基因克隆与遗传转化受体系统的建立[D]. 上海: 上海交通大学, 2008, 15-31.
孙申申, 温秀萍, 陈晓静. ‘云香水仙ACC氧化酶基因的克隆表达分析及其遗传转化与鉴定[J]. 西北植物学报, 2017, 37(9): 1685-1692.
Li X B, Fan X P, Wang X L, et al. The cotton ACTIN1 gene is functionally expressed in fibers and participates in fiber elongation[J]. Plant Cell, 2005, 17(3): 859-875.
王彩华. 模糊论方法学[M]. 北京: 中国建筑出版社, 1988.
周 露, 化文平, 王喆之, 等. 丹参ACC氧化酶基因(SmACO1)的克隆与序列分析[J]. 植物研究, 2012, (5): 584-590
Tang X Y, Gomes A M T R, Bhatia A, et al. Pistil-specific and ethylene-regulated expression of 1-aminocyclopropane- 1-carboxylate oxidase genes in Petunia flowers[J]. Plant Cell, 1994, 6(9): 1227-1239.
张树珍, 汤火龙, 杨本鹏, 等. 康乃馨ACC氧化酶反义基因遗传转化康乃馨的研究[J]. 园艺学报, 2003, 30(6): 699-702, 778.
吴晓庆, 谭华山, 张静静, 等. 根瘤农杆菌介导ACO基因转化延长石竹花期的研究[J]. 华中农业大学学报, 2015, 34(6): 21-26.
责任編辑:谢龙莲

