巨大芽孢杆菌LB01粗提物对采后芒果炭疽病的生防效果及成分鉴定
丁从文,韦罗晴,马忠璇,周尚泽
(1.桂西区域生态环境分析和污染控制重点实验室,广西 百色 533000;2.百色学院化学与环境工程学院,广西 百色 533000)
研究表明,巨大芽孢杆菌(Bacillus megaterium,BM)对一些食品病害如香蕉大灰斑病、小麦纹枯病、辣椒疫霉病、花生黄曲霉病及生姜青枯病等均有良好的生防效果[1-5]。也有研究报道BM z12及BM B1301粗提液对水稻纹枯病菌(Corticium sasakii)有抑制效果[6-7],吉玉玉等[8]报道BM L2粗提物对番茄青枯雷尔氏菌(Ralstonia solanacearum)有抑制作用,赵妗颐等[9]报道BM L2粗提物对魔芋软腐病菌(Erwinia carotovora subsp.carotovora)有抗菌活性。然而,关于BM粗提物对由炭疽病菌(Colletotrichum gloeosporioides,CG)引起的芒果炭疽病的防治测试及BM粗提物中活性成分的分离鉴定,文献中少见报道。
前期研究已表明,BM LB01发酵滤液抑制了采后芒果CG菌丝生长和孢子萌发,抑制了芒果炭疽病的病斑扩展及芽管伸长[10]。本文在前期研究基础上,采用乙酸乙酯(ethyl acetate,EA)、石油醚(petroleun ether,PE)和二氯甲烷(dichloromethane,DCM)等有机溶剂对BM LB01发酵滤液中活性成分进行萃取,研究其粗提物对采后贮藏期芒果炭疽病菌的抑菌效果,并对防病效果最佳的粗提物进行活性成分分离纯化和结构鉴定,本期研究将为防治采后芒果炭疽病的新药合成提供微生物源先导化合物。
1 材料与方法
1.1 材料与试剂
菌株BM LB01:分离于百色市靖西县岩溶区芒果园果树根基土壤,保存于百色学院化学与环境工程学院天然有机化学研究室芽孢杆菌菌株储藏柜;病原菌CG:百色学院农业与食品工程学院提供;七成熟“台农”1号芒果:百色市靖西县岩溶区芒果园;EA、PE、二甲基亚砜、DCM、施保克(分析纯):西亚化学科技(山东)有限公司;柱层析硅胶粉(100目~200目)、薄层层析硅胶板(F254):烟台维启化工产品有限公司;大孔吸附树脂(D101):天津市津达正源有限公司。
1.2 仪器与设备
MFa-b微孔膜过滤器:杭州惠合机械设备有限公司;XPR微量电子天平:梅特勒-托利多国际有限公司;GGC-X小型试管翻转振荡萃取器:北京国环高科自动化技术研究院;SE-1000小型旋转蒸发仪:北京仪信网通科技有限公司;LGZE-250型生化培养箱:杭州勒丰科技有限公司;EasYDish圆形细胞培养皿:赛默飞世尔科技(中国)有限公司;M2200-12道移液枪:杭州中旺科技有限公司;EFT-60/90台式核磁共振波谱仪:QUANTUM量子科学仪器贸易(北京)有限公司;HT-JZ-1接种器:济南腾昊科学仪器有限公司;DSX-280KB24高压灭菌器、ZX-1800超净工作台:凯越机械有限公司;RMP-SAC生物层析柱:江阴市新辉层析设备有限公司;Nexera MP制备型高效液相色谱仪:广州领托贸易有限公司。
1.3 试验方法
1.3.1 巨大芽孢杆菌LB01粗提物的制备
参考文献[10]的方法制备900 mL BM LB01无菌发酵滤液,于此发酵滤液中加入900 mL EA和200 mL H2O,剧烈摇动1 h,浸泡24 h,静置分层后取上层EA相。下层水相再次用等体积的EA浸泡相同时间,共萃取3次。将3次得到的EA相合并,用无水Na2SO4干燥后于旋转蒸发仪上减压浓缩,收集EA相浸膏。
采用同样的操作方法,制备PE和DCM相浸膏。
1.3.2 巨大芽孢杆菌LB01粗提物对采后芒果炭疽病的防治效果测定
1.3.2.1 药液配制
采用电子天平准确称量EA相浸膏1、2、4 mg溶解于熔融(45℃)的马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基或者二甲基亚砜(dimethyl sulfoxide,DMSO)中,配制 20、40、80 μg/mL 3 个系列浓度(药量500 mL),贴上标签,用于测定三类溶剂粗提物的体外和体内抗菌活性。称取4 mg施保克溶于DMSO中配制80 μg/mL药液,供试体积用量为500 mL。
采用同样的配制方法,配制PE和DCM相浸膏20、40、80 μg/mL 3 个系列浓度(药量 500 mL)。
1.3.2.2 培养基的配制及病原菌CG分生孢子悬浮液的制备
参照文献[11-13]的方法,进行PDA、马铃薯葡萄糖肉汤培养基和营养肉汤培养基配制及病原菌CG分生孢子悬浮液的制备,病原菌CG分生孢子悬浮液培养时间为4 d,并将其浓度调节为1.0×106/mL。
1.3.2.3 巨大芽孢杆菌LB01粗提物的体外抗菌活性测定
将EA、PE和DCM萃取相浸膏添加到熔融的PDA(45℃)培养基中,得到最终质量浓度分别为0、20、40、80 μg/mL的萃取相浸膏。在PDA板中心接种直径为6 mm的菌饼,黑暗中28℃恒温培养。直至对照组病原菌CG菌丝贴近培养皿边缘时,用游标卡尺计量菌落生长直径。每个菌落用十字交叉法垂直测量各一次,取其平均值。根据计量的菌丝生长直径,计算BM LB01粗提物对病原菌CG菌丝生长抑制率,并比较不同溶剂粗提物对CG菌丝生长的抑制活性,依据文献[14]的方法,统计BM LB01粗提物在1 d~6 d内对病原菌CG的菌丝生长抑制率。抑制率按如下公式计算。

1.3.2.4 巨大芽孢杆菌LB01粗提物的体内抗菌活性测定
以七成熟的“台农”1号芒果为试验材料,用无菌水对芒果进行冲洗,用NaClO消毒,在空气中风干后于芒果果实中心位置打孔(孔宽4.5 mm,孔深1.5 mm),用于接种病原菌CG和各类药剂,进行体内抗菌活性试验。
试验共分为6个小组,10次重复。
(1)阴性对照组(编号为T1):未给药,也未接种病原菌 CG;(2)阳性对照组(编号为 T2):仅接种 CG;(3)处理组(编号为 T3):200 μL 80 μg/mL 施保克+CG;(4)处理组(编号为T4):200 μL BM LB01发酵滤液+CG;(5)处理组(编号为 T5):200 μL 80 μg/mL EA 粗提物药液+CG;(6)处理组(编号为 T6):200 μL 80 μg/mLPE粗提物药液+CG。
除T1外的所有处理中,芒果果实伤口接种的病原菌CG分生孢子悬浮液的体积和浓度均为100 μL、1.0×106/mL,T3~T6组接种各类药液1.5 h后,再接种病原菌CG。参考文献[15]的计算方法,于第7天统计供试组芒果病斑面积(lesion area,LA)及药剂生防效果(biocontrol efficacy,BE)。
1.3.3 巨大芽孢杆菌LB01粗提物化学成分的分离纯化
将EA相浸膏(5 g)和D101大孔树脂(5 g)混合于烧瓶中,再注入250 mL PE,室温(20℃~25℃)下电磁搅拌5 min,用砂芯漏斗抽滤,用干法将样品装上大孔树脂柱初步分离,不同体积比(5∶1、1∶1、1∶5)洗脱剂PEEA对样品进行减压梯度洗脱[16],共收集到F1~F4 4个组分,组分F3(90 mg)用100目~200目硅胶柱分离,洗脱剂 DCM-PE(体积比为 1∶5、1∶1、5∶1)进行梯度洗脱,共收集到F5~F8 4个组分。用薄层色谱(thin-layer chromatography,TLC)检测,用反相制备型高效液相色谱法进行精细分离纯化[17]。将 F2(75 mg)和 F8(95 mg)组分用反相制备型高效液相色谱(high performance liquid chromatography,HPLC)纯化,洗脱剂 CH3CN-H2O(体积比 1∶4)洗脱,最终获得单一活性成分 a(28 mg)、b(30 mg)、c(32 mg)。
1.3.4 巨大芽孢杆菌LB01粗提物化学成分的结构鉴定
将单一活性成分a、b、c溶于DMSO-d6(碳谱测定无需氘代溶剂),形成溶液后加入核磁管进行氢谱(1hydrogen nuclear magnetic resonance,1H-NMR)和碳谱(13carbon nuclear magnetic resonance,13C-NMR)测定,获取的数据与原始文献比对鉴定。
1.4 数据处理
运用Excel 2010对数据作图,通过SPSS软件,进行结果差异性分析,p<0.05为差异显著。
2 结果与分析
2.1 巨大芽孢杆菌LB01粗提物对采后芒果炭疽病菌生长的体外抑制
采用乙酸乙酯(EA)、石油醚(PE)和二氯甲烷(DCM)为萃取剂,从巨大芽孢杆菌(Bacillus megaterium)LB01 发酵滤液中萃取的 0(对照)、20、40、80 μg/mL等不同浓度的粗提物对PDA平板上炭疽病菌(Colletotrichum gloeosporioides)生长的抑制作用情况,如图1所示。
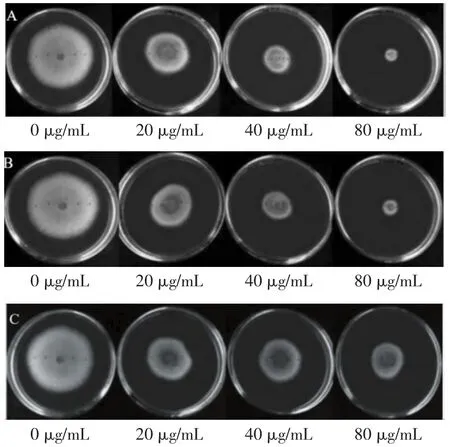
图1 不同浓度粗提物对PDA板上炭疽病菌的抑制活性Fig.1 Inhibitory activity of crude extracts with different concentrations against Colletotrichum gloeosporioides on PDA board
由图1可知,EA、PE和DCM粗提物对PDA平板上接种的炭疽病菌的抑制活性顺序为EA相浸膏>PE相浸膏>DCM相浸膏。
表1~表3为不同浓度的EA、PE和DCM粗提物对炭疽病菌菌丝生长的抑制率。

表1 不同浓度的EA粗提物对炭疽病菌菌丝生长的抑制率Table 1 Inhibition rate of different concentrations of crude extracts by EA on mycelial growth of Colletotrichum gloeosporioides
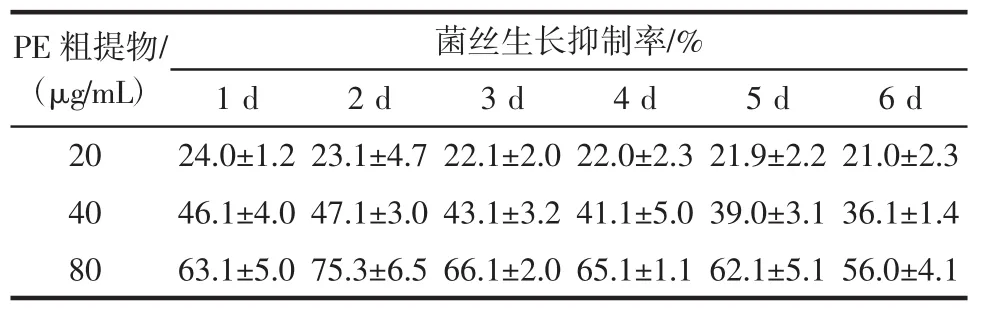
表2 不同浓度的PE粗提物对炭疽病菌菌丝生长的抑制率Table 2 Inhibition rate of different concentrations of crude extracts by PE on mycelial growth of Colletotrichum gloeosporioides

表3 不同浓度的DCM粗提物对炭疽病菌菌丝生长的抑制率Table 3 Inhibition rate of different concentrations of crude extracts by DCM on mycelial growth of Colletotrichum gloeosporioides
表1~表3显示,EA和PE粗提物抑制病原菌生长的效果优于DCM。EA和PE粗提物(80 μg/mL)在培养2 d后对病原菌生长的抑制率最高,分别为(76.2±5.2)%和(75.3±6.5)%。第2天后,不同溶剂粗提物对病原菌的生长抑制效果随处理时间的延长而降低。而不同溶剂粗提物的抗菌活性随粗提物浓度的增加而增加,反之亦然。由于DCM粗提物的抗菌活性较低,因此选择EA和PE粗提物进行芒果果实体内防治试验测定。
2.2 巨大芽孢杆菌LB01粗提物对采后芒果炭疽病的体内防治效果
为研究巨大芽孢杆菌LB01 EA和PE粗提物对采后芒果炭疽病的体内防治效果,本试验于第7天观察了供试组(T1~T6)芒果的发病情况,测定了它们的病斑面积,并统计了各类药剂的生防效果。其试验结果如图2及表4所示。

图2 芒果贮藏至第7天后的炭疽病发病情况Fig.2 Symptoms of postharvest mango anthracnose after 7 days storage

表4 不同药剂处理对采后芒果炭疽病病斑面积及生防效果统计结果Table 4 Statistical results of lesion area and biocontrol efficacy of postharvest mango anthracnose treated with different fungicides
由图2可以得出,阳性对照组(T2)接种芒果炭疽病菌7 d后出现明显的炭疽病病害症状,伤口扩大并覆盖了整个损伤口区域。施保克处理组(T3)和EA粗提物处理组(T5)的芒果发病程度相似,并且比较轻微。T3和T5对芒果采后炭疽病的防治效果明显优于巨大芽孢杆菌LB01发酵滤液(T4)及PE粗提物处理组(T6)。阴性对照组(T1)没有接种芒果炭疽病菌,也没有给药,但贮藏至第7天后,T1与T5~T6类似,也出现病斑,可能是潜伏于采前芒果中的炭疽病菌所致。
由表4统计结果可知,采用化学杀菌剂施保克(T3)和EA粗提物(T5)施药1.5 h后,于芒果果实损伤口上接种炭疽病菌孢子悬浮液(1.0×106/mL),培养7 d后芒果炭疽病受到强烈抑制。T3和T5组的芒果病害表现状态与T1(阴性对照)相似。巨大芽孢杆菌LB01发酵滤液和PE粗提物对芒果炭疽病的防治效果均低于EA粗提物。EA粗提物(T5)的病斑面积(LA)与阳性对照组(T2)相比较,显著降低(p<0.05),并且 EA 粗提物(T5)对芒果炭疽病的防治效果高达(89.55±1.12)%,比T4和T6高10%以上。
2.3 巨大芽孢杆菌LB01粗提物的化学成分结构鉴定
将体外和体内防病效果均最佳的EA粗提物浸膏通过大孔树脂、硅胶和反相制备型液相色谱分离纯化后获得3个单体化合物a、b、c,其熔点、氢谱和碳谱数据如下。
化合物a:无色针状晶体,熔点201℃~203℃;1HNMR(600 MHz,DMSO-d6)δ:3.29(2H,s,H-2),6.71(2H,d,J=7.6 Hz,H-5,7),7.15(2 H,d,J=7.6 Hz,H-4,8);13CNMR(150 MHz,CH3CN)δ:39.8(C-2),119.1(C-5,7),126.0(C-3),132.1(C-4,8),160.3(C-6),181.3(C-1)。以上熔点及核磁图谱数据与文献[18-19]报道的4-羟基苯乙酸的数据相符。
化合物b:无色针状晶体,熔点187℃~189℃;1HNMR (600 MHz,DMSO-d6)δ:5.64 (2H,s,-NH2),6.83(2H,d,J=10.0 Hz,H-3,7),7.78 (2H,d,J=10.0 Hz,H-4,6);13C-NMR(150 MHz,CH3CN)δ:114.9(C-2),117.2(C-3,7),134.2(C-4,6),156.1(C-5),179.5(C-1)。以上熔点及核磁图谱数据与文献[20-21]报道的4-氨基苯甲酸的数据相符。
化合物c:浅黄色晶体,熔点174℃~176℃;1HNMR(600 MHz,DMSO-d6)δ:3.92(3H,s,H-10),6.62(1H,d,J=16.1 Hz,H-9),6.96(1H,d,J=9.2 Hz,H-5),7.07(1H,dd,J=9.2,2.4 Hz,H-3),7.31(1H,d,J=2.4 Hz,H-2),7.82(1H,d,J=16.1Hz,H-8)。13C-NMR(150 MHz,CH3CN)δ:53.7(C-10),111.2(C-3),116.4(C-5),116.9(C-8),123.3(C-6),126.1(C-9),145.3(C-4),149.1(C-7),150.2(C-2),178.0(C-1)。以上熔点及核磁图谱数据与文献[22-23]报道的3-甲氧基-4-羟基肉桂酸的数据相符。
基于以上数据可以推断粗提物中化学成分a、b、c的结构式如图3所示。
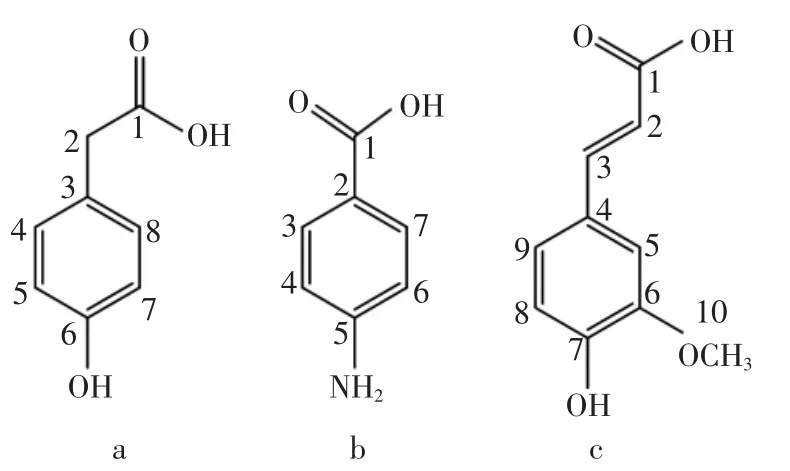
图3 EA粗提物中化学成分的结构式Fig.3 Structural formula of compounds from crude extract of EA
3 结论
本试验先用乙酸乙酯(EA)、石油醚(PE)和二氯甲烷(DCM)3种不同极性有机溶剂作为萃取剂制备了3类巨大芽孢杆菌(Bacillus megaterium,BM)LB01粗提物。PDA平板离体试验法确认了0(对照)、20、40、80 μg/mL EA和PE粗提物抗菌活性明显强于DCM粗提物,芒果活体试验中,80 μg/mL EA粗提物对采后芒果炭疽病的活体防治效果类似于化学杀菌剂施保克,且显著优于PE粗提物。最后采用大孔树脂、硅胶柱及制备型液相色谱等方法对防病效果最佳的EA粗提物化学成分进行分离纯化,通过氢谱和碳谱数据测定,并与原始数据比照进行化学成分鉴定,共获得3个化合物 a(4-羟基苯乙酸)、b(4-氨基苯甲酸)、c(3-甲氧基-4-羟基肉桂酸)。

