变温处理对西红花花芽分化及其生理生化的影响
吴光炎,孙莉琼,王康才,刘小兰,唐晓清*,张 凯,郝雯菁
(1 南京农业大学中药研究所,南京 210095; 2 南通御福源药业有限公司 江苏南通 226011)
西红花(CrocussativusL.)属鸢尾科(Iridaceae)西红花属的多年生三倍体球茎类球根花卉,又名藏红花、泊夫兰、撒馥兰等[1]。西红花原产于伊朗、小亚细亚半岛和希腊,后引种到印度、地中海盆地、东欧和中国,以其干燥的柱头入药,具有活血化瘀、凉血解毒和解郁安神的功效[2]。西红花喜冷凉湿润和半阴环境,较耐寒。球茎夏季休眠,秋季发根、萌叶。10月下旬开花,花朵日开夜闭。西红花在中国引种后逐渐探索出“二段法”栽培模式,即当年11月至翌年7月,开花后将母球种植于大田,越冬生长并发育生成仔球,翌年7月采收后于室内干燥储藏,8~10月仔球茎在暗光阴湿条件下上架催芽、开花,之后采收花的柱头干燥入药[3]。西红花有较强的药理活性和极高的经济价值,近年来其市场需求逐年递增,已经被国家中医药管理局列为重点发展的中药材品种[4],但其基原植物西红花球茎来源不足、且繁殖系数低的问题仍没有得到妥善解决,药材西红花大规模生产的愿景仍然无法实现,找到西红花增产方法的问题迫在眉睫[5]。目前已有许多影响西红花产量和品质因素的研究,环境因子、栽培技术及母球大小等是影响西红花产量和品质的主要因素[6]。
在植物花芽分化的过程当中,温度是影响西红花花芽分化最重要的因素之一[7]。因温度参与了植物的一系列生活周期,它影响着植物的光合作用及呼吸作用,影响有机物的合成与运输,而不同植物花芽分化所需要的温度是不同的。有研究表明,花分生诱导的最适温度应在9~25 ℃,而随后需要进行几周的低温处理,可以促进茎的伸长以及花期的正常[8]。
温度是影响西红花生长发育的一个关键因素,大田培育期间适宜的温度范围在1~19 ℃,冬季寒冷时可耐受-8~-7 ℃的低温,但当温度低于-10 ℃时会严重影响植株的发育,导致植株发育不良,并且致使新球茎变小[9]。因此当有极冷天气出现时,应注意对田间栽培的西红花进行保暖措施。室内培育阶段的适宜温度在24~28 ℃之间,花芽分化对温度的需求是需要经历“低温-高温-低温”过程,最终顺利进行花芽分化[10]。可见,花芽分化期间的温度不是一成不变,而是需要经历变温过程才能顺利进行花芽分化,因此探索适宜花芽分化的变温是促进花芽分化的重要举措。本研究采用变温处理西红花球茎,考察西红花营养生长及药材西红花活性物质的变化,从而探究变温处理对西红花花芽分化及其品质的影响,为两段式栽培方式的室内培育部分提供理论参考。
1 材料和方法
1.1 实验材料
实验材料来自江苏南通御福源药业有限公司,经南京农业大学王康才教授鉴定为鸢尾科植物西红花(CrocussativusL.)的球茎。实验于2019年在南京农业大学园艺学院的光照培养箱内进行,选取225个大小均匀的西红花球茎,其重量为18±2 g,无病虫害,随机分成5组,每组球茎45个,于2019年6月25日移入光照培养箱。培养条件为:光照培养12 h,光照强度为2 000 lux,暗培养12 h,湿度保持80%。
1.2 实验设计
实验设置20 ℃-25 ℃-20 ℃(T1)、20 ℃-30 ℃-25 ℃(T2)、25 ℃-35 ℃-25 ℃(T3)3组三阶段变温处理,并设置经验变温对照组25 ℃-30 ℃-25 ℃(CK1)和恒温对照组25 ℃-25 ℃-25 ℃(CK2)。自2019年6月25日起,将T1、T2置于20 ℃的光照培养箱内,将T3、CK1、CK2置于25 ℃的光照培养箱内,分别进行第Ⅰ阶段处理,处理时间为20 d;自2019年7月15日起,将T1、CK2置于25 ℃培养箱内,将T2、CK1置于29 ℃的光照培养箱内,将T3置于35 ℃的光照培养箱内,进行第Ⅱ阶段的温度处理;自2019年8月5日起,将T1置于20 ℃的光照培养箱内,将T2、T3、CK1、CK2置于25 ℃的光照培养箱内,分别进行第Ⅲ阶段的温度处理,直到8月25日结束。在变温处理期间,分别于7月14日、8月14日和8月24日取样,每组随机选取15个西红花种球,从其球茎基部混合取样共2 g,保存于液氮中用于测定淀粉、可溶性糖、可溶性蛋白含量与CAT、POD、SOD等酶活性,同时测定IAA、GA等内源激素含量,8个指标均为鲜重测定值,每个指标3次重复,取平均值。
1.3 观测项目及方法
1.3.1 球茎生物量测定变温处理前分别对5组西红花球茎称重,每组随机选取15个球茎,3次重复,并记录数据。在变温处理结束(即8月25日)后,取出球茎再次称重,分析其处理前后的生物量差异。经三个阶段变温处理后,定期观测每个处理组的花芽长度并记录,开花后记录每个处理的首花时间。
1.3.2 花芽分化过程的形态观察采用石蜡制片法对球茎顶芽进行纵切,切片厚度8~10 μm,番红-固绿对染,中性树胶封片,Leica DM2000光学显微镜观察、拍照[10]。
1.3.3 球茎生理生化指标测定参照《植物生理学研究技术》[11]中方法,采用蒽酮比色法测定球茎淀粉、可溶性糖含量,采用考马斯亮蓝G-250染色法测定可溶性蛋白质含量,采用H2O2分解法测定CAT活性,采用愈创木酚法测定POD活性,采用氮蓝四唑法测定SOD活性。在变温处理结束后,即8月24日取样,采用酶联免疫法测定球茎IAA、GA含量。
1.4 数据处理
采用SPSS 21. 0软件进行单因素方差分析和差异显著性分析,Excel 2010进行绘图。
2 结果与分析
2.1 变温处理对西红花球茎生长的影响
在变温处理前后,西红花球茎的生物量在各组变温处理间及对照组间均无显著差异;花芽长度在5个变温处理组间存在显著的差异,并以T1处理最长,它稍高于T2处理,但显著高于T3、CK1、CK2处理(P<0.05),而T2、T3、CK1、CK2处理间无显著差异(表1)。同时,在变温处理后80和110 d时,各处理组的花芽长度均表现为T1>T2>CK1>CK2>T3,且T1处理明显高于其余处理(图1,A、B),这与表1的表现一致。同时,各变温处理组球茎的首花时间存在明显差异(图1,C-G),其中T1处理的首花时间最早(11月5日),T2和CK1处理次之(11月12日),T3、CK2处理较晚(11月13日);T1处理首花时间比T2和CK1处理早7 d,比T3和CK2处理早8 d。可见,各组变温处理均对西红花球茎生物量无显著影响。T1变温处理对花芽的生长有显著促进作用,且在花芽分化过程中花芽长度和生长状况始终优于其他各组,首花时间比其他处理组早7~8 d;T2组生长表现与对照组无明显差异;T3组花芽长度最短,生长状况最差,首花时间最迟,高温可能对花芽的生长具有一定程度的抑制作用,不适宜花芽的分化生长。

表1 变温处理后西红花的球茎生物量和花芽长度(n=15)
2.2 变温处理对西红花花芽分化过程中形态发育的影响
西红花从营养生长转变到生殖生长,再到最终完整花序的形成,需要经历一系列形态发育过程。西红花的花芽分化可为花芽未分化期、花芽分化初期、 花原基分化期、花被原基分化期、雄蕊原基分化期和雌蕊原基分化期等6个阶段。整个分化过程大概需要45 d左右,属于向心型发育,其中前期分化速度较快,后期分化缓慢[12]。图2显示,各变温处理组西红花球茎解剖学观察结果表明,5个处理组间的分化进程有明显差异,不同温度处理下的西红花球茎处于不同的花芽分化阶段。其中,T1处理组的球茎已处于花芽分化末期,T2、CK1、CK2组正处于花芽分化中期,T3组则处于花芽分化的初期。这表明不同的变温处理对西红花花芽分化产生了不同影响,较低的变温处理明显促进了西红花球茎花芽分化进程,而过高的温度组合则显著延缓西红花的花芽分化。

A、B.花芽生长:A.变温处理后第80天;B.变温处理后第110天;C-G.首花时间[C.11月5日(T1);D、F.11月12日(T2、CK1);E、G.11月13日(T3 、CK2)]图1 变温处理后西红花的花芽生长和首花时间A,B. Flower bud growth:A. The 80th day after variable temperature treatment; B. The 110th day after variable temperature treatment; C-G. First flowering time [C. T1, on November 5; D,F.T2 and CK1, on November 12; E,G. T3 and CK2, on November 13]Fig.1 Flower bud growth and first flowering time of C. sativus treated with variable temperature

GC. 营养生长锥;OPP. 外轮花被原基;IPP. 内轮花被原基;RC. 生殖生长锥图2 石蜡切片中西红花花芽分化的形态发育过程GC. Vegetative growth cone; OPP. Outer perianth primordium; IPP. Inner perianth primordium; RC. Reproductive growth coneFig.2 The morphological development process of flower bud differentiation of Crocus sativus L. in paraffin section
2.3 变温处理对西红花花芽分化过程中营养物质含量的影响
首先,淀粉作为西红花营养物质的主要贮藏形式之一,在花芽分化期间,只有不断地被消耗才能维持其正常的生理代谢活动[13]。各处理组西红花球茎的淀粉含量均随着变温处理进程呈现出逐渐降低的趋势(图3,A)。在变温处理第Ⅰ阶段,西红花球茎淀粉含量在5个处理组间相接近,无显著差异(P>0.05)。在变温处理第Ⅱ阶段,西红花球茎淀粉含量以T1处理组最高(194.68 mg·g-1),显著高于T3处理组合CK1组(P<0.05),而与T2组合CK2处理无显著差异;CK1组淀粉含量最低(164.00 mg·g-1),并与其他处理组差异显著。在变温处理第Ⅲ阶段,各处理组球茎的淀粉含量比第Ⅱ阶段大幅降低,T1、T2、T3和CK1处理组降幅分别达到34.1%、27.08%、18.21%和9.96%;球茎淀粉含量以CK1组最高(147.66 mg·g-1),T1、T2和CK2均与CK1差异显著,而与T3均无显著差异。以上结果表明西红花花芽分化期间不同变温处组间的淀粉消耗量存在差异,T1处理组球茎的淀粉消耗量较大,花芽分化旺盛,而T3处理组球茎淀粉含量降低幅度较小,淀粉代谢活动较缓慢,花芽分化慢于其他各组。
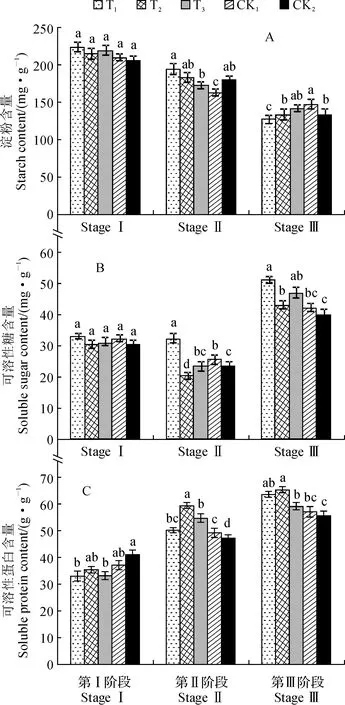
同期不同小写字母表示处理间在0.05水平存在显著性差异(P<0.05),下同图3 西红花花芽分化过程中营养物质含量的变化(n=15)The different lowercase letters within same stage indicate significant differences among treatments at 0.05 level (P < 0.05); the same as belowFig.3 The changes of nutrient contents in corm of Crocus sativus L. during flower bud differentiation (n = 15)
其次,可溶性糖由淀粉降解产生,是西红花花芽分化过程中可直接运输与利用的养分形式,为西红花花芽分化提供了充足的可直接利用的营养基础,对花芽分化具有积极意义。各处理组西红花球茎可溶性糖含量随着变温处理进程均呈现先降后升的变化趋势(图3,B)。在变温处理第Ⅰ阶段,各理组间球茎可溶性糖含量无显著差异。在变温处理第Ⅱ阶段,球茎可溶性糖含量在T2处理组大幅下降,显著低于两个对照组和其余处理组;T1处理组可溶性糖含量相比于第Ⅰ阶段稍有下降,显著高于其余处理组。在变温处理第Ⅲ阶段点,各处理组球茎的可溶性糖含量均比第Ⅱ阶段显著大幅上升,其中T1、T2、T3处理组含量均不同程度高于对照组CK1和CK2,且T1处理组与两对照组均差异显著,T2、T3处理组均与对照组CK2差异显著,T1、T2、T3分别显著高于CK2组27.5%、5.29%、19.60%。表明变温处理有利于西红花球茎可溶性糖的累积,且温度越低促进效果越佳。
再次,可溶性蛋白作为植物器官形态建成的结构与营养物质,在西红花花芽分化过程中不断积累,各处理组的可溶性蛋白含量随着变温处理进程均呈现逐渐上升趋势(图3,C)。这是因为西红花的花芽顶端分生组织在接受成花信号诱导后,需进行大量的成花相关基因的复制与转录,必然会诱导蛋白质的大量合成。其中,西红花球茎的可溶性蛋白含量在第Ⅰ阶段以CK2组最高,并与T1和T3差异显著,而与T2和CK1差异不显著。在第Ⅱ阶段,T1~T3组球茎的可溶性蛋白含量均不同程度高于两个对照组,T2处理组显著高于其余组,T1、T3组也与CK2差异显著。到第Ⅲ阶段,T1~T3组球茎的可溶性蛋白含量仍不同程度高于两个对照组,且均与CK2差异显著,仍以T2组最高;T1、T2、T3组可溶性蛋白含量分别高于CK1组11.13%、14.34%和3.62%,分别显著高于CK2组13.91%、17.19%和6.20%。表明变温处理对西红花球茎可溶性蛋白的合成有积极促进作用,且T1、T2组变温设定更有利于其可溶性蛋白的大量积累。
2.4 变温处理对西红花花芽分化进程中球茎抗氧化酶活性的影响
在花芽分化过程中,各处理组西红花球茎超氧化物歧化酶(SOD) 活性均在变温处理的3个阶段中总体呈上升趋势;T1和T2处理组SOD活性在3个阶段中始终处于较高水平,并大多高于同期的两个对照组;T3处理组SOD活性始终低于CK1,与CK2相比大多无显著差异;在变温处理第Ⅲ阶段,T1和T2处理组SOD活性分别比CK1显著增加11.14%、6.23%,分别比CK2显著增加15.50%、10.39%(图4,A)。可见,T1、T2变温处理有利于增强花芽分化过程中西红花球茎SOD活性。
同时,西红花球茎过氧化物酶(POD)活性在变温处理的3个阶段也均呈逐渐上升趋势;T1处理组POD活性在第Ⅰ、Ⅲ阶段均高于两个对照组,在第Ⅱ阶段显著高于CK2,稍高于CK1;T2处理组POD活性始终不同程度地高于两个对照组,但仅在第Ⅲ阶段显著与CK2差异达到显著水平; T3处理组POD活性始终与两个对照组无显著差异;T1和T2处理组POD活性在第Ⅲ阶段分别比CK1显著增加20.06%、1.61%,分别比CK2显著增加31.10%、10.95%(图4,B)。这表明T1、T2变温处理能显著提高花芽分化过程中西红花球茎POD活性,且T1处理效果比T2处理更佳。

图4 西红花花芽分化过程中球茎抗氧化酶活性的变化Fig.4 Changes of antioxidant enzyme activities in corm of Crocus sativus L. during flower bud differentiation
另外,西红花球茎过氧化氢酶(CAT)活性在花芽分化过程中呈现逐渐上升趋势。T1处理组CAT活性在第Ⅰ阶段稍高于T3组,而显著高于其他各处理组,在第Ⅱ阶段显著高于T3组,而与其他各处理组无显著差异,在第Ⅲ阶段与各处理组均无显著差异(图4,C)。以上结果表明仅T1变温处理在初期对西红花球茎CAT活性有显著促进作用,而在中后期各处理组对CAT活性均无显著影响。
2.5 变温处理对西红花花芽分化进程中内源激素含量的影响
首先,各处理组西红花球茎IAA含量随着花芽分化进程基本呈现先上升再下降的变化趋势,且各处理组间存在显著差异(图5,A)。其中,在第Ⅰ阶段,T1~T3处理组球茎IAA含量均不同程度地低于两个对照组,T2和T3处理组降幅达显著水平。在第Ⅱ阶段,T1处理组的IAA含量显著低于两个对照组,T2处理组IAA含量稍高于CK1,显著高于CK2,T3处理组IAA含量显著高于两个对照组;此时,T3处理组IAA含量(40.17 μg·g-1)比CK2显著提高26.2%,而T1处理组(28.35 μg·g-1)则比CK2显著降低11.12%。在第Ⅲ阶段,各处理组IAA含量比第Ⅰ、Ⅱ阶段大幅降低,其表现与第Ⅱ阶段相似,T1处理(11.59 μg·g-1)显著低于CK1,T2处理与两对照组无显著差异,T3处理(22.09 μg·g-1)则显著高于两个对照组。目前普遍认为低浓度的IAA是植物花芽分化所必须的,因此IAA浓度的降低一定程度反映了休眠的解除与花芽分化的开始。

图5 西红花花芽分化过程中球茎内源激素含量的变化Fig.5 The changes of endogenous hormone contents in corm of Crocus sativus L. during flower bud differentiation
其次,各处理组西红花球茎GA含量随着花芽分化进程整体呈逐渐下降趋势。其中,在第Ⅰ阶段,T1处理球茎GA含量显著低于对照和其余变温处理,T2处理显著低于CK1,与CK2无显著差异,T3处理则与两对照均无显著差异;在第Ⅱ阶段,T1处理GA含量仍低于其他处理组且大多达到显著水平,T2处理显著高于其他处理, T3处理则与两对照组无显著差异;在第Ⅲ阶段,各处理组GA含量间均无显著差异。说明不同处理组第Ⅲ阶段的温度设定对内源GA含量无显著影响,而各组内源GA含量最终趋于一致。
3 讨 论
3.1 变温处理下西红花花芽形态和分化进程的变化
西红花能否正常开花与球茎重量有着密切的关系[14]。本研究选用了重量在18 g左右大小均一的球茎,球茎重量在变温处理前后不同处理组间均无显著差异,但花芽长度在处理后两次测定中均以T1处理最长,T3处理最短,且两者之间存在显著性差异。同时,不同处理组球茎首花时间的观测结果显示,T1处理首花时间比T2和CK1早7 d,比T3和CK2早8 d,而且T1和T2处理的花瓣更大,柱头的长度、色泽均优于其他各组。另外,花芽分化作为西红花球茎从营养生长转向生殖生长的关键阶段,其好坏直接影响后续的开花率及柱头产量[15]。本研究采用传统石蜡切片法,在同一阶段随机取样观察其花芽分化情况,发现T1处理组已进入雌蕊原基分化期,而T3处理组还处于花芽分化初期,T1处理的花芽分化进程先于其他各组。可见,适宜的变温处理可使西红花球茎内部的生理生化进程加快,有利于打破西红花的休眠状态,提早进行花芽分化和开花;而且,低温处理组合更有利于花芽分化的进行,而相对高温处理会延缓花芽分化进程。
3.2 变温处理下西红花球茎的营养物质含量与花芽分化的关系
西红花球茎内部贮藏着淀粉、可溶性糖和可溶性蛋白等主要营养物质。淀粉和可溶性糖是鳞茎内较为重要的结构或能量物质,其含量的高低在一定程度上能反映植物体内可利用态物质和能量的供应状态[16]。可溶性蛋白与植物生长发育,尤其是花芽分化与发育有着密切的联系[17]。本实验结果表明,在休眠期进行西红花球茎的变温贮藏,会显著影响其淀粉、可溶性糖以及蛋白质含量的变化,其中T1处理可显著促进淀粉的降解,并相应促进可溶性糖及蛋白质的积累;而T3处理的球茎内淀粉降解较少,相应的可溶性糖及蛋白质含量的积累量也较低。因此,相对于T2、T3、CK1以及CK2处理,T1变温设置更有利于西红花球茎内可溶性糖和蛋白质的合成和积累。
3.3 变温处理下西红花抗氧化酶活性与花芽分化的关系
植物在正常代谢过程中会产生基态氧和H2O2,而H2O2含量的提高对于植物休眠的解除具有促进作用,SOD、CAT、POD是植物细胞内主要的抗氧化酶,通常认为SOD在植物细胞内主要将超氧化物催化分解为基态氧和H2O2,而CAT、POD又可消除H2O2,使细胞内氧自由基的产生与消除处于动态平衡状态[17]。在西红花花芽分化过程中,球茎内SOD、CAT、POD活性总体呈不断增强状态,表明较高活力的SOD、CAT、POD可更好地维持细胞内氧自由基浓度的平衡,保护花芽顶端分生组织免受活性氧的毒害作用,使花芽分化得以顺利有序进行。同时,SOD与植物抗逆性有密切关系,POD为西红花球茎进入休眠的重要影响因子,而SOD、CAT对球茎休眠解除的调控作用更为明显[18]。在本研究中,西红花球茎内SOD和CAT活性在变温处理期间有较大的增幅,其中T1处理的SOD、CAT活性增幅最大,T3处理的SOD、CAT以及POD活性及增幅较低,表明较低变温处理(T1、T2)可以提高球茎内SOD、CAT及POD活性,从而更好地维持植株体内的超氧自由基浓度的平衡,促进花芽的分化,而高温变温处理(T3)则一定程度上抑制了相关酶活性,不利于花芽分化。
3.4 变温处理下西红花内源激素水平与花芽分化的关系
植物内源激素吲哚-3-乙酸(indole-3-acetic acid,IAA)和赤霉素(GA)在植物开花与结果、成熟与衰老、休眠与萌发及细胞的分裂与茎组织的伸长等方面起着至关重要的调控作用[19]。在球根花卉中,植物激素是球根休眠和花芽分化的关键诱导因子之一,具有调控花芽分化起始的作用。有研究表明,IAA、GA有利于细胞分裂和生长,一定量的IAA、GA的积累有利于打破球茎的休眠状态进入叶原基分化阶段,低浓度的IAA和GA是花芽分化所必须的[20]。在本研究中,通过动态监测西红花不同阶段球茎内IAA含量的变化,发现在花芽分化过程中,IAA含量先有小幅增加再降低,而不同变温处理组间IAA和GA含量存在显著差异。以往的研究表明,低浓度的IAA和GA可促进花芽分化,高浓度则会抑制开花。在本研究中,高温处理(T3)组球茎IAA和GA含量普遍偏高,而低温处理(T1)组IAA和GA含量均低于CK,且结合花芽长度测量及顶芽切片观察可知,T1处理的花芽发育均早于其他个处理组。这表明T1的温度设置更有利于打破西红花球茎休眠,更有利于调节球茎内源激素含量至适宜开花的生理水平,从而推进花芽分化进程,提早花芽分化及开花。
综上所述,适宜的变温处理组合可有效地促进西红花的生长发育,有利于西红花打破休眠,提前进行花芽分化。花芽分化是一个复杂的生理生化和形态变化过程,环境温度的变化会使得球茎内部的营养物质和植物激素变化产生相应的改变。变温处理结果表明,调控环境温度能有效地调控西红花花芽分化的起始与时间长短,外界环境因子的改变也可间接调节球茎内部营养物质、抗氧化酶及植物激素的合成与运输,从而影响植物的休眠和花芽分化,最终调控花芽分化和开花。适宜的变温处理组合(20 ℃-25 ℃-20 ℃)有利于实现西红花提早花芽分化的需求、优化室内培育技术、缩短室内培养时间,为更快更好地培育西红花提供了理论依据。在今后的研究中还需结合分子生物学,进一步从基因水平上解析西红花成花机制的本质。

