冻-放射复合伤中大鼠肺损伤情况及其机制研究
徐 莹, 任 雪, 姜 曈, 吕东阳, 高宽科, 王海旭, 阎 英
北部战区总医院 放疗科,辽宁 沈阳 110016
寒冷是一种复杂、特殊的环境,长期暴露于寒冷环境可致机体多器官功能紊乱。持续暴露于低温环境时,核心体温降低常引起全身冻伤(冻僵),对心脑血管系统、呼吸系统、泌尿系统、免疫系统以及骨关节运动系统等产生严重损害,甚至威胁生命。寒冷环境下遭受辐射可形成“冻-放射复合伤”。目前,国内外尚缺乏“冻-放射复合伤”相关的机制及救治方案研究,亟需建立动物模型进行基础理论探索。本研究通过模拟寒区辐射现场,建立“冻-放射复合伤”动物模型,观察复合伤中肺损伤情况,旨在探讨肺损伤的致伤机制,为制定“冻-放射复合伤”应急预案和救治流程提供理论依据。现报道如下。
1 材料与方法
1.1 实验动物及试剂 40只6~8周龄雄性SD大鼠购自本溪长生生物科技有限公司。所用放射治疗设备为SIEMENS直线加速器。白细胞介素1(interleukin-1,IL-1)、转化生长因子β(transforming growth factor-β,TGF-β)酶联免疫吸附试剂盒购自酶科生物公司,BCA蛋白检测试剂盒购自天根生化科技(北京)有限公司,MDA5、SOD-25).、Cytochrome C、Bax、Bcl-2抗体以及Ahsg/RAGE/NF-κB信号通路相关抗体购自英国Abcam公司。
1.2 研究方法
1.2.1 实验分组及模型建立 将40只雄性大鼠随机分成对照组、寒冷组、放射组和冻-放射组,每组各10只。将大鼠每天置于人工气候箱内6 h,箱内温度调至-10℃,6 h后置于22℃~24℃的室温环境,共持续7 d,第8天接受20 Gy X射线全身单次照射(6 MV-X线,剂量率为220 cGy/min,SSD 100 cm)。
1.2.2 一般症状观察 观察大鼠一般状态、营养、皮毛光泽度、活动能力、饮食、体质量、呼吸、排泄物性状 。
1.2.3 组织学观察 照射后72 h处死所有大鼠进行实验标本采集,收集肺组织标本,置于10%中性甲醛溶液中充分固定,然后取材、包埋、切片、HE染色,最后于光学显微镜下摄片观察肺组织形态学改变。
1.2.4 血液分析检测 于照射后72 h采集血标本,送至本溪长生生物科技有限公司进行血液分析化验,检测白细胞、淋巴细胞、血小板、血红蛋白水平。
1.2.5 血气分析 照射72 h后采集腹主动脉血进行血气分析检测,测量动脉pH值、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)及动脉氧分压(arterial partial pressure of oxygen ,PaO2)。
1.2.6 酶联免疫吸附法 采血3 000 g离心10 min,收集上清并冻存在-80℃冰箱中备用。采用酶联免疫吸附试剂盒检测大鼠血清中IL-1、TGF-β的表达水平。
1.2.7 肺湿重/干重比值 用滤纸干燥右肺上叶,用天平测量肺湿重。右肺上叶随后在60℃的烘箱中干燥72 h,记录干重。计算湿重/干重比值提示水肿形成情况。
1.2.8 蛋白免疫印迹法 采用蛋白提取试剂盒提取大鼠肺标本蛋白,应用BCA蛋白测定试剂盒检测蛋白浓度,检测凋亡相关因子Cytochrome C、Bax 和Bcl-2的表达;检测氧化应激相关蛋白MDA5和SOD-2的表达,同时检测Ahsg/RAGE/NF-κB信号通路蛋白表达。
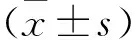
2 结果
2.1 各组大鼠的一般状态观察结果比较 对照组大鼠状态良好,毛发光泽,体质量逐渐增加,呼吸平稳,便质正常。寒冷组、放射组和冻-放射组大鼠一般状态较差,拱背蜷缩,扎堆,呼吸急促,进食差,体质量减轻。放射组和冻-放射组大鼠出现腹泻、脱毛、鼻黏膜出血等症状。与对照组比较,放射组、冻-放射组大鼠体质量明显降低,且冻-放射组低于放射组,差异有统计学意义(P<0.05)。见图1。

图1 各组大鼠体质量变化情况
2.2 各组大鼠血液分析结果比较 与对照组比较,寒冷组、放射组和冻-放射组大鼠白细胞、淋巴细胞均明显降低,差异有统计学意义(P<0.05)。与对照组比较,放射组和冻-放射组大鼠血红蛋白明显升高,差异有统计学意义(P<0.05)。见图2。

图2 大鼠血象变化情况(a.各组大鼠白细胞水平;b.各组大鼠淋巴细胞水平;c.各组大鼠血红蛋白水平;d.各组大鼠血小板水平)
2.3 各组大鼠血气分析结果比较 与对照组比较,放射组、冻-放射组大鼠的pH值明显降低,PaCO2明显升高,差异有统计学意义(P<0.05)。见表1。
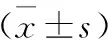
表1 各组大鼠血气分析结果
2.4 各组大鼠炎性因子表达水平比较 寒冷组、放射组和冻-放射组大鼠血清中IL-1、TGF-β表达水平显著高于对照组,且冻-放射组高于寒冷组和放射组,差异有统计学意义(P<0.05)。见图3。

图3 各组大鼠炎性因子表达水平比较(a.各组大鼠IL-1表达水平;b.各组大鼠TGF-β表达水平)
2.5 各组大鼠肺水肿情况比较 与对照组比较,寒冷组、放射组和冻-放射组大鼠肺重量/体质量比值和湿重/干重比值均升高,差异有统计学意义(P<0.05)。见图4。

图4 各组大鼠肺水肿情况比较(a.各组大鼠肺重量/体质量比值;b.各组大鼠湿重/干重比值)
2.6 各组大鼠肺损伤情况比较 组织病理学分析显示,寒冷组、放射组和冻-放射组大鼠均出现了肺损伤改变,其特征是肺体积增大,有明显的出血、水肿、炎性细胞浸润,其中,冻-放射组织肺组织损伤最为明显。见图5。

图5 各组大鼠肺损伤情况比较(a.对照组;b.寒冷组;c.放射组;d.冻-放射组)
2.7 各组大鼠MDA5、SOD-2表达情况比较 与对照组比较,寒冷组、放射组、冻放射组MDA5表达升高,SOD-2的表达降低,差异有统计学意义(P<0.05)。与寒冷组比较,放射组、冻-放射组MDA5表达升高,SOD-2表达降低,差异有统计学意义(P<0.05)。见图6。

图6 各组大鼠MDA5、SOD-2表达情况比较
2.8 各组大鼠肺组织凋亡相关因子水平比较 与对照组比较,寒冷组、放射组和冻-放射组大鼠肺组织Cytochrome C、Bax表达增加,Bcl-2表达降低,差异有统计学意义(P<0.05)。与寒冷组比较,放射组和冻-放射组大鼠肺组织Cytochrome C、Bax表达增加,Bcl-2的表达降低,差异有统计学意义(P<0.05)。见图7。

图7 各组大鼠肺组织凋亡相关因子水平比较
2.9 各组大鼠Ahsg/RAGE/NF-κB信号通路蛋白表达情况比较 与对照组比较,寒冷组、放射组和冻-放射组大鼠肺组织的Ahsg、RAGE、NF-κB蛋白表达显著增加,差异有统计学意义(P<0.05)。与寒冷组和放射组比较,冻-放射组大鼠肺组织的Ahsg/RAGE/NF-κB蛋白表达显著增加,差异有统计学意义(P<0.05)。见图8。

图8 各组大鼠Ahsg、RAGE、NF-κB信号通路蛋白表达情况比较
3 讨论
我国北部地区多地域均处于寒区,在寒冷环境下遭受核辐射可形成“冻-放射复合伤”,研究冻-放射复合伤对特殊条件下卫生保障具有重要的现实意义。本研究发现,经放射的大鼠一般状态较差,出现拱背蜷缩、扎堆、进食差、体质量减轻、腹泻、脱毛、鼻黏膜出血等症状,全血中白细胞、淋巴细胞明显降低,血清中IL-1和TGF-β明显升高。有研究表明,寒冷应激或辐射暴露可导致如IL-1、白细胞介素、肿瘤坏死因子α、TGF-β等炎症介质释放[1-3]。
肺是对寒冷应激反应十分明显的器官,主要表现为不能自主的过渡通气,肺通气量提高8倍,但肺内氧弥散量和氧合效果均明显下降[4]。同时,肺也是对放射线最敏感的器官之一,一旦辐射剂量超过辐射阈值,放射性损伤超出肺组织固有的修复能力时,便发生肺损伤。本研究通过组织病理学检查发现,寒冷组、放射组、冻-放射组大鼠肺部主要病理变化表现为以中性粒细胞聚集的肺部炎性反应,肺泡-毛细血管膜通透性增加导致肺组织水肿,肺泡内透明膜形成,以及由于血管内皮受损导致的血栓形成和出血。本研究中,冻-放射组肺泡间隔水肿明显,可见大量中性粒细胞浸润,部分可见肺泡间隔出血等病理变化。为了解这些病理改变对大鼠肺气血交换功能的影响,本研究在造模后72 h抽取大鼠动脉血进行血气分析,结果发现,寒冷组pH值、PaO2、PaCO2与对照组比较无明显差异,原因可能为本研究大鼠于第1~7天置于寒冷环境,然后在常温环境中继续饲养4 d后处死,可能此时大鼠的呼吸功能有所恢复。与对照组比较,放射组和冻-放射组大鼠的pH值明显降低,PaCO2明显增高,而PaO2有下降趋势,但差异无统计学意义(P>0.05),提示放射组、冻-放射组大鼠肺部损伤较重,最终导致了血氧交换功能受损伤。
目前,尚不清楚冻-放射复合伤的机制。氧化应激被认为是肺损伤发病机制中的关键因素[5-9]。有研究表明,在实验动物模型中,通过清除中性粒细胞、补体或联合超氧化物歧化酶和过氧化氢酶进行全身治疗,可以预防急性肺损伤[10-11]。SOD-2表达对急性肺损伤有保护作用。本研究发现,与对照组、寒冷组相比,辐射暴露显著增加了大鼠肺组织氧化应激因子MDA5的表达增加,表明放射组和冻-放射组大鼠肺组织中存在高水平的氧化应激,而利于清除氧化应激调节的SOD-2的表达降低[12]。有研究发现,上调Sirt3水平可促进SOD-2、Nrf2、GST-Pi和GPX-1蛋白表达,抑制MDA、GSH、iNOS的水平,从而增强抗氧化能力,提示通过调节Sirt3信号可减轻氧化损伤,对抗糖尿病肺纤维化肺损伤[13]。因本研究观察时间较短,肺组织尚未出现纤维化的病理学改变,但SOD表达下降可能会促进后续肺纤维化进程,相关调节通路有待进一步研究。
细胞凋亡是肺损伤的另一重要机制。凋亡主要由两条不同的信号通路启动,一种是外源性(死亡受体依赖)途径,另一种是内源性(线粒体依赖)途径[14]。当细胞表面死亡受体(如Fas)与其配体结合时,外源性途径被触发。Te内在途径是由线粒体外膜的完整性丧失介导的,这导致线粒体蛋白(如细胞色素c)从线粒体释放到细胞质中。线粒体途径由Bcl2蛋白家族控制,其可以促凋亡(如Bid、Bim、Bad、Noxa)或抗凋亡(如Bcl2、Bcl-xL、Mcl1)。本研究发现,与对照组相比,寒冷组、放射组和冻-放射组大鼠肺组织的凋亡相关因子Cytochrome C、Bax的表达增加,Bcl-2的表达下降;与寒冷组相比,放射组和冻-放射组大鼠肺组织的凋亡相关因子Cytochrome C、Bax的表达增加,Bcl-2的表达下降,提示放射组和冻-放射组大鼠肺部组织凋亡明显,损伤更重,其调控可能是通过线粒体途径进行。
进一步研究发现,寒冷组、放射组和冻-放射组大鼠肺组织的Ahsg、RAGE、NF-κB蛋白表达显著增加;与对寒冷组和放射组相比,冻-放射组大鼠肺组织的Ahsg、RAGE、NF-κB蛋白表达显著增加。Ahsg是一种主要由成人肝分泌的糖蛋白,具有促炎和抗炎作用[15]。体外研究表明,AHSG刺激单核细胞迁移和促炎细胞因子的产生。此外,Ahsg作为一种抗炎介质,参与巨噬细胞失活、抗纤维化活性、氧化应激和抑制凋亡[16]。Ahsg还可能是一种内源性配体,在通过TLR4信号调节小鼠胰岛素敏感性方面起着关键作用[17]。此外,高表达RAGE可激活NF-κB,上调多种炎症细胞因子,导致炎症反应和氧化应激反应[18-19]。
综上所述,本研究通过建立冻-放射复合伤模型,观察到大鼠肺部损伤情况,其损伤机制可能通过Ahsg/RAGE/NF-κB信号通路实现。

