疫苗中铝含量紫外分光光度测定法的建立及验证
王平,张学峰,陈美丽,冯帆,邵帅,刘梅影
1.国药中生生物技术研究院有限公司,北京101111;
2.北京生物制品研究所有限责任公司,北京100176
铝佐剂是目前使用最广泛的人用疫苗佐剂,主要包括氢氧化铝佐剂、磷酸铝佐剂和二者混合系统及与其他佐剂成分组成的佐剂系统(如AS04),多数预防性疫苗采用氢氧化铝作为佐剂[1],铝佐剂的含量对预防性疫苗的安全性和免疫原性具有重要影响,存在诱导过敏反应及神经毒性的可能,因此在不影响免疫原性的前提下,应采用能够达到预期人体有效性的最小剂量,尽可能降低疫苗中铝佐剂的含量,从而降低发生临床不良反应的风险[2-4]。
WHO和欧盟规定,铝佐剂的安全性限度标准为不超过1.25 mg/剂[1],《美国药典》为不超过0.85mg/剂[1],最低0.125 mg/剂[4],《中国药典》三部(2020版)各论规定为0.17~0.52 mg/剂[5]。目前,疫苗中铝含量检测方法为《中国药典》三部(2020版)推荐的乙二胺四乙酸钠络合滴定法[5-7]。该方法根据指示剂颜色变化通过目测确定滴定终点,易受人为因素影响,所需样品量大(一般需要合并5~10剂疫苗),无法检测单支疫苗的铝含量。因此,本实验采用高温干烤加酸的方法处理样品,将疫苗中的氢氧化铝胶体颗粒转化为可溶性Al3+,与Tiron试剂在酸性条件下形成有紫外光发色团的衍生物[8-11],用紫外分光光度计检测A310,并对该方法进行验证。
1 材料与方法
1.1 疫苗 吸附百白破联合疫苗、吸附无细胞百白破联合疫苗、实验用流感病毒裂解疫苗(佐剂)及实验用流感病毒裂解疫苗(不含佐剂)由北京生物制品研究所有限责任公司提供;实验用乙型肝炎疫苗由国药中生生物技术研究院有限公司第三研究室提供。
1.2 主要试剂及仪器 硫柳汞由北京生物制品研究所有限责任公司提供;氢氧化铝佐剂由国药中生研究院第三研究室提供;氯化铝溶液标准物质(BW00764-1)及氢氧化铝溶液标准物质(BW21554)购自北京盛世康普化工技术研究院;衍生试剂Tiron(4,5-二羟基-1,3苯二磺酸一水合磷酸氢二钠,172553-100G)及乙酸铵(17836-250G)购自美国Fluka公司;磷酸铝佐剂(Cas7784-30-7)购自德国Brenntag公司;紫外分光光度计(UV-2550)购自日本岛津公司。
1.3 衍生物检测波长的确定 将Tiron溶液(用乙酸铵缓冲液溶解为9.8 mg/L)、氯化铝标准溶液(用乙酸铵缓冲液将氯化铝溶液标准物质稀释至以Al3+计10 μg/mL)、Tiron溶液与氯化铝标准溶液反应后(按1∶1体积比例混合,反应5 min)的衍生物溶液,采用紫外分光光度计分别于波长200~700 nm范围进行测定,以乙酸铵缓冲液作为空白对照,进行拟合,以确定衍生物的最适光谱吸收波长。
1.4 标准曲线的绘制 精确量取氯化铝标准溶液(以Al3+计10 μg/mL)0.1、0.2、0.4、0.6、0.8、1.0 mL,补加乙酸铵缓冲液至1.0 mL,加入乙酸铵缓冲液2 mL及Tiron试剂1 mL,放置5 min,紫外分光光度计检测A310。以A310为纵坐标,氯化铝标准溶液浓度为横坐标绘制标准曲线,进行线性回归,获得回归方程。
1.5 样品前处理方法的确定
1.5.1 干烤温度 精确量取氢氧化铝标准溶液(用乙酸铵缓冲液将氢氧化铝溶液标准物质稀释至以Al3+计70 μg/mL)0.1 mL,加入1.5 mL样品瓶中,分别于120、140、160、180、200、220℃干烤60 min;加入1 mol/L盐酸100 μL,乙酸铵缓冲液补至1.0 mL;后续步骤同1.4项。
1.5.2 盐酸加入量 精确量取氢氧化铝标准溶液(以Al3+计50 μg/mL)0.1 mL,加入1.5 mL样品瓶中,200℃干烤60 min;分别加入10、20、50、100、200、300、400和500 μL 1 mol/L盐酸,补乙酸铵缓冲液至1.0 mL;后续步骤同1.4项。
1.6 方法的验证
1.6.1 准确性 用乙酸铵缓冲液将氯化铝标准物质稀释为2.5 μg/0.5 mL的氯化铝标准溶液后,分别加入80%、100%、120%的氯化铝溶液(分别为2、2.5、3.0 μg/0.5 mL),每个浓度平行制备4份样品。按1.4项方法检测铝含量,并计算回收率。
1.6.2 精密性
1.6.2.1 重复性 将氯化铝标准溶液分别稀释至低(以Al3+计2 μg/mL)、中(以Al计5 μg/mL)、高(以Al3+计8 μg/mL)3个浓度,每个浓度平行制备8份样品,按1.4项方法进行检测,计算SD和CV。
1.6.2.2 中间精密性 将氯化铝标准溶液分别稀释至低(以Al3+计,2 μg/mL)、中(以Al计,5 μg/mL)、高(以Al3+计,8 μg/mL)3个浓度,每个浓度平行制备12份样品,分别由3名实验员(A、B、C)按1.4项方法进行检测,每名实验员检测高、中、低浓度各4份样品,并计算SD和CV。
1.6.3 专属性
1.6.3.1 紫外分光光度法测定 将实验用流感病毒裂解疫苗(佐剂)及实验用流感病毒裂解疫苗(不含佐剂)样品按1.5项确定的样品处理方法进行处理,按1.4项方法检测铝含量。
1.6.3.2 光谱测定 将实验用流感病毒裂解疫苗(佐剂)及实验用流感病毒裂解疫苗(不含佐剂)样品按1.5项确定的样品处理方法处理后,在波长200~700 nm范围内进行光谱测定,同时测定硫柳汞溶液及磷酸缓冲盐溶液,进行拟合,确定以上样品在波长310 nm处的吸收情况。
1.7 方法的应用 取氢氧化铝佐剂、磷酸铝佐剂、吸附百白破联合疫苗、吸附无细胞百白破联合疫苗、实验用重组乙型肝炎疫苗及实验用流感病毒裂解疫苗(佐剂)样品,按1.5项确定的样品处理方法进行处理后,按1.4项方法检测铝含量,并与《中国药典》三部(2020版)[5]通则3106氢氧化铝(或磷酸铝)测定法检测结果或商品化产品说明书标示值进行比较,其中实验用流感病毒裂解疫苗(佐剂)重复检测9支。
2 结果
2.1 最适衍生物检测波长 氯化铝标准溶液在光度测定范围内无明显吸收,Tiron溶液和Tiron溶液与氯化铝标准溶液反应后的衍生物溶液在波长310 nm处吸收峰有明显吸收差异,且Tiron溶液吸收光值较小。见图1。因此确定最适衍生物检测波长为310 nm。
2.2 标准曲线 铝含量标准曲线见图2。氯化铝标准溶液铝含量在1~10 μg/mL范围内,与A310值呈良好的线性关系,回归方程为:Y=0.009 41X+0.009 97,R=0.998 29。
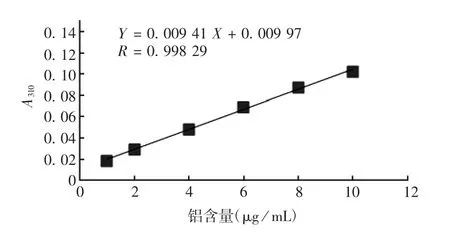
图2 铝含量标准曲线Fig.2 Standard curve for determination of aluminium content
2.3 最适样品处理方法
2.3.1 干烤温度 干烤温度为120、140、160、180、200、220℃时,氯含量分别为6.17、5.92、6.11、6.16、6.34、6.35 μg/mL。干烤温度在120~220℃之间,铝含量的检测值差异较小,且200℃时信号最强,反应最完全。因此确定最适干烤温度为200℃。
2.3.2 盐酸加入量 加入10、20、50、100、200、300、400和500 μL 1 mol/L盐酸时,铝含量分别为4.76、5.12、5.07、4.86、4.33、2.61、3.65、2.77 μg/mL。加入量在20~100 μL范围内,铝含量的检测值差异较小;高于200 μL时改变了溶液pH,使检测结果降低。在确保样中氢氧化铝充分反应的前提下,为尽量不改变溶液pH,盐酸加入量应尽量少,因此确定1 mol/L盐酸最适加入量为50 μl。

图1 最适衍生物检测波长的确定Fig.1 Optimization of detection wavelength of derivatives
2.4 方法的验证
2.4.1 准确性 加入80%、100%、120%的氯化铝溶液样品的回收率为100.36%~108.40%,均在80%~115%之间,见表1。表明该方法具有良好的准确性。
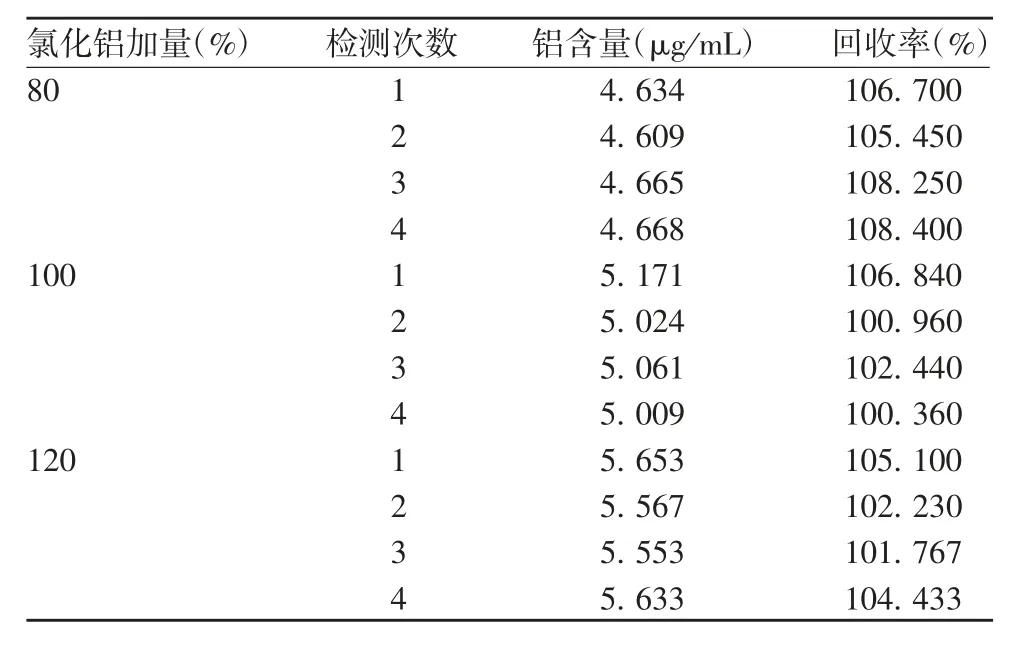
表1 准确性的验证结果(n=12)Tab.1 Verification for accuracy(n=12)
2.4.2 精密性
2.4.2.1 重复性 低、中、高浓度的氯化铝标准溶液8份样品重复测定结果的CV分别为2.10%、3.08%和1.12%,均<6%,见表2。表明该方法具有良好的重复性。
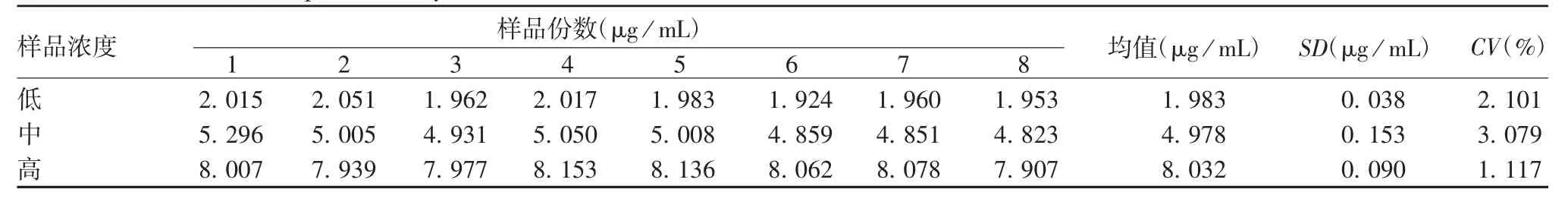
表2 重复性试验结果Tab.2 Verification for reproducibility
2.4.4.2 中间精密性3名实验人员A、B、C检测低、中、高浓度氯化铝标准溶液结果的CV分别为3.46%、2.28%和1.55%,均<6%,见表3。表明该方法具有良好的中间精密性。

表3 中间精密性验证结果Tab.3 Verification for intermediate precision
2.4.3 专属性
2.4.3.1 紫外分光光度法测定 实验用流感病毒裂解疫苗(不含佐剂)及实验用流感病毒裂解疫苗(佐剂)铝含量分别为2.30和111.18 μg/mL,差异较大,表明该方法具有良好的专属性。
2.4.3.2 光谱测定 实验用流感病毒裂解疫苗(不含佐剂)样品、硫柳汞溶液和磷酸缓冲盐溶液于310 nm波长处无明显吸收峰,实验用流感病毒裂解疫苗(佐剂)样品有明显吸收峰,见图3。表明该方法专属性良好。
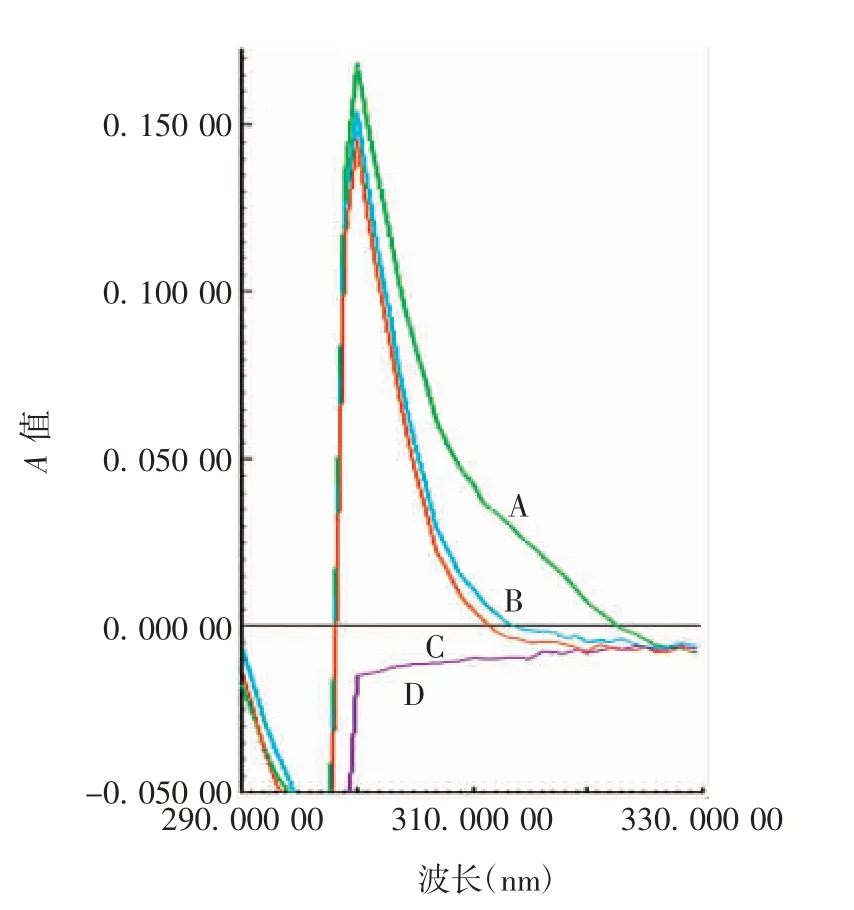
图3 专属性的光谱测定Fig.3 Spectrometric determination in specificity test
2.5 方法的应用 用紫外分光光度法测定氢氧化铝佐剂、吸附百白破联合疫苗、吸附无细胞百白破联合疫苗、实验用乙型肝炎疫苗中铝含量结果分别为1.01、1.34、1.28、1.00 mg/mL,药典测定方法结果分别为1.08、1.40、1.30、1.06 mg/mL,两者差异较小;磷酸铝佐剂铝含量用紫外分光光度法测定结果为4.92 mg/mL,符合商品化的磷酸铝佐剂铝含量说明书标示值(4.5~5.5 mg/mL)。9支实验用流感病毒裂解疫苗(佐剂)测定结果分别为0.11、0.11、0.11、0.09、0.10、0.09、0.09、0.10、0.09 mg/mL,均值为0.10 mg/mL,与药典测定方法结果一致。
3 讨论
铝佐剂在增强抗原递呈、提高机体固有免疫应答和激活B细胞诱导抗体产生等方面发挥重要作用,国家药品监督管理局(National Medical Products Administration,NMPA)发布的《预防用含铝佐剂疫苗技术指导原则》中明确指出,必须对疫苗添加佐剂的必要性进行严格论证,并应保证添加的佐剂不会引起不可接受的毒性,且使用佐剂所带来的增强免疫应答的潜在利益必须超过其所带来的风险[1]。目前,中国已上市含铝佐剂疫苗共有17种,包括百白破系列疫苗、甲/乙/戊肝疫苗、大流行流感疫苗及森林脑炎灭活疫苗、肾综合征出血热灭活疫苗及肠道病毒疫苗[12-13],涉及灭活疫苗、亚单位疫苗和基因工程重组蛋白疫苗和联合疫苗等多种类型疫苗,其中铝含量检测是重要的质控指标。
《预防用含铝佐剂疫苗技术指导原则》[1]及《中国药典》三部(2020版)[5]将铝佐剂和含铝疫苗粒径大小及分布纳入质量特性研究和日常控制的要求,因此,铝佐剂制备工艺和抗原吸附工艺需不断优化和改进,以提高抗原吸附效果和吸附后的粒径均一性,从而进一步降低疫苗中铝佐剂使用量。环境和食品行业多采用分光光度法、原子吸收光谱法和色谱技术进行微量铝的检测,其中国内食品行业采用的铬天青S分光光度法需浓硝酸、高氯酸等强氧化性酸微波消解供试品,加入铬天青S、十六烷基三甲基溴化铵(cetyltrimethyl ammonium bromide,CTMAB)、抗坏血酸、聚乙二醇辛基苯基醚等试剂反应,再进行比色测定,这种方法结果准确、成本较低,缺点是检测过程步骤繁琐,易受多种因素影响,且使用大量有毒有害试剂,造成环境污染。原子吸收光谱法(atomic ab-sorption spectrometry,AAS)尚未大量应用于检测领域,主要是由于安全性不达标,且许多关键部件消耗较大,处于研发阶段[14-15]。国际上采用的高效液相色谱-紫外检测法[16]、LC-MS法[17]、离子色谱-紫外检测[18]等,可大幅提高铝检测的灵敏度和精确度,此类技术相较于滴定法,显著减少了人为操作误差,且可实现样本的高通量检测,具有审计追踪功能,有利于质量控制。但该方法尚未见应用于生物制品领域,可能是由于疫苗的成分复杂,对样品进行预浓缩和/或净化等前处理成为该方法用于疫苗中铝含量检测的关键。
本实验用高温干烤加酸的方法处理样品,结果表明,最适干烤温度为200℃,1 mol/L盐酸最适加入量为50 μL。该步骤可将疫苗中不溶性的氢氧化铝胶体颗粒转化成可溶性的Al3+,排除了疫苗其他成分对检测的干扰。Al3+与Tiron试剂在酸性条件下在波长310 nm处形成特异吸收峰的衍生物,实现了对铝离子的定量检测。本实验方法验证结果显示,氯化铝的加样回收率在100.36%~108.40%之间;重复性及中间精密性RSD均<6%,符合规定。采用建立的方法检测氢氧化铝佐剂、百白破疫苗、实验性乙型肝炎疫苗和实验用流感病毒裂解疫苗(佐剂)的铝含量,结果表明,紫外分光光度法与传统滴定法测定结果差异较小,且操作简便,方法可靠,减少了人为判断误差。本方法实现了单支疫苗中铝含量的检测,为研发过程中铝佐剂制备工艺、抗原吸附工艺和分装工艺优化提供了有效的监测手段。另外,针对不同佐剂疫苗中所含抗原成分的不同,可在本研究基础上,考虑采用柱后反应的高效螯合离子色谱技术进行分离和测定复杂样品中铝含量[19]。

