热休克70-kDa蛋白A6(HSPA6)的研究进展
沈诗怡,宋炳辉,傅俊江
西南医科大学基础研究中心 表观遗传与肿瘤四川省高校重点实验室(泸州 646000)
热休克70-kDa蛋白A6(heat shock 70-kDa protein 6,HSPA6)(OMIM:140555)是HSP70 家族中的一员,最早由Leung 等[1]于1990 年首次鉴定。HSP70家族包括:HSPA1A、HSPA1B、HSPA1L、HSPA2、HSPA5、HSPA6、HSPA7、HSPA8、HSPA9、HSPA12、HSPA13、HSPA14[2-7]。HSPA6基因位于人类染色体1q23.3上,全长1 929个核苷酸,编码643个氨基酸。HSPA6 蛋白的分子量为70 kDa,其表达分布主要定位于细胞质、细胞外外泌体[8]。HSPA6 在绒顶柽柳猴、猪、牛和人中发现了同源基因,而在啮齿动物中则无。
目前研究发现HSPA6对肿瘤的发生、发展既有直接或间接的抑制作用,也有促进作用,在非肿瘤疾病的罹患中也扮演着多种重要角色。总的来说,现阶段HSPA6已日渐成为研究的热点,但其作用机制仍未明确。本文对HSPA6 蛋白的结构、功能、研究现状、可能的作用机制及未来展望作一概述。
1 HSPA6蛋白结构、生理功能及其表达
1.1 HSPA6蛋白质的结构
HSPA6 蛋白质含2 个重要结构域,即结合和水解ATP 的44 kDa 的N 端核苷酸结合域(nucleotide binding domain,NBD)(也称为ATP 酶结构域)、具有蛋白酶敏感位点的中间域和结合延伸多肽的28 kDa的C 端底物结合域(substrate-binding domain,SBD)(也称为肽结合域)(图1)。除HSPA12 含有不同的NBD外,其他HSP70家族成员中的NBD都是高度保守的,它由围绕ATP结合袋的四个子域(IA、IB、IIA、IIB)组成[9]。SBD 又可细分为N 端的β-折叠(SBDβ)和C端的辅助底物结合的盖子结构α-螺旋亚结构域(SBDα)[10]。NBD 和SBD 这两个结构域是变构耦合的,因此当ATP与NBD 结合时,SBD 与其伴侣蛋白的结合相对较弱;而当ADP 与NBD 结合时,构象变化增强了SBD对伴侣蛋白的亲和力[8]。

图1 HSPA6的结构
1.2 HSPA6的生理功能
通过ATP 结合、ATP 水解和ADP 释放,HSPA6经历了三磷酸腺苷水解和核苷酸交换,完成底物结合和释放的循环,进而使HSPA6实现一系列生理功能:保护蛋白质组免受压力、折叠和运输新合成的多肽、激活错误折叠蛋白质的蛋白质分解,以及形成和解离蛋白质复合物等。HSPA6 在蛋白质质量控制系统中起着关键作用,可确保蛋白质的正确折叠、将错误折叠的蛋白质重新折叠,同时还控制蛋白质随后的降解[8]。
1.3 HSPA6蛋白的甲基化修饰
HSPA6 存在翻译后甲基化修饰,其第563 位点的赖氨酸(K)残基,在体内、体外都能被重组人甲基转移酶样蛋白21A(METTL21A)催化形成三甲基化修饰。这种催化反应是受到ATP 的刺激来完成的。Magnus等[11]发现热休克蛋白的三甲基化修饰具有功能性的结果,它可以改变分子伴侣与某些疾病相关蛋白的亲和力。例如,HSPA8的三甲基化修饰就改变了分子伴侣对帕金森病相关蛋白-突触核蛋白的单体和纤维形式的亲和力[11]。当HSPA6 第563 位点发生K→R(精氨酸)突变时,会导致其完全丧失在体外被METTL21A 催化形成甲基化修饰的能力,但其可能产生的病理变化尚不清楚。
1.4 HSPA6的基因表达
HSPA6 属于严格诱导型HSP70 家族成员中的一种,与HSP70-1高度同源,且在大多数细胞中具有低或不可检测的表达水平[1]。综合Human Protein Atlas(HPA)数 据 库、Genotype-Tissue Expression(GTEx)数据库和Function Annotation Of The Mammalian Genome(FANTOM5)数据库数据的合集,我们发现HSPA6的mRNA 表达水平在不同人类正常组织、细胞中高低不同。在阴道组织中表达最高,然后依次为粒细胞、乳腺、胚胎等(图2)。由图2可见,HSPA6 在女性部分器官组织中表达均较高,这一表达特点可能具有特殊意义,例如HSPA6是否与女性体内激素作用相关,这一猜测有待进一步研究证实。
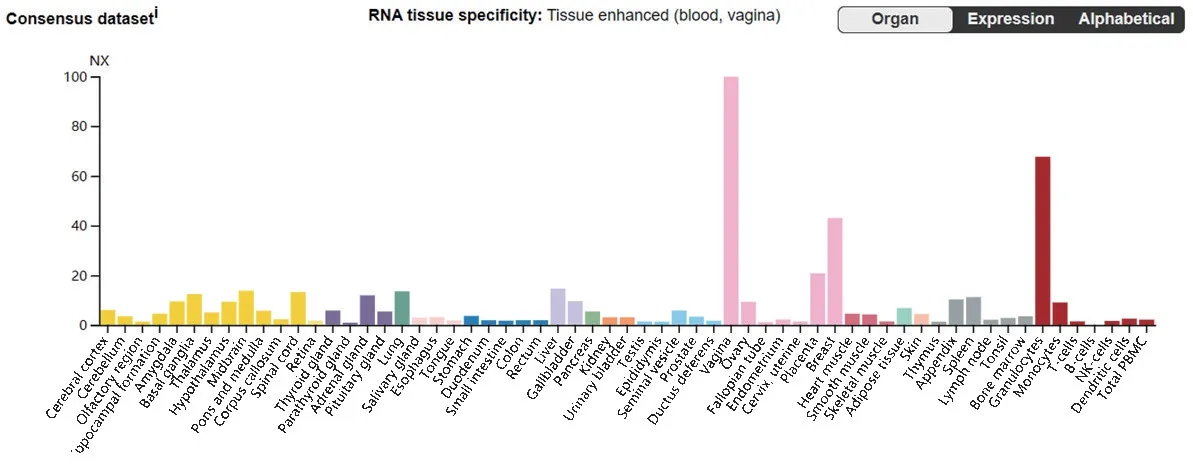
图2 HSPA6在人体各组织中mRNA表达情况
进一步通过GEPIA2 数据库(http://gepia2.cancer-pku.cn/#analysis)分析31 个不同类型肿瘤及其癌旁组织,发现在6种不同类型癌组织中,HSPA6的表达比其相应的癌旁组织显著降低(P<0.01)(图3A),而在另外4 种不同类型癌组织中HSPA6 的表达比其相应癌旁组织显著增高(P<0.01)(图3B),提示HSPA6可能具有双重作用,即抗肿瘤作用和促癌作用(原癌作用)[12]。

图3 HSPA6在不同类型的癌组织及相应的癌旁组织的表达情况
2 HSPA6的抗肿瘤作用
肿瘤患者的治疗是一个艰难而漫长的过程,尤其是化学治疗方案,治疗周期长,患者耐受度差,单一用药效果普遍比联合用药效果差,且容易出现耐药现象。如果在原有化疗药物的基础上联合用药,产生协同效应,缩短治疗周期,患者将会有很大的受益。近期关于HSPA6 的研究表明,药物处理肿瘤细胞后HSPA6表达升高,并验证了其抗肿瘤作用[13-14]。
大蒜提取物(garlic extract,GE)具有抗肿瘤作用,GE处理通过G2/M期细胞周期阻滞显著抑制人膀胱癌EJ细胞的增殖,并通过抑制基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)表达进而降低AP-1、Sp-1 和NF-κB 基序的结合活性来阻碍EJ 细胞的迁移和侵袭[13,15-16]。Seung 等[13]基于微阵列数据集,发现HSPA6是GE 发挥抑制作用时最明显上调的基因。过表达HSPA6使GE对EJ细胞增殖、迁移和侵袭的抑制作用明显增强。在EJ 细胞中,通过增强诱导G2/M期介导的ATM-CHK2-Cdc25C-p21WAF1-Cdc2级联反应,磷酸化MAPK和AKT信号,以及抑制转录因子相关的MMP-9 调节进一步验证了HSPA6的增强作用。该研究表明HSPA6增强了GE介导的对EJ 细胞增殖、迁移和侵袭的抑制作用,为恶性肿瘤的治疗提供了新的途径[13]。
组蛋白去乙酰化酶抑制剂(HDACi)在实体瘤的治疗中基本无效,而Duncan等[14]研究发现一类新的蛋白质二硫键异构酶(PDI)抑制剂,可显著协同增强HDACi在胶质母细胞瘤和胰腺癌临床前模型中的抗肿瘤活性。RNA-seq筛选与基因沉默研究相结合,确定转录激活因子3(activating transcription factor 3,ATF3)是这种抗肿瘤协同作用的驱动因素。由于ATF3 启动子区域侧翼的关键组蛋白赖氨酸残基(H3K27-ac、H3K18-ac)乙酰化增加,ATF3被PDI和HDACi 联合处理高度诱导。而HSP40/HSP70 家族基因DNAJB1和HSPA6被发现是关键的ATF3 依赖性基因,ATF3诱导热休克蛋白家族成员的转录,在PDI和HDACi抑制后引发抗肿瘤反应。这表明HSPA6有介导抗肿瘤的作用。
Yang等[17]通过比较依维莫司单药治疗或联合一种血管破坏剂BNC105P 治疗转移性肾细胞癌(mRCC),发现HSPA6 与临床效益(clinical benefit,CB)密切相关,其基因表达可能为患者选择合适的治疗方法提供理论依据。
最新研究发现,在宫颈癌细胞HeLa 中过表达HSPA6能抑制其生长、迁移及侵袭的作用;在三阴性乳腺癌BT549 细胞中,敲减HSPA6 则促进了肿瘤的生长、迁移及侵袭[18]。有趣的是,天然小分子化合物百里醌能够诱导HSPA6的表达,从而达到其抑制肿瘤的作用[18]。而百里醌作为黑种草籽中的有效成分,已有大量研究证明其具有抗肿瘤作用[18-25]。
3 HSPA6 的表达上调促进肿瘤发生、发展
上述多个实验研究结果显示,HSPA6就是一个潜在的抑制肿瘤的靶基因。但也有研究表明,HSPA6对肿瘤有促进作用,它在肿瘤发生、发展、预后等方面也扮演重要角色,即原癌作用。
与肿瘤周围组织相比,胃癌组织中Rho 鸟嘌呤核苷酸交换因子10 样蛋白(ARHGEF10L)的表达增加。具有ARHGEF10L 过表达的人胃癌细胞SGC7901 细胞显示出细胞增殖、迁移和管状结构形成能力增加;同时GTP-RhoA(GTP-Ras homolog gene family member A,GTP-Ras 同源基因家族成员A),ROCK1(Rho-associated coiled-coil kinase-1,Rho 相关卷曲螺旋激酶-1)和磷酸化Ezrin/Radixin/ Moesin 的表达增加[26-28]。ARHGEF10L 过表达下调E-钙粘蛋白的表达,上调N-钙粘蛋白和Slug 的表达,表明转染细胞中发生上皮-间充质细胞转化(EMT)的激活。RNA-seq 分析检测到过表达ARHGEF10L 的SGC7901 细胞中HSPA6 的表达增加。即ARHGEF10L 的表达可通过促进RhoA-ROCK1-磷酸化-ERM 信号传导,诱导EMT 并增加HSPA6 表达来刺激胃癌发生[29]。
从对猕猴桃根提取物(actinidia chinensis planch root extract,acRoots)敏感和不太敏感的肺癌细胞株的转录谱中筛选acRoots相关的炎症靶基因,再进一步筛选、鉴定和验证,并选择热休克蛋白HSPA6 作为炎症靶点,结果发现HSPA6在对acRoots治疗敏感的肺癌细胞中明显高表达。为了进一步评估HSPA6在细胞对acRoots 反应中的决定性作用,该研究在acRoots 治疗72 h 后动态测量了敲减HSPA6基因后对肺癌细胞的增殖影响。敲除HSPA6基因后,敏感细胞和较不敏感细胞对acRoots 的细胞敏感性和增殖能力都增加。其主要机制是HSPA6和以HSPA6为主的分子网络相互作用,可以改变肺癌细胞对药物的敏感性。HSPA6 被定义为调节细胞敏感性的关键因素,可能是通过与HSPA家族成员,HSP家族成员和其他家族之间的相互作用来实现的。同时,由于ac-Roots 对p53-细胞系敏感,acRoots 处理的HSPA6 上调可能与p53 或其相关途径有相互作用。因此,HSPA6基因有可能成为肺癌的联合药物治疗靶点[30]。
细胞内热休克蛋白(HSP)浓度的增加与人肝细胞癌(hepatocellular carcinoma,HCC)的发生和发展密切相关,是HCC 进展和恶化的有用标志[31-34]。HSPA6表达上调也与乙型肝炎病毒(HBV)相关的早期肝细胞癌预后不良有关[35]。Yang 等[35]用来自Gene Expression Omnibus 的GSE14520 微阵列表达谱比较了肿瘤和非肿瘤组织之间的各HSP 基因表达情况,并将其与HCC患者的预后结果相关联。他们通过分析220 名HBV 相关的HCC 患者的样本和25 个HSP基因,发现大多数HSPs在肿瘤组织中的表达高于非肿瘤组织,而HSPA6 在非肿瘤组织中上调。以患者任何原因的死亡和肝癌复发为终点,收集处理数据、进行统计学分析,发现肝癌巴塞罗那分期(barcelona clinic liver cancer,BCLC)高评分、晚期肝硬化以及HSPA12A 和HSP90B1 的过表达可能与HCC 的存活率差有关;而HSPA4、HSPA5 和HSPA6 的高水平可能与HCC的早期复发有关。
HSP90 在多种肿瘤组织中过表达[36],格尔德霉素(geldanamycin)是一种小分子,可抑制HSP90家族蛋白的功能[37],格尔德霉素衍生物17-AAG 作为HSP90 抑制剂是潜在的抗肿瘤药物[38]。然而肿瘤细胞似乎可以通过上调其他热休克蛋白的表达来逃避HSP90 抑制剂的细胞毒性,尤其是HSP70 家族[39-40]。实验表明17-AGG 可以在多种肿瘤细胞系中诱导HSPA6 的表达,甚至在部分细胞中呈现对17-AGG作用时间和计量的依赖性。然而,也有一些细胞系不引起“HSPA6 反应”,这表明细胞系依赖性因子可能参与HSP90 下游HSPA6 的转录调控。研究还发现,在HSPA6启动子中存在正调控元件和负调控元件,HSPA6 的热休克诱导是由热休克元件(HSE)介导的[41]。HSP90抑制、蛋白酶体抑制和热休克可能通过不同的机制介导HSPA6的诱导,其中只有HSP90下游的信号具有高度的细胞类型特异性。可能通过启动子元件C/EBP 或ZFX 参与HSP90 下游的HSPA6诱导[42]。由此,HSPA6有望作为HSP90抑制的敏感标记物。
食管癌(esophageal carcinoma,EC)是一种严重的恶性肿瘤,无论是在死亡率还是预后方面,免疫相关基因(IRGs)都是其发展的关键因素。Guo等[43]分析了TCGA 数据库中的182 个EC 样本,通过多变量Cox 回归分析,发现了HSPA6、CACYBP、DKK1、EGF、FGF19、GAST、OSM、ANGPTL3和NR2F2共9个最佳免疫相关的预后基因,且均为高危基因。并构建了一个基于IRGs 的EC 预后模型,可以准确预测EC 患者的预后。在TCGA 数据库的182 个肿瘤样本和GETx 数据库中匹配的286 个正常样本之间验证了这些预后基因,发现HSPA6、CACYBP、DKK1、GAST、OSM在EC 组织中上调。同样,Wang 等[44]也构建了一个由六个免疫基因HSPA6、S100A12、FABP3、DKK1、OSM和NR2F2组成的模型,Chen等[45]构建了一个由HSPA6、S100A12、NOS2、DKK1、OSM、AR和OXTR组成的7 个基因模型,均可作为预测EC患者预后的新生物标志物。以上研究一致得出:HSPA6 在EC 组织中表达升高,可为EC 提供新的免疫治疗靶点。
手霉素A(manumycin A,MA)是一种耐受性良好的天然抗生素,在各种临床的体外和体内模型中显示出多效抗癌作用。抗癌药物本身可能作为应激源来诱导细胞适应机制,从而使其细胞毒性最小化。热休克蛋白作为细胞保护因子可以抵消各种应激刺激的有害作用。Sojka 等[46]研究了MA 的抗癌作用是否可以被属于HSP70家族的热休克蛋白相关机制所抵消,结果发现MA 引起了细胞类型特异性的HSPAs水平的改变,变化包括应激诱导的HSPA6 上调。
同时,HSPA6也可通过细胞凋亡抑制、靶向肿瘤微环境等机制,与磁流体热疗(magnetic fluid hyperthermia,MFH)组合产生协同作用,并且可能成为增强MFH在卵巢癌治疗结果中的靶标,被鉴定为卵巢癌的潜在治疗靶点[47]。
新型蛋白酶体抑制剂伊沙佐米(ixazomib)抑制人结直肠癌SW620 细胞的增殖。它通过靶向HSPA6、APCDD1、TP53和JUN等差异基因的表达,并影响细胞凋亡和细胞周期通路等信号通路发挥抗癌作用[48]。
4 HSPA6 在肿瘤以外的其它疾病中的作用
HSPA6 在除肿瘤以外的临床多学科研究中,也逐渐被探索出其新的作用。HSPA6 是肠道病毒A71(EV-A71)生命周期的正调节剂。HSPA6 仅在内部核糖体进入位点(IRES)介导的翻译中必需,它通过细胞蛋白而不是病毒蛋白促进EV-A71 的IRES 活性。HSPA6的敲低还导致由柯萨奇病毒A16、埃可病毒9、脑心肌炎病毒或丙型肝炎病毒的IRES 驱动的荧光素酶活性降低,该研究结果显示,HSPA6 可能有助于病毒IRES活动通常所需的细胞蛋白的功能[49]。
心血管疾病常与血管壁内皮细胞损伤有关。内皮损伤的结果是平滑肌细胞(SMC)从中层迁移到动脉壁内膜层,并在此开始增殖。这刺激了平滑肌细胞的生长,导致血管腔的不利狭窄,纤维化,最终导致再狭窄。一氧化氮(NO)对抑制SMC的迁移和增殖至关重要,而NO 主要来源于血管内皮细胞[50-51]。在内皮细胞中,内皮型一氧化氮合酶(eNOS)又是产生NO 最活跃的酶,其缺乏与某些血管疾病有关。它可通过上调细胞周期调节因子p27、p21[52-53]和肿瘤抑制基因p53[54]来诱导细胞周期停滞。通过微阵列分析检测eNOS 腺病毒(Ad-eNOS)转导的人冠状动脉平滑肌细胞(HCASMC)的基因表达谱,与空腺病毒组相比,发现HSPA1A、HSPA1B和HSPA6的转录分别增加了2、1.7 和14 倍。进一步蛋白质免疫印迹实验显示Ad-eNOS 诱导HSPA6 蛋白表达。构建携带HS-PA6基因的腺病毒(Ad-HSPA6),转染至HCASMCs中,在血清刺激后3 d 和6 d 抑制SMC 增殖,且与Ad-eNOS 对SMC 生长的抑制作用平行。从而证实HSPA6 过表达可抑制SMC 增殖,推动了靶向HSPs用于血管修复领域的研究进展。结合放射学和病理学特征,HSPA6 可用于鉴别诊断回肠结肠的克罗恩病与小肠白塞氏病[55]。HSPA6 也是在中枢神经系统的动静脉畸形(AVM)疾病中检测到的表达水平显著改变的基因,其表达增加提示与神经元、浸润细胞和血管细胞的死亡,该病的严重程度密切相关[56]。
Liu 等[57]收集了20 名活动性免疫性血小板减少症(ITP)患者和20 名健康对照者的骨髓样本,发现了两组之间的差异表达蛋白。平行反应监测(parallel reaction monitoring,PRM)分析证实与正常对照组相比,凋亡相关蛋白显著减少,其中HSPA8、HSPA6、ITGB3、YWHAH 和PRDX6 不同程度地下调。KEGG富集分析表明凋亡相关蛋白与PI3K-Akt 信号通路密切相关。综上所述,HSPA6 的显著减少可以通过PI3K-Akt信号通路调节ITP中的细胞凋亡。
HSPA6可由香烟烟雾强烈、短暂诱导,它是溃疡性结肠炎易感因子。香烟烟雾诱导的HSPA6可与稳定的抗凋亡蛋白Bcl-XL相互作用,从而提供上皮保护,防止结肠炎引起的肠道损伤(过度凋亡)[58]。
当神经退行性疾病中的某些蛋白质发生错误折叠和聚集时,热休克蛋白参与了由此引发细胞损害的修复和保护。其中HSPA6 和HSPA1A 有助于保护分化的人类神经元细胞免受细胞应激的损害[59]。
多发性硬化(MS)是一种慢性自身免疫性中枢神经系统脱髓鞘疾病,其病因尚不完全清楚。Chiricosta 等[60]通过计算机研究评估健康受试者和MS 患者之间六个大脑区域(胼胝体、海马、内囊、视交叉、额叶和顶叶皮层)的转录修饰,以识别代表疾病的基因。结果发现编码HSP70s 的HSPA1A、HSPA1B、HSPA7、HSPA6、HSPH1和HSPA4L基因在健康个体和MS患者之间的胼胝体、海马、内囊、视交叉和额叶或顶叶皮质中显著上调。因此,在自身免疫性疾病中,包括MS、HSP70s可能具有有害作用,导致针对髓鞘自身抗原的免疫系统反应的恶化和促进。
滋养层细胞在人胎盘低氧环境中的存活需要MMP 介导的重组人肝素结合性表皮生长因子(recombinant human proheparin-binding EGF-like growth factor,HBEGF)脱落和下游信号传导。而HSPA6具有调节MMP2 生物合成的作用,是HBEGF 在低氧下脱落所必需的,有助于滋养细胞在怀孕前三个月在低氧浓度下存活,并且对于成功的妊娠结局至关重要[61]。
与健康牙周膜组织相比,肉芽肿中HSP 基因的表达显著增加(P<0.001)。HSPA6 在肉芽肿和LPS处理的巨噬细胞中的表达水平明显升高,且在活动病灶中更高表达。因此,HSPA6参与根尖周病变的发展,并可能解释了不同的临床结果[62]。
健康个体和心肌梗死(MI)患者的血液中发现了几个差异表达的miRNA和基因,其中HSPA6在MI患者血液中表达水平升高,其表达水平对MI有很大的诊断价值。因此,HSPA6可作为MI 早期诊断的生物标志物,以及监测MI早期恢复的生物标志物[63]。
此外,HSPA6 可作为类风湿关节炎潜在的诊断生物标志物,可以帮助预测甲氨蝶呤的治疗功效[64]。HSPA6也是人脑胶质瘤的预后标志物[65-66]。
HSPA6在肿瘤及其他疾病的作用及病理生理机制总结,见表1。
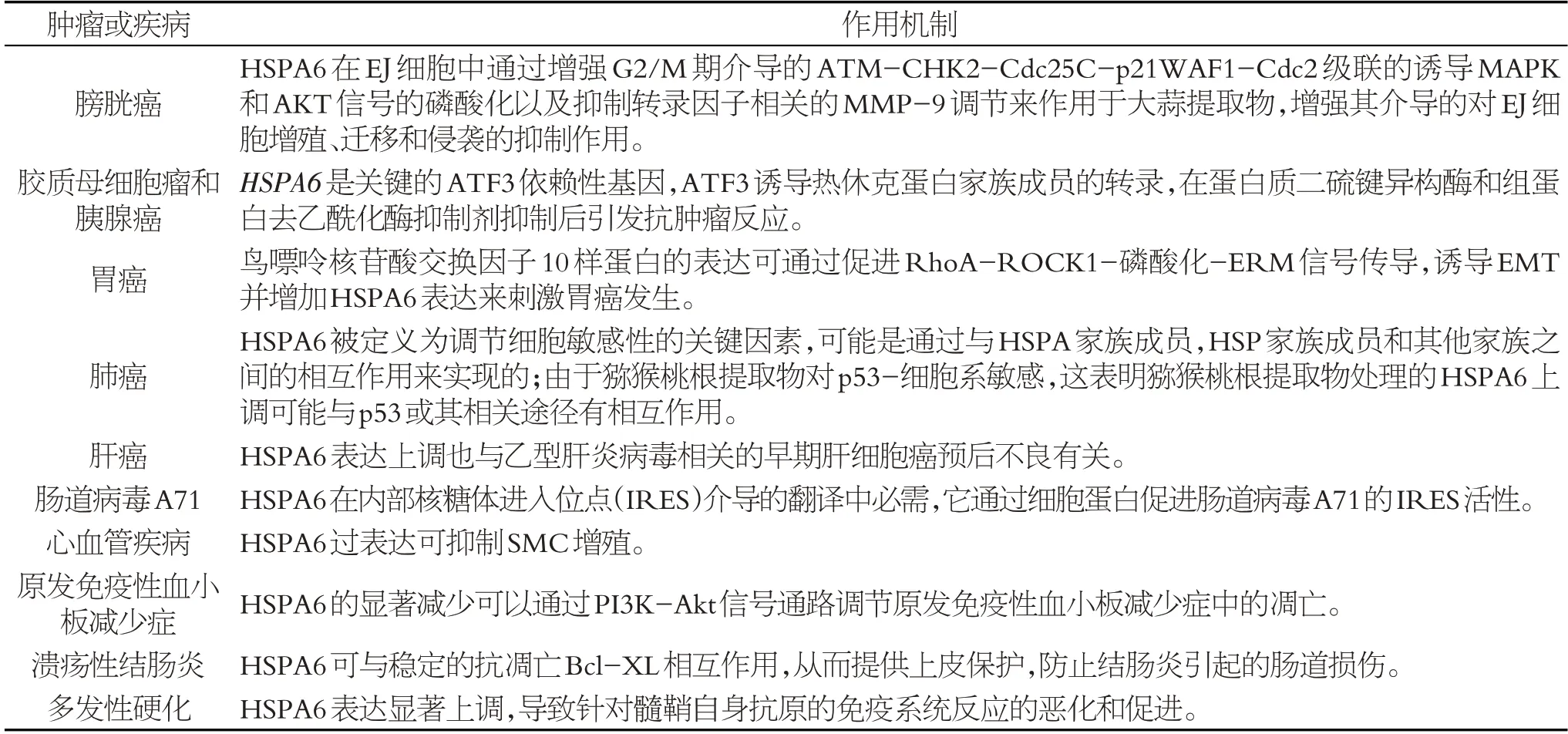
表1 HSPA6在肿瘤或其他疾病的作用及病理生理机制
5 展望
近年来热休克蛋白在各种疾病中的研究日渐增多,HSPA6 作为HSP70 中的一个家族成员,正备受关注。在肿瘤领域中,目前对HSPA6的研究较少,实验数据不足,且实验结果并不全表现为HSPA6对肿瘤的抑制作用。它具有双向性,既存在直接或间接抑制肿瘤的作用,某些条件下又是肿瘤发生、发展的一个危险因素。什么情况下可以发挥其抑癌作用,哪种条件下又会导致其对肿瘤生长的刺激作用,目前还不得而知。而且,HSPA6 的信号通路、作用机制尚不明确。面对这种情况,还需要更多的探索来充分认识和了解HSPA6,明确其分子靶向作用,为未来肿瘤及其他疾病的临床诊治、预后提供指导。

