藤黄酸通过增加lncRNA GAS5水平抑制卵巢癌细胞的增殖、炎症反应和转移标志物表达
许娟秀, 吴海根
(江西省妇幼保健院肿瘤科,江西 南昌 330006)
卵巢癌是女性生殖系统中最严重的恶性肿瘤之一。全球每年超过125 000例死于卵巢癌[1],而在中国,近年来卵巢癌的发病率持续上升[2]。目前的首要临床问题是提高患者的早期诊断和疗效。近年来,手术联合药物治疗可改善患者的预后,但晚期卵巢癌的5年生存率仍小于30%[3]。因此,迫切需要更好地理解发病机理和鉴定分子改变,以开发有助于卵巢癌诊治的有效策略。
藤黄酸(Gambogic acid,GA)已被多次报道可在卵巢癌中扮演抗癌作用[4-5]。但是其抗癌的内在分子机制并不清楚。研究发现在膀胱癌细胞中藤黄酸可以促进抗癌长链非编码RNA(lncRNA)GAS5水平的表达[6]。而GAS5又可以通过调节miRNA和靶基因参与介导膀胱癌和卵巢癌中的抗癌机制[6-7]。GAS5和藤黄酸都具有较明显的抗炎、抗增殖、抗侵袭和迁移的能力[8-9]。因此藤黄酸很可能在卵巢癌中同样调节GAS5的表达,但在藤黄酸是否通过调节GAS5介导卵巢癌进展方面缺乏报道。
本研究使用藤黄酸处理卵巢癌细胞,观察NF-κB的激活状态、细胞炎症状态、以及增殖和转移标记物的变化,并基于lncRNAGAS5研究藤黄酸介导的卵巢癌细胞功能的分子机制。
1 材料和方法
1.1 组织 2016年7月至2018年12月,从江西省妇幼保健院医院接受手术的患者中获得12例卵巢癌组织和相邻正常组织。根据组织病理学诊断为卵巢癌(Ⅱ,Ⅲ和Ⅳ期)根据国际妇产科联合会(FIGO)的标准进行评估。手术前未对这些患者进行局部或全身治疗。收集组织并立即在液氮中冷冻,储存在-80 ℃。本研究经江西省妇幼保健院研究伦理委员会批准,每个参与者都获得知情同意。
1.2 细胞系 人卵巢表面上皮细胞(HNOECs)和卵巢癌细胞系SW626分别购自美国典型培养物保藏中心(ATCC)和中国科学院细胞库,根据供应商的说明培养卵巢癌细胞。在含有10%胎牛血清(FBS)的Dulbecco改良Eagle培养基中(美国Gibco公司)常规培养,所有培养基均含1%青-链霉素(100 U/mL青霉素和100 μg/mL链霉素),将所有细胞培养于补充有5%CO2、37 ℃的细胞培养箱中。
1.3 药物 藤黄酸购于上海阿拉丁生化科技有限公司(G101480),处理SW626细胞,浓度为每孔100 μg/2×104cells,分为对照组和藤黄酸组,分别处理6、12、24 h。
1.4 实时荧光定量PCR(RT-qPCR)分析 使用TRIzol试剂(美国英杰生命科技有限公司)从组织样品或培养的细胞中提取总RNA。使用Reverse Transcription试剂盒[宝生物工程(大连)有限公司]将2 μg总RNA用于逆转录反应和cDNA合成。使用SYBR-Green Real-Time Master Mix(日本TaKaRa公司)进行实时荧光定量PCR分析。将结果标准化为组成型表达基因GAPDH。GAS5引物正向5′-CTTCTGGGCTCAAGTGATCCT-3′,反向5′-TTGTGCCATG AGACTCCATCAG-3′;MMP-2引物正向5′-TGGCAGTGCAA TACCTGAAC-3′,反向5′-CCGTACTTGCCATCCTTCTC-3′;MMP-9引物正向5′-AGTTTGGTGTCGCGGAGCAC-3′,反向5′-TACATGAGCGCTTCCGGCAC-3′’;GAPDH引物正向5′-ACACCCACTCCTCCACCTTT-3′,反向5′-TTACTCCTTGGAG GCCATGT-3′;U6引物5′-GCTCTAGATTTGATCCGACGCC GCCATCTC-3′。在Applied Biosystems 7500序列检测系统(美国ABI公司)上进行RT-qPCR和数据收集。计算GAS5的相对表达并使用2-ΔΔCt方法相对于GAPDH标准化。
1.5 CCK-8细胞增殖实验 根据制造商的说明书,用Cell Counting Kit-8(CCK-8)(日本同仁化学研究所)进行细胞增殖测定。将每孔2×104个细胞接种在96孔板中。接种后24 h内的三个间隔用CCK-8评估细胞活力。CCK-8在37 ℃处理1 h后,使用酶标仪测450 nm处的吸光度。
1.6 MTT细胞毒性实验 采用MTT法检测藤黄酸对正常卵巢细胞系IOSE386(中国典型培养物保藏中心)的细胞毒性。IOSE386细胞用10% FBS和1%青霉素-链霉素的RPMI-1640培养基培养,培养条件为5% CO2、37 ℃的细胞培养箱。取对数生长期的细胞以每孔7×103个密度接种于96孔板,过夜培养使细胞贴壁。然后弃去培养液,加入用培养液稀释的不同质量浓度藤黄酸,每个质量浓度设置6个平行,空白对照只加入培养基,培养48 h后吸去培养液,每孔加入100 μL质量浓度为500 μg/mL的MTT溶液。培养4 h,吸去MTT,PBS清洗,加入100 μL DMSO,用酶标仪测量580 nm处的OD值,计算细胞的存活率。细胞存活率=[OD(加药孔)/OD(空白孔)]×100%。
1.7 蛋白质提取和蛋白免疫印迹检测 用SDS裂解缓冲液(上海碧云天生物技术有限公司)在冰上将培养的细胞中提取总蛋白质20 min,并使用BCA蛋白质测定试剂盒(美国Pierce公司)测定蛋白质质量浓度。为检测p-p65的表达,使用核蛋白和胞浆蛋白抽提试剂盒(上海碧云天生物技术有限公司)提供的具体步骤对核蛋白进行抽提,并存储在-70 ℃以进行下一步实验。通过10% SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的总蛋白质,转移至0.22 μm聚偏二氟乙烯(PVDF)膜(美国Millipore Corp公司)并与特异性第一抗体(美国Abcam公司)一起室温孵育8 h。PBS洗掉一抗,经过荧光二抗(上海碧云天生物技术有限公司)孵育2 h后,通过增强化学发光(ECL)检测蛋白质,并通过光密度测定法(Quantity One软件;美国Bio-Rad公司)定量条带的强度。 GAPDH抗体(1∶2 000)用作总蛋白的内参蛋白,Lamin A作为核蛋白的内参蛋白。测定MMP-2(1∶1 500)、MMP-9(1∶1 000)、VEGF(1∶800),侧支发芽因子同源物2(Sprouty homolog2,SPRY2)(1∶900),p-p65(1∶800)蛋白表达。
对供试种子样品进行处理,种子发芽势统计分析结果见表3。结果表明,不同处理上杭锥种子发芽势为7.61%~85.20%,处理6发芽势最高为85.20%。从R值可以得出,不同因素对上杭锥种子发芽势影响的主次顺序为B>A>C>D,依次为浸种温度、粒级分类、GA3浓度、萌发温度处理。根据各因素水平的平均值(ki)的大小比较可得最优水平组合为A1B2C1D2,即大粒种子在30℃温度下浸种后沥干,加入50mg·l-1GA3溶液浸种24h,放在萌发温度20℃的人工气候箱内萌发,种子发芽势最高。进一步经方差分析,浸种时间对上杭锥种子发芽势的影响是极显著 (P=0.0096< 0.01)。
1.8 质粒构建细胞转染 构建GAS5的siRNA,合成人GAS5完整序列(2 651 bp)并亚克隆到siRNA载体中。另外,通过DNA测序确认质粒[生工生物工程(上海)股份有限公司]。将卵巢癌细胞接种于24孔板(每孔1×105个细胞)中并孵育24 h,然后使用Lipofectamine 2000(美国英杰生命科技有限公司)转染si-GAS5(每孔2 μg/2×104cells)或阴性对照(si-NC,每孔2 μg/2×104cells)到细胞内。按照制造商的说明书在无血清培养基中进行孵育。
1.9 酶联免疫吸附检测 将各组细胞离心,取上清液,使用IL-6和IL-1β 酶联免疫吸附检测试剂盒(上海江林生物科技有限公司),严格按照制造商的说明进行检测,用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中人白介素的质量浓度。

2 结果
2.1 藤黄酸促进卵巢癌细胞SW626中的GAS5的表达 使用RT-qPCR检查12例配对的人卵巢癌组织和相匹配的癌旁正常组织中GAS5的表达。如图1A所示,与相应的相邻组织学正常组织比较,卵巢癌组织中GAS5的表达下调(P<0.05)。其次,检测卵巢癌细胞系SW626和正常卵巢细胞中GAS5的表达差异,与正常卵巢细胞比较,SW626中GAS5的表达同样下调(图1B,P<0.05)。另外,在藤黄酸(6、12、24 h)刺激下,GAS5的表达呈时间依赖性升高(图1C,P<0.05)。

注:A为卵巢癌组织和相应癌旁正常组织(n=12)中GAS5的表达,与癌旁正常组织比较,*P<0.05;B为卵巢癌细胞中GAS5表达,与人卵巢表面上皮细胞比较,*P<0.05;C为藤黄酸(每孔100 μg/2×104 cells)对卵巢癌细胞中GAS5表达的影响,与对照组比较,*P<0.05;与藤黄酸-6 h比较,#P<0.05;与藤黄酸-12 h比较,&P<0.05。图1 藤黄酸对卵巢癌细胞中lncRNA GAS5表达的影响
2.2 藤黄酸抑制卵巢癌细胞SW626的增殖和转移相关指标 采用CCK-8实验检测藤黄酸对卵巢癌细胞增殖能力的影响,分析与对照组比较,藤黄酸处理后细胞在6、12、24 h增殖率均下调(图2A,P<0.05);藤黄酸分别在每孔10、50、100、200、300、400、500、600 μg/2×104cells浓度下处理正常卵巢细胞IOSE386,增殖率均未降低(图2B,P>0.05);藤黄酸处理24 h后,MMP-2、MMP-9的mRNA和蛋白表达均下调(图2C~2F,P<0.05)。

注:A为CCK-8用于检测藤黄酸(每孔100 μg/2×104 cells)处理不同时间卵巢癌细胞的成活率,B为MTT法检测藤黄酸(每孔10~600 μg/2×104 cells)处理卵巢细胞IOSE386的成活率,RT-qPCR检测卵巢癌细胞中MMP-2(C)、MMP-9(E)mRNA表达,Western blot检测卵巢癌细胞中MMP-2(D)、MMP-9(F)蛋白表达。与对照组比较,*P<0.05。图2 藤黄酸对卵巢癌细胞成活率和MMP-2及MMP-9表达的影响(n=3)
2.3 藤黄酸抑制卵巢癌细胞SW626的炎症水平 藤黄酸刺激24 h后,与对照组比较,p-p65核表达降低(图3A,P<0.05),炎症因子水平IL-6、IL-1β降低(图3B~3C,P<0.05)。

注:A为Western blot检测卵巢癌细胞核中p-p65表达,ELISA检测卵巢癌细胞培养物上清液中IL-6(B)、IL-1β(C)水平。与对照组比较,*P<0.05。图3 藤黄酸对卵巢癌细胞中炎症反应的影响(n=3)
2.4 沉默GAS5恢复卵巢癌细胞的增殖,转移相关指标和炎症因子的表达siGAS5转染卵巢癌细胞并联合藤黄酸处理,使用CCK-8检测GAS5沉默对卵巢癌细胞增殖能力的影响,结果显示,与单独藤黄酸处理24 h组比较,siGAS5+藤黄酸处理后细胞在24 h增殖率上调(图4A,P<0.05),MMP-2、MMP-9、VEGF的蛋白表达增加(图4B~4D,P<0.05)。与单独藤黄酸处理24 h组比较,藤黄酸+siGAS5组p-p65核表达部分升高,IL-6、IL-1β水平部分上调(图4E~4G,P<0.05)。
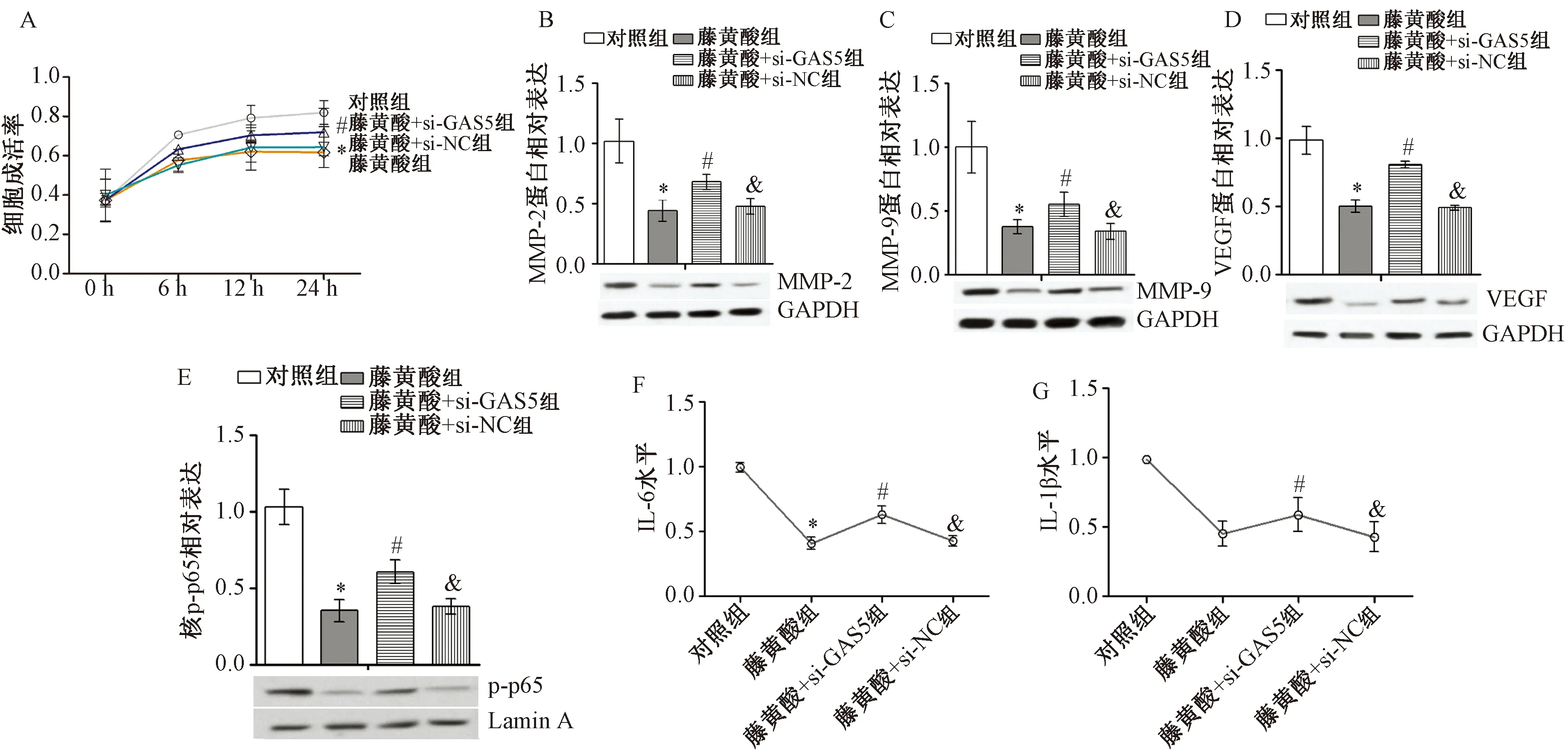
注:A为CCK-8检测卵巢癌细胞的成活率,Western blot检测卵巢癌细胞中MMP-2(B)、MMP-9(C)、VEGF(D)蛋白及细胞核中p-p65蛋白(E)表达,ELISA检测卵巢癌细胞培养物上清液中IL-6(F)、IL-1β(G)水平。与对照组比较,*P<0.05;与藤黄酸组比较,#P<0.05;与藤黄酸+si-GAS5比较,&P<0.05。图4 沉默GAS5恢复卵巢癌细胞成活率(n=3)
2.5GAS5敲低减弱藤黄酸对miR-21和SPRY2的调控作用 miR-21在SW626细胞中表达升高,SPRY2表达则降低(P<0.05)。在藤黄酸处理24 h后细胞中miR-21表达降低,SPRY2表达升高(P<0.05)。在藤黄酸+si-GAS5转染处理24 h细胞中miR-21表达升高,SPRY2表达降低(P<0.05)。见图5。

注:A、C为RT-qPCR法检测卵巢癌细胞中miR-21表达,B、D为Western blot检测SPRY2的蛋白表达。与对照组比较,*P<0.05;与藤黄酸组比较,#P<0.05;与藤黄酸+si-GAS5比较,&P<0.05。图5 GAS5敲低减弱藤黄酸对miR-21和SPRY2的调控作用(n=3)
3 讨论
研究表明,中药单体化合物可能在治疗癌症中起重要作用[10]。藤黄酸是一种多靶标的化合物,具有抗肿瘤活性[5,11]。研究表明藤黄酸可在体内外抑制卵巢癌肿瘤的生长[5]。本研究确定了藤黄酸对卵巢癌细胞炎症、细胞增殖、以及转移标志物表达水平的影响,进一步明确lncRNA GAS5的异常表达以及其介导的miR-21/SPRY2轴可能是藤黄酸调节卵巢癌细胞功能的关键下游机制之一。
多项证据表明,藤黄酸不仅抑制肿瘤细胞增殖、促进多种肿瘤细胞凋亡,且不良反应较少[12-13]。本研究以每孔100 μg/2×104cells的藤黄酸分别处理卵巢癌细胞6、12、24 h后,卵巢癌细胞的增殖能力以时间依赖性下调。另外,肿瘤细胞转移标志物MMP-2、MMP-9和VEGF蛋白表达均被藤黄酸所抑制。由此提示,藤黄酸可以作为潜在的抗卵巢癌新药物。
近年来研究表明,lncRNA在细胞的基本生物学过程中起重要作用,如影响表观遗传信息、促进细胞生长[14-15]。
在多种肿瘤恶性进展过程中频繁出现lncRNA表达失调现象,可能对肿瘤的发展起关键作用[16]。lncRNA GAS5全称为生长停滞特异性5,被发现可作为潜在的肿瘤抑制基因,其在生长停滞的细胞中高表达[17-18],在乳腺癌和前列腺癌等癌症中异常表达[19-20],对不同类型的癌细胞生长具有抑制作用,其中包括卵巢癌细胞[6-7]。本研究证明GAS5在卵巢癌中被下调,而且藤黄酸可以恢复GAS5在卵巢癌细胞中的表达。为进一步验证藤黄酸是通过上调GAS5参与抑制卵巢癌细胞的恶性特征,本研究在藤黄酸处理卵巢癌细胞的基础上同时改变GAS5的表达,结果表明沉默GAS5的表达可以在较大程度上逆转藤黄酸对卵巢癌细胞表型的影响,包括部分恢复细胞生长,恢复细胞转移标记物MMP-2、MMP-9和VEGF。抑制GAS5的水平可提高卵巢癌细胞的迁移、侵袭能力和增殖能力[8],本研究结果表明,藤黄酸通过调节lncRNA GAS5参与抑制卵巢癌细胞的恶性特征。
NF-κB可被不同的内源性或外源性因子激活从而刺激细胞,促进一系列促炎和抗凋亡相关基因的表达。研究表明,NF-κB信号通路在各种肿瘤的发展中起着重要作用,在晚期可以促进肿瘤的恶性进展[21]。在本研究中,藤黄酸能抑制细胞核中磷酸化p65的表达以及促炎症因子IL-6和IL-1β的水平,说明NF-κB信号通路的失活可能是藤黄酸对于卵巢癌的抑制作用的关键机制之一。沉默GAS5的表达可逆转藤黄酸对卵巢癌细胞磷酸化p65表达及促炎症因子IL-6和IL-1β水平的抑制作用,表明藤黄酸可通过调节lncRNA GAS5介导抑制卵巢癌细胞炎症反应。
GAS5在卵巢癌中已被证实可以抑制miR-21并促进SPRY2基因表达,从而在卵巢癌细胞中扮演内源竞争性RNA的角色调节肿瘤细胞的增殖[7]。基于本研究所得到的藤黄酸可正向调节GAS5的结论,进一步验证藤黄酸对卵巢癌细胞中miR-21和靶基因SPRY2水平的影响,最终确定藤黄酸不仅上调GAS5水平,且抑制miR-21/SPRY2表达水平的比值。表明藤黄酸可能直接调控了GAS5/miR-21/SPRY2轴的表达水平。
综上所述,藤黄酸可阻止卵巢癌细胞过度增殖、细胞转移和细胞炎症的激活,上调lncRNA GAS5是藤黄酸发挥体外抑制卵巢癌增殖、转移、炎症功能的关键机制之一,为卵巢癌的药物治疗提供了新的理论基础、潜在的检测和治疗靶点。

