lncRNA12753在β-葡聚糖诱导小鼠树突状细胞成熟中的作用①
苏明明 沈 凯 丁 骏 宁永玲 戚春建
(南京医科大学附属常州市第二人民医院中心实验室,肿瘤研究所,常州213164)
树突状细胞(dendritic cell,DC)是体内最重要的专职抗原提呈细胞,在启动和调节先天免疫和适应性免疫应答中起关键作用[1-2]。肿瘤组织浸润DC可以捕获并加工肿瘤抗原,在趋化因子的作用下,迁移至外周淋巴器官激活初始CD4+和CD8+T 细胞以启动特异性细胞免疫应答。此外,DC还可以分泌多种趋化因子和细胞因子来介导其他免疫细胞募集到免疫反应发生部位,例如IL-8、MIP、IL-6 和IL-12 等[3-4]。因此,DC 在抗肿瘤免疫中具有不可或缺的作用[5-6]。目前,基于DC 的肿瘤疫苗在全球范围内已广泛应用于临床试验和治疗[7]。本课题组的临床研究结果也显示,负载自体肿瘤抗原的DC 疫苗可以在58% 的Ⅱ/ⅢA 期ER/PR 双阴性乳腺癌患者体内诱导产生肿瘤特异性的迟发型超敏反应,延长患者的无进展生存期[8]。
DC 通过模式识别受体(pattern recognition re‐ceptors,PRR)如Dectin-1、TLR-4 等识别病原体及细胞内容物等抗原信息后启动分化、成熟,其成熟程度与免疫微环境中的信号刺激密切相关[9]。在DC的发育成熟过程中,细胞表面分子表达、细胞因子分泌和抗原加工能力都会发生显著变化。β-葡聚糖是一种由D-葡萄糖单体通过β-糖苷键连接形成的多糖,存在于多种植物和微生物中。作为生物效应调节剂,β-葡聚糖的抗肿瘤和抗感染活性已得到广泛研究[10-11]。研究表明,DC 表面的Dectin-1 分子可以识别β-葡聚糖,并通过形成免疫突触激活下游信号引发DC 免疫功能改变。本课题组前期的研究表明,β-葡聚糖可以直接诱导DC 成熟,驱使CD4+T 细胞向Th1 分化,促进细胞毒T 淋巴细胞(cytotoxic T lymphocytes,CTL)增殖,其下游信号与ERK、P38 等信号通路相关[12]。早在2009 年,LIU 等[13]用新鲜分离的小鼠肿瘤细胞与DC 共培养,诱导其分化为肿瘤微环境驯化DC(TEDC),抑制CD4+T 细胞的增殖,从而提高肿瘤的免疫逃逸,本课题组前期的研究表明β-葡聚糖可以促进TEDC 成熟且抑制T 细胞分化[14]。
长链非编码RNA(long non-coding RNA,lncRNA)是一种长度大于200 nt且不具有蛋白质编码能力的RNA。lncRNA 可以调控多种细胞的发育和分化,比如心肌细胞、干细胞、上皮细胞、红细胞、脂肪细胞和多种不同免疫细胞谱系等,与主要依赖碱基互补性调控靶基因表达的miRNA 不同,lncRNA 涉及多种机制来调节这些生物学过程[15]。其中大多数功能需要与一种或多种RNA 结合蛋白(RNA binding protein,RBP)相互作用来实现[16-17]。本研究发现β-葡聚糖激发成熟的DC 会显著上调表达lncRNA-12753。因此,本研究探索了lncRNA12753 在β-葡聚糖诱导DC成熟过程中的作用及可能机制。
1 材料与方法
1.1 材料
1.1.1 实验材料 本研究使用的β-葡聚糖是一种源于酵母细胞壁的全葡聚糖颗粒(whole particle glu‐can,WGP),购自南京英缪赛生物科技有限公司。为了去除β-葡聚糖中可能的LPS 污染,预先使用200 mmol/L NaOH 处理20 min,彻底洗涤后,重悬于去离子水中。C57BL/6小鼠购自常州市卡文斯实验动物有限公司。CD4 卵清蛋白T 细胞受体转基因OT-Ⅱ小鼠由清华大学祁海教授慷慨惠赠,所有小鼠在无特定病原体的条件下饲养。
1.1.2 实验试剂 重组小鼠FMS 样酪氨酸激酶3配体(FMS-like tyrosine kinase 3 ligand,Flt3L)购自Peprotech 公司;检测IL-12p40、IL-10、IL-6、TNF-α 和IFN-γ 的ELISA 试剂盒,PE 标记的抗小鼠CD11c 抗体,FITC 标记的抗小鼠I-A/I-E(MHC Ⅱ)抗体,Per‐CP-cy5.5 标记的抗小鼠CD86 抗体,FITC 标记的抗小鼠CD40 抗体,PerCP-Cy5.5 标记的抗小鼠CD80抗体,羧基荧光黄二乙酸盐琥珀酰亚胺(carboxyfluo‐rescin succinimidyl ester,CFSE),PE 标记的抗小鼠CD4 抗体、PE-cy7 标记的抗小鼠IFN-γ 抗体以及胞内染色固定剂、破膜剂均购自Biolegend 公司;白细胞活化混合物(leukocyte activation cocktail,LAC)购自BD Pharmingen 公司;RPMI1640 培养基、减血清培养基(Opti-MEM)、磷酸缓冲盐溶液(PBS)购自Gibco 公司;胎牛血清(FBS)购自BI 公司;TRIzol 试剂、逆转录试剂盒、SYBR Green Supermix 购自Va‐zyme 公司;卵清蛋白(ovalbumin,OVA)购自Sigma-Aldrich 公 司;CD4 磁 珠 分 选 试 剂 盒、Lipofectami‐neTM2000购自Invitrogen公司。
1.2 方法
1.2.1 小鼠骨髓DC 培养 取6~8 周龄C57BL/6小鼠,CO2法处死后取其股骨和胫骨,剔除肌肉,用PBS 反复吹洗骨髓腔得到骨髓细胞。离心后,加入4 ml 红细胞裂解液去除红细胞,最后用70 µm 细胞筛过滤。使用RPMI1640 完全培养基(含100 ng/ml Flt3L、100 ml/L FBS、0.009 mmol/L β-巯基乙醇、10 mmol/L 丙酮酸钠和1 mmol/L 非必需氨基酸)按细胞数1×106个/ml 重悬细胞,再按每孔3 ml 铺至6 孔细胞培养板中,置于37℃、5%CO2的培养箱中培养。第3 天进行半换液,第5 天收集细胞,为未成熟DC。加入100 µg/ml β-葡聚糖继续培养2 d 诱导成熟,未刺激组设为对照。
1.2.2 测序分析 使用3种不同生长环境(正常培养基、正常培养基中加入小鼠肺癌细胞株LLC 或小鼠乳腺癌细胞株4T1 培养上清液)得到未成熟DC(N、LLC 或4T1),3 组未成熟DC 分别经WGP 诱导后得到成熟DC(mN、mLLC 或m4T1)。各组收集至少5×106个细胞,预冷PBS 洗涤后,用TRIzol 处理保存送至测序公司进行转录组测序。
1.2.3 siRNA 转染 第3 天半换液时进行siRNA转染(LipofectamineTM2000 终浓度为2 µg/ml、siRNA终浓度为0.528 µg/ml)。干扰处理48 h 后,收集细胞。lncRNA12753-siRNA 序列:F:5'-GCAAAUCAU‐UUCAGCCCAATT-3',R:5'-UUGGGCUGAAAUGAU‐UUGCTT-3';阴性对照(NC)序列:F:5'-UUCUCC‐GAACGUGUCACGUTT-3',R:5'-ACGUGACACGUUCGGAGAATT-3'。
1.2.4 实时荧光定量PCR(qRT-PCR) 用TRIzol试剂处理细胞并提取RNA,逆转录合成cDNA。qRT-PCR 20 µl 反应体系包括上下游引物各1 µl、cDNA 模 板2 µl、2×SYBR Green Supermix 10 µl、ddH2O 6 µl。每组样品设3 个复孔,经过40 个循环扩增后以GAPDH 为内参计算lncRNA 组间的相对表达量,计算公式为2−ΔΔCt。GAPDH 引物序列:F:5'-CACUCAAGAUUGUCAGCAATT-3',R:5'-UUGCUGACAAUCUUGAGUGAG-3';lncRNA12753引物序列:F:5'-TCCTCACCTCACCGAAGCC-3',R:5'-CAGC‐GTTGGATAAGTACCTCACA-3'。
1.2.5 流式细胞术 收集细胞,预冷PBS 洗涤后,与荧光染料标记的抗CD11c、CD40、CD80、CD86、MHC Ⅱ单克隆抗体和同型对照抗体4℃避光孵育30 min。PBS洗涤2次后,用流式细胞仪进行分析。
1.2.6 酶联免疫吸附实验(ELISA) 收集各组培养上清液,置于−80℃以备用。按照ELISA 试剂盒的操作说明,进行包被、一抗孵育、二抗孵育、显色等,最后用酶标仪测定标准品浓度和吸光度(A)值并绘制标准曲线,计算上清液中TNF-α、IL-12p40、IL-6、IL-10和IFN-γ的浓度。
1.2.7 T 细胞增殖分化试验 取6~8 周龄OT-Ⅱ小鼠脾脏和淋巴结,制备成单细胞悬液。裂解红细胞后使用磁珠分选出CD4+T 细胞,并进行CFSE 标记。将T 细胞和各组DC 按照5∶1 的比例混合培养,同时加入100 µg/ml OVA 作为抗原。培养3~5 d后,加入LAC 处理4~6 h 收集细胞,表面染色后再固定破膜,进行胞内染色,最后使用流式细胞仪分析CD4+T细胞增殖和分化情况。
1.3 统计学分析 应用Graphpad Prism7.0 软件绘制热图、柱状图,Flowjo 7.60 软件分析流式数据,String 数据库进行蛋白质相互作用分析。所有数据使用表示,两两组间比较使用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 成熟DC 差异表达lncRNA 的筛选 与未成熟DC 相比,3 种不同生长环境下的DC 经WGP 诱导成熟后(mN vs N、mLLC vs LLC、m4T1 vs 4T1),差异性表达且变化趋势一致的lncRNA 有9 个,上调4 个,下调5 个(图1A)。qRT-PCR 进一步进行验证,各基因表达变化和测序结果一致。 其中发现Lnc-TCONS_00012753 的差异表达最显著,与未成熟DC相比,成熟DC 中上调为7.8 倍(图1B),因此本文选择lncRNA12753 作为实验研究对象。 对lnc-RNA12753 设计了3 条siRNA 序列,分别干扰后,使用qRT-PCR 检测评估干扰效率。 结果显示siR‐NA5655 干扰效率最高,可以降低30%~44% 的lnc-RNA12753 的表达(图1C),且差异具有统计学意义(t=5.201,P<0.05)。
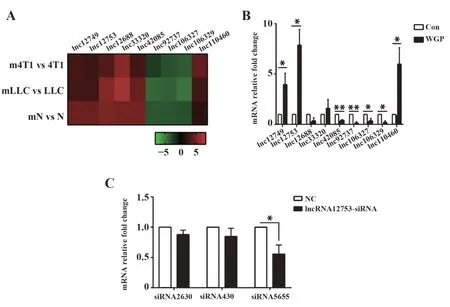
图1 β-葡聚糖诱导成熟的DC中差异表达lncRNA的筛选Fig.1 Screening of differentially expressed lncRNA in ma⁃ture DC stimulated by β-glucan
2.2 lncRNA12753 对WGP 诱导DC 表型的影响
未成熟DC 经lncRNA12753 敲低后,再加入WGP 诱导,48 h 后检测DC 表面分子的变化。结果表明,与对照组相比,干扰组DC 表面MHC Ⅱ表达水平显著降低,对照组MFI 值为358.8±68.13,干扰组MFI 值为248.2±47.42,差异具有统计学意义(P<0.05)。同时还检测了共刺激分子CD86、CD80、CD40 等分子的表达情况,发现两组间表达一致(图2)。
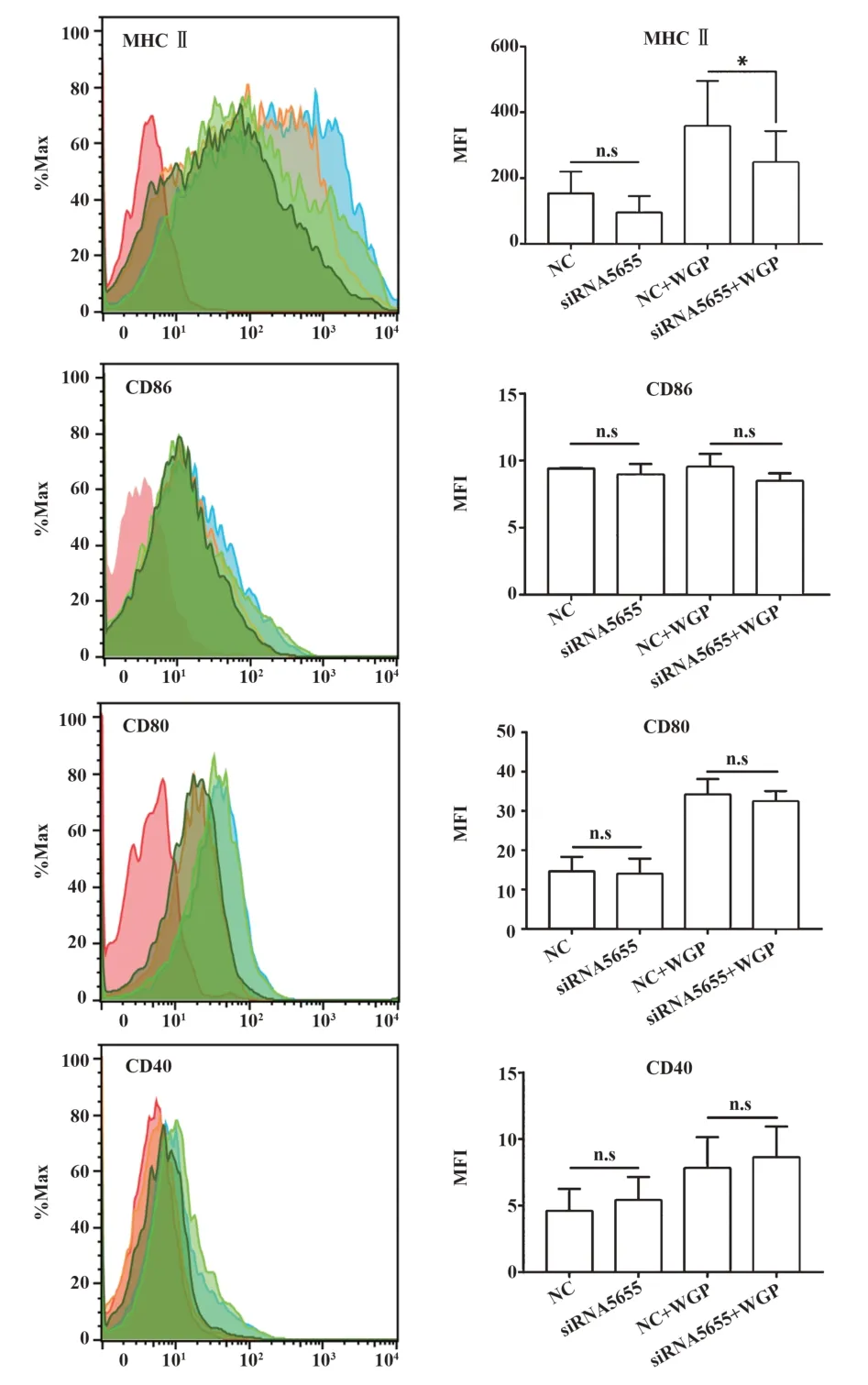
图2 敲低lncRNA12753 对β-葡聚糖激发DC 表面分子表达的影响Fig.2 Effect of knocking down lncRNA12753 on mole⁃cules expression on DCs surface stimulated by β -glucan
2.3 lncRNA12753 对WGP 诱导DC 产生炎症细胞因子的影响 收集上清液并检测TNF-α、IL-12、IL-6、IL-10 的浓度情况。使用WGP 分别激发干扰组和对照组DC后,实验结果表明,DC中lncRNA12753敲低后,细胞上清液中IL-12p40 的分泌明显减少,对照 组 为(235.7±38.72)pg/ml,干 扰 组 为(161.3±23.91)pg/ml,差异有统计学意义。而IL-10 的水平显著提高,对照组为(43.11±3.829)pg/ml,干扰组为(277.9±10.67)pg/ml,差异有统计学意义(图3)。IL-6、TNF-α也呈降低趋势,但差异无统计学意义。
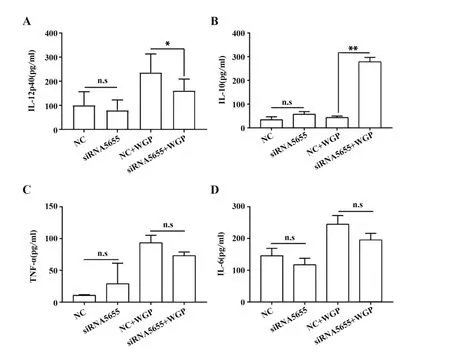
图3 敲低lncRNA12753 对β-葡聚糖激发DC 分泌细胞因子的影响Fig.3 Effect of knocking down lncRNA12753 on cyto⁃kines secretion of DCs stimulated by β-glucan
2.4 lncRNA12753 对WGP 诱 导DC 激 发T 细 胞 免疫应答的影响 使用OT-Ⅱ小鼠来源的CD4+T 细胞来测定DC诱导抗原特异性T细胞免疫应答的能力。增殖实验结果表明,DC中下调lncRNA12753的表达后,其诱导OVA 特异性CD4+T 细胞增殖的能力显著降低,为对照组的35%。进一步分析这些增殖的T细胞中IFN-γ+Th1 细胞的比例,发现干扰组仅为对照组的50%。同时,收集DC-T细胞共培养上清液并检测IFN-γ 的分泌水平,发现对照组为(4.173±0.6308)pg/ml,而实验组为(2.027±0.4969)pg/ml,差异有统计学意义(图4)。
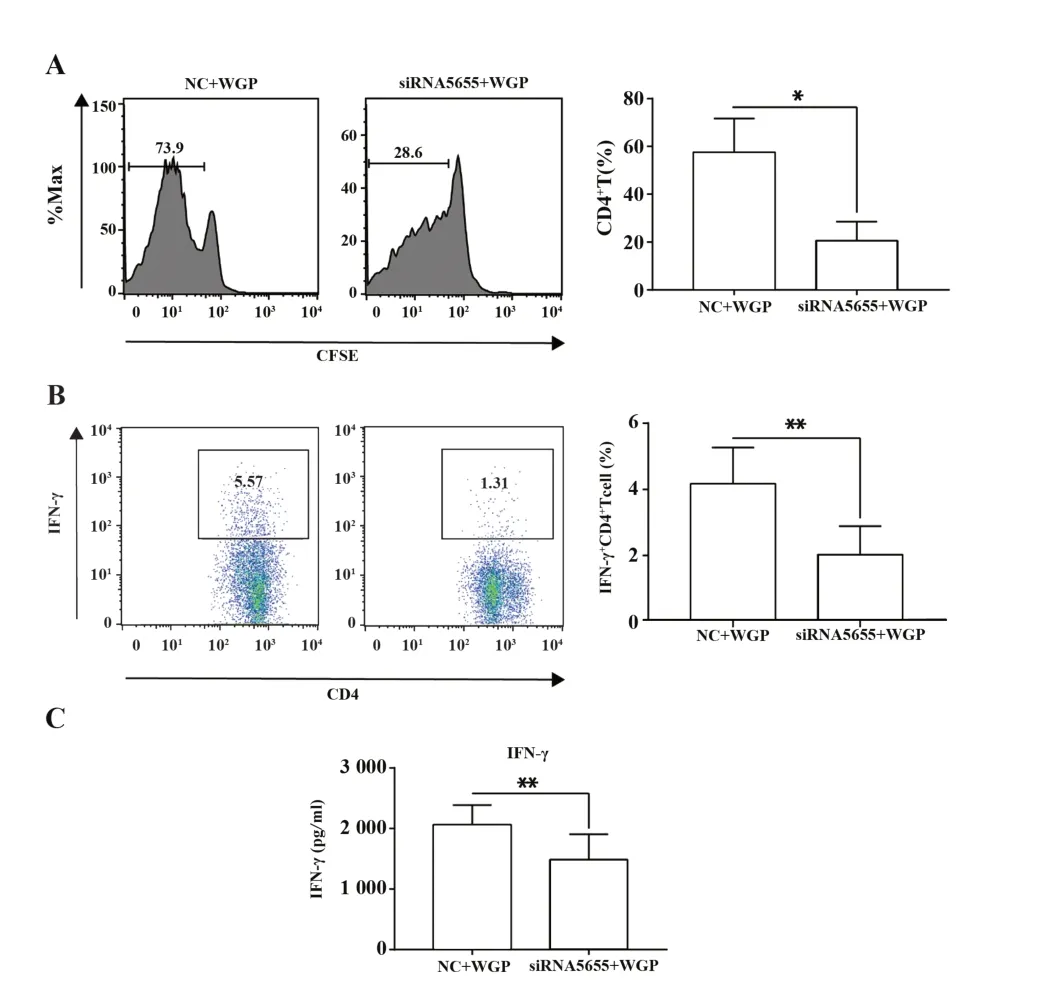
图4 敲低lncRNA12753 削弱β-葡聚糖激发DC 诱导抗原特异性Th1细胞免疫应答的能力Fig.4 Knocking down lncRNA12753 impaired β -glucanstimulated DCs functions to elicit antigen specific Th1 cells immune responses
2.5 String 数据库分析蛋白质之间的相互作用根据上述实验结果,用JASPAR 数据库联合UCSC数据库预测了调控MHC Ⅱ和炎症细胞因子(IL-6、IL-10、IL-12p40、TNF-α)表达的转录因子,发现转录因子RBPJ、IRF7、KLF14 对上述分子的表达都有调控作用。 进一步对lncRNA12753 进行分析,通过BLAST 序列比对得出lncRNA12753 的靶基因为Timp3 和Syn3,将靶基因(Timp3、Syn3),MHC Ⅱ(Ciita),炎症细胞因子(IL-12p40、IL-10、IL-6、TNF-α)和筛选的转录因子(RBPJ、IRF7、KLF14)输入到String 数据库得到蛋白质-蛋白质相互作用网络(PPI)。根据目前数据库中已有信息,lncRNA12753暂时没有发现直接调控DC 中MHC Ⅱ、IL-12p40 和IL-10,但其靶基因Timp3 和上述炎症细胞因子及转录因子IRF7 存在着联系(图5A)。后续qRT-PCR 实验表明敲低lncRNA12753后,转录因子IRF7发生显著性下降,差异具有统计学意义,说明lncRNA12753和IRF7的确存在着某种调控关系,但具体调控机制等待进一步实验(图5B)。
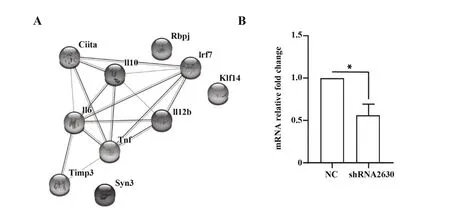
图5 String数据库分析蛋白质之间的相互作用(PPI)Fig.5 String database analysis of protein-protein interac⁃tion(PPI)
3 讨论
lncRNA 是免疫系统中基因表达调控的关键因素之一,具有高度谱系特异性,调节先天和适应性免疫细胞的分化及其功能[18-19]。Lnc-DC 是DC 中一组特定的长链非编码RNA,WANG 等[20]曾报道下调DC 中lncRNA 表达后,单核细胞和小鼠骨髓细胞分化为DC的数量显著减少,且其刺激T细胞活化的能力也降低,它通过与STAT3的C末端相互作用,阻止SHP1 对STAT3 的去磷酸化,进而促进STAT3 信号传导。ZHUANG 等[21]进一步研究表明Lnc-DC 还会通过TLR9/STAT3信号通路调控DC的生长、凋亡和免疫应答。在上述研究中,激发DC 成熟使用的诱导物为LPS。为探索lncRNA 在β-葡聚糖诱导DC 成熟及其免疫功能发挥中的作用,本研究使用了不同生长环境(正常和肿瘤微环境)下诱导产生的DC,经β-葡聚糖激发后,进行转录组测序,筛选出了显著上调表达的lncRNA12753。
为了明确lncRNA12753 对DC 免疫功能的影响,本研究使用siRNA技术对DC中lncRAN12753进行了敲低表达,再分析其免疫状态的变化。实验结果表明,敲低lncRNA12753 表达后,DC 表面的MHCⅡ明显下调。同时,这种DC 对细胞因子IL-12p40的分泌降低,而IL-10 分泌增加。成熟DC 激活T 细胞免疫应答需要三种信号,第一信号是MHC分子与抗原肽结合形成的复合物,将抗原信息传递给T 细胞表面受体;第二信号是DC 表面的共刺激分子CD86、CD80 和CD40 等与T 细胞表面分子如CD28等相互作用后产生共刺激信号;第三信号是DC 分泌产生的细胞因子如IL-12、TNF-α、IL-10等,直接影响T 细胞的极化方向[22-24]。其中IL-12诱导T 细胞向Th1 分化,而IL-10 诱导细胞向Th2 分化。本实验结果提示,lncRNA12753 可能会影响DC 诱导T 细胞增殖和分化的能力。接下来,将DC 与OT-Ⅱ小鼠CD4+T 细胞进行共培养,证实了lncRNA12753 的表达下调确实会削弱DC 诱导OVA 抗原特异性CD4+T细胞增殖和向Th1细胞分化的能力。
由String 数据库得出的结果显示干扰素调节因子7(IRF7)是最有可能参与调控的转录因子,IRF7最初是在EB 病毒感染中发现的,后来成为Ⅰ型干扰素(IFNs)抗病原感染的关键调节因子,它通过触发病原体识别受体(PRRs)识别病原核酸的信号级联来激活IRF7[25]。浆细胞样树突状细胞(pDC)表达IRF7,并能够在离体TLR-9 刺激下迅速产生Ⅰ型IFN 和IL-12p40[26]。此 外,IRF7 的 激 活 也 可 增 加MHC Ⅱ、共刺激分子的表达以及IFN-α 和TNF-α 的产生[27],但具体调控机制尚需进一步实验验证,这也是本课题组目前正在进行的工作。
总之,本研究表明,lncRNA12753 通过调节DC表面MHC Ⅱ的表达及IL-12、IL-10 极化因子的分化,影响其诱导Th1细胞免疫应答的能力,具体分子机制尚待进一步研究。

