特殊部位小肝癌超声引导下微波消融与手术切除的对比研究
李姗姗, 李开艳, 黄 哲, 吴晓贝, 罗鸿昌
原发性肝癌是我国目前发病率排行第4位的恶性肿瘤、第3位的肿瘤致死病因[1]。手术治疗是小肝癌的首选治疗手段之一,目前超声引导下MWA凭借其独特的优势在小肝癌治疗中得到广泛应用。在临床工作中,检出23.4%~34.7%肝癌病灶置于特殊部位[2],这些部位的病灶常由于进针困难,甚至首次消融不完全而归为消融治疗相对禁忌证[3],从而影响治疗决策。本文回顾性分析对于特殊部位原发性小肝癌超声引导下MWA与手术切除的对比疗效,旨在为临床提供最佳的治疗方案选择。
1 材料与方法
1.1 材料
1.1.1 病例来源 收集我院2011年1月至2019年5月240例特殊部位小肝癌患者资料,其中超声引导下MWA组116例,手术切除组124例。年龄22~87岁。两组患者基本情况,见表1。
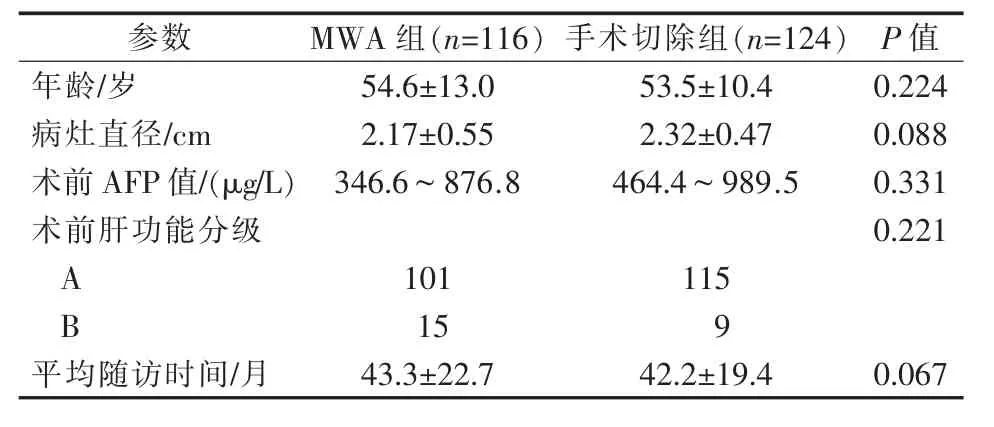
表1 患者基础资料比较
1.1.2 纳入标准 ①首次经病理学或血清AFP结合至少两项影像学诊断为原发性肝癌;②特殊部位:紧邻脏器(肿瘤边缘至胆囊、肝包膜、右肾、膈肌、胃肠道最短间距≤5 mm);紧邻大血管旁(肿瘤边缘至门静脉主干及一二级分支、肝静脉近心段以及下腔静脉最短距离≤5 mm);③单发肿瘤最大直径≤3.0 cm;④无明显凝血功能障碍,患者肝功能分级Child-pugh A或B级;⑤无手术相关禁忌证。
1.1.3 器材 使用LOGIQ E9、Philips EPIQ5、Aloka Prosound α7超声诊断仪,配套专用探头及穿刺导向器。采用最高输出功率100 W的南京亿高公司微波治疗仪(ECO-100c型)。使用内置冷循环的微波消融针(ECO-100AL10型),其规格为2.0×200 mm(外径14 G,长度18 mm)。
1.2 方法
1.2.1 操作 患者取仰卧位或侧卧位,在经验丰富的超声科医师操作下,根据肿瘤位置及大小制定合理的布针方案。穿刺点消毒并局麻后,使用专用配套穿刺导向器并在超声引导下,患者配合屏住呼吸,经皮将消融针尽可能一次性经肝实质进入瘤体中央,输出功率60 W,每点消融6 min,对于直径小于2 cm肿瘤采用单点次消融,直径2~3 cm的肿瘤视具体情况可多点次消融。消融范围尽可能超过肿瘤边界0.5 cm。整个过程需要实时监测,消融结束后,将消融针退至肝包膜下再进行热凝固,以防止针道转移及出血。位于紧邻脏器的病灶,进针路线尽量选择与周边脏器长轴方向平行;若存在角度进针时,则以针尖不刺破脏器且发热点至周边脏器距离≥1 cm为原则。病灶位于大血管旁,穿刺针尽量绕开肝内血管、胆管或紧贴其管壁而不刺破;若穿刺针无法完全避开,则可穿过门静脉及胆管的二级以下分支或肝静脉远心段(距下腔静脉>2 cm)。手术切除组要求全麻下局部完全切除病灶或解剖性切除,手术切除需超过肿瘤边界>1.0 cm肝组织。
1.2.2 随访 所有患者首次治疗后1个月内进行疗效评估,血清AFP明显下降,超声造影、增强CT或MRI提示原病灶区为无增强,即判断为肿瘤完全消除。反之,为局部残留。之后患者定期每2~3个月进行检查血清AFP以及常规超声,每6个月复查增强超声、CT或MRI。患者治疗1个月以后,若肝内新发且与原治疗区域紧邻的病灶,则为肿瘤局部复发;肝内分界清楚的其他区域新发病灶视为再发。对于局部残留病灶需及时再次消融,局部复发或再发的病灶,依据患者情况而选择不同治疗方式。
1.3 统计学方法
SPSS22.0软件对资料进行统计学研究分析,t检验用于计量资料,χ2检验用于计数资料。采用Kaplan-Meier方法制作患者生存曲线,Log-rank检验进行两组资料生存率的比较。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者术中、术后及住院情况
MWA组与手术切除组患者治疗后出现一般术后反应,如发热、疼痛、纳差、恶心呕吐等,但无胆瘘、肠穿孔、大出血等严重并发症。治疗前两组患者肝功能对比,差异无统计学意义(P>0.05)。MWA组患者术后肝功能、术中出血量、手术时间、术后体温、术后住院天数以及住院费用均优于手术切除组(P<0.05)。见表2。

表2 两组患者术中、术后和住院情况比较
2.2 两组局部治疗效果以及复发情况
手术切除组124个病灶,其中紧邻脏器74个,紧邻大血管旁50个。MWA组116个病灶,其中紧邻脏器49个,大血管旁67个。患者治疗后1个月内复查,MWA组患者肿瘤首次完全消除率97.4%(113/116)。经超声造影评估,3个病灶局部残留,及时再次微波后肿瘤消融完全。手术切除组肿瘤首次完全消除率100%,两组差异无统计学意义(P=0.072)。随访期间,MWA组31例局部复发,肿瘤局部复发率为26.7%,手术切除组25例局部复发,肿瘤局部复发率为20.2%,差异无统计学意义(P=0.230)。
2.3 两组患者远期生存疗效
本研究中MWA组中位随访时间36(8~96)个月,手术切除组中位随访时间40(9~96)个月。至随访结束,Log-rank检验对两组生存率进行处理,对比MWA组与手术切除组1、3、5年总生存率及无瘤生存率(P=0.852、P=0.341),见表3;图1、2。
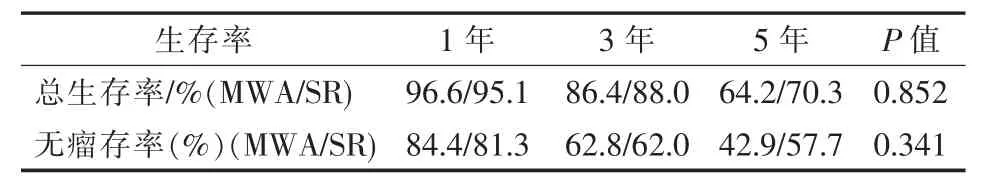
表3 两组总生存率、无瘤生存率的对比
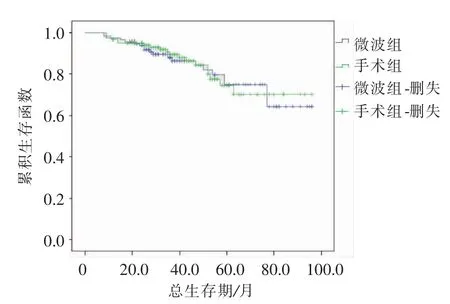
图1 两组生存曲线
3 讨论
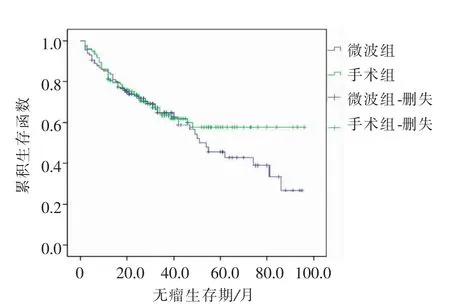
图2 MWA组与手术切除组无瘤生存曲线
查阅相关文献,近些年有研究报道过特殊部位肝癌热消融安全性的单方面研究。有研究表明肝内大血管周、包膜下是小肝细胞癌RAF术后复发的独立危险因素[4]。Lu等[5]提出大血管旁是影响肝肿瘤RAF术后预后的危险因素,这可能与大血管带走部分消融热量导致消融区域相对减小有关。一些学者对特殊部位肝癌MWA是否安全可行进行了前期探讨[6-9],结果与本文一致,表明紧邻大血管旁、胆囊、肝包膜、右肾、膈肌、胃肠道等特殊部位的肝癌MWA安全、可行。
本研究治疗后两组患者均未出现严重并发症,MWA组患者术中、术后以及住院情况均优于手术切除组(P<0.05),相比于手术切除组创伤小、恢复快且更经济。MWA组患者首次肿瘤完全消除率与手术切除组存在差距,这表明位于特殊部位的肿瘤病灶消融难度大,有待于今后在临床工作中进一步完善。MWA组有3例病例残留,其中1例病灶近胆囊旁,回顾性分析,可能与消融针尖偏离近胆囊面有关。2例近膈肌,1例由于进针角度大,消融针发热点位置偏差,另1例患者因右肩部疼痛剧烈难以坚持到最后,治疗被迫终止,导致消融残留。3例残留病灶二次消融后均完全消融。小肝癌的复发模式表现为微小播散灶或多中心发生[1],MWA可通过凝固性坏死灭活癌细胞,但无法清除其旁潜在微小转移灶,然而手术不仅可以完整摘除肿瘤,还可以连同切除周围潜在微小转移灶,相比于消融降低了局部肿瘤复发率。本研究中两组患者1、3、5年生存率相似,表明治疗特殊部位的原发性小肝癌,MWA取得了与手术切除相似的长期生存疗效。
随着超声介入技术的日新月异,超声引导下MWA治疗特殊部位病灶,除了严格掌握以上治疗策略,还可以使用一些辅助方法进而提高病灶首次完全消融率、降低并发症发生率。大血管旁的病灶,可通过注射生理盐水或酌情增加消融时间灭活肿瘤;肝脏边缘的病灶,人工胸/腹水[9-10]可辅助减少消融盲区带来的干扰;靠近空腔脏器的病灶,联合无水酒精形成水保护带并致肿瘤细胞发生不可逆坏死;紧邻膈肌的病灶,融合成像导航技术[11-12]辅助术中实时监测并克服小视野,术后联合CEUS进行即刻疗效评估。
综上所述,治疗特殊部位原发性小肝癌,超声引导下MWA与手术切除相比,具有相似的近期及长期疗效,且更经济、微创。在严格掌握治疗原则和策略下,超声引导下MWA可作为特殊部位原发性小肝癌的首选治疗手段之一。

