加减益经汤对卵巢功能减退大鼠转化生长因子β超家族相关成员的影响
李丽美, 夏建红, 黄雪萍, 陈婷婷, 和秀魁
(1.广东省妇幼保健院妇保科,广东广州 510095;2.广东省妇幼保健院保健部,广东广州 510095;3.广东省妇幼保健院妇科,广东广州 510095)
加减益经汤是广州中医药大学第一附属医院妇科张玉珍、陶莉莉教授的临床经验方,用于治疗卵巢功能减退(diminished ovarian reserve,DOR)引起的月经不调、不孕、性激素不足等疾病,疗效显著。前期临床研究发现,加减益经汤可明显改善肾虚肝郁证卵巢功能减退患者的临床症状、性激素水平及妊娠率[1-3],可恢复环磷酰胺导致的卵巢功能减退大鼠的动情周期,改善性激素水平[1],但其机制尚不明确。转化生长因子β(TGF-β)超家族相关成员对卵泡的生长、发育、成熟、闭锁,甾体激素的产生起着重要的调控作用[4]。另外,前期实验研究证实,采用单次腹腔注射75 mg/kg环磷酰胺法可成功构建卵巢功能减退大鼠模型[1,5],因此,本研究同法复制卵巢功能减退大鼠模型,以补佳乐为阳性对照药,观察加减益经汤对TGF-β超家族中相关成员的影响,以期明确其抗卵巢功能减退的作用机制。现将研究结果报道如下。
1 材料与方法
1.1 动物SPF级12周龄健康成年雌性SD大鼠60只,体质量(230±10)g,由广东省医学实验动物中心提供,动物质量合格证号:SCXK(粤)2013-0002。经阴道脱落细胞涂片筛查,动情周期均正常。室温20~25℃,光照14 h,相对湿度45%~55%。
1.2 药物、试剂与仪器加减益经汤组成包括熟地黄20 g,党参20 g,菟丝子20 g,当归10 g,丹参15 g,白芍10 g,柴胡6 g等9味中药[1,6-7]。将上述中药材水煎并浓缩为每毫升含生药2.358、1.179、0.589 5 g的药液,装瓶冷藏备用(由广东省中医研究所制备),应用时以蒸馏水调配。戊酸雌二醇(补佳乐),为法国DELPHARMLille S.A.S公司产品,批号:251A2。环磷酰胺,山西普德药业有限公司产品,批号:04130301;抗苗勒氏管激素(AMH)酶联免疫吸附分析(ELISA)试剂盒、抑制素B(INHB)ELISA试剂盒,均为上海西唐生物科技有限公司产品;AMH抗体与TGF-β1抗体为美国Santa Cruz生物技术公司产品;骨形态发生蛋白15(BMP-15)与转化生长因子-β1受体(TGF-β1R)为武汉博士德生物科技有限公司产品。Bio-Rad 680酶标仪,美国伯乐公司产品;Olympus DP2-BSW型病理图像采集系统,日本奥林巴斯公司产品。
1.3 动物模型的制备、分组与给药将60只大鼠按随机数字表分出10只作为空白组,给予1 mL生理盐水腹腔注射;其余50只大鼠给予环磷酰胺75 mg/kg(加生理盐水配制成1 mL药液)单次腹腔注射构建卵巢功能减退模型[1,5,8]。环磷酰胺造模后,大鼠出现精神差、蜷卧少动、脱毛、易激惹等表现,提示造模成功。将造模成功的大鼠采用完全随机分组法分为加减益经汤高、中、低剂量组,补佳乐组,模型组,每组10只。加减益经汤高、中、低剂量组参考《中药药理研究方法学》分别给予加减益经汤23.58、11.79、5.895 g·kg-1·d-1(生药剂量)灌胃;补佳乐组参考《中药药理研究方法学》给予补佳乐(与生理盐水配成混悬液)0.09 mg·kg-1·d-1灌胃;模型组与空白组灌胃10 mL·kg-1蒸馏水。造模后2 h开始灌胃给药,1次/日,连续4周。
1.4 观察指标与方法模型组在造模后2周,其余组在结束给药后,筛查出处于动情间期的大鼠,断颈处死。腹主动脉采血,室温静置30 min后离心分离血清置于-80℃保存待测。以双抗体夹心ELISA法测定血清AMH、INHB水平。卵巢组织切片后,采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶连结(SP)法按试剂盒说明书分别测定AMH、TGF-β1、TGF-β1R、BMP-15蛋白表达。采集免疫组织化学图像,用Image-Pro Plus分析软件进行图像分析,每张切片于400倍镜下随机选取5个视野,进行积分光密度(IOD)测定。IOD代表目的蛋白表达强度。
1.5 统计方法采用SPSS 21.0 For Windows统计分析软件进行数据处理。所有计量资料均以均数±标准差(±s)表示,多组比较采用单因素方差分析方法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清AMH、INHB水平的比较表1结果显示:与空白组比较,模型组大鼠血清AMH、INHB水平明显降低(P<0.01);与模型组比较,各治疗组血清AMH水平明显升高(P<0.01),加减益经汤高、中剂量组血清INHB水平明显升高(P<0.01),且各治疗组之间AMH、INHB比较,差异无统计学意义(P>0.05)。
表1 各组大鼠血清AMH、INHB水平的比较Table 1 Comparison of the serum levels of AMH and INHB in various groups (±s,pg·mL-1)
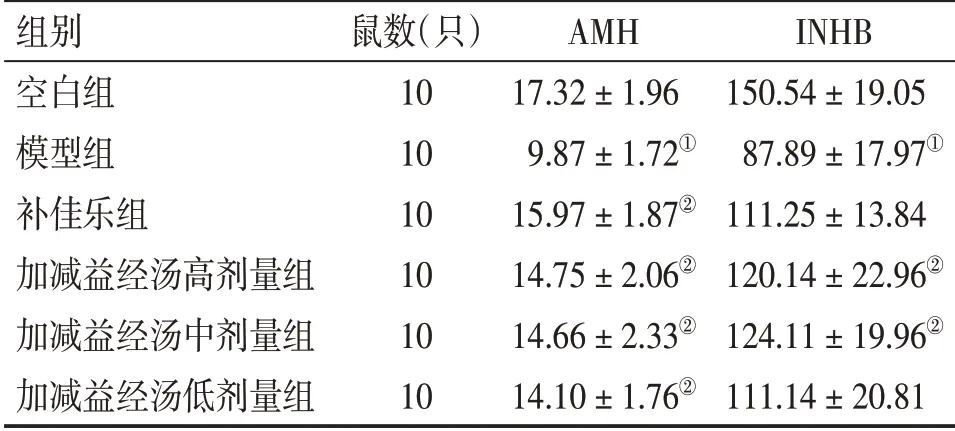
表1 各组大鼠血清AMH、INHB水平的比较Table 1 Comparison of the serum levels of AMH and INHB in various groups (±s,pg·mL-1)
①P<0.01,与空白组比较;②P<0.01,与模型组比较
组别空白组模型组补佳乐组加减益经汤高剂量组加减益经汤中剂量组加减益经汤低剂量组INHB 150.54±19.05 87.89±17.97①111.25±13.84 120.14±22.96②124.11±19.96②111.14±20.81鼠数(只)10 10 10 10 10 10 AMH 17.32±1.96 9.87±1.72①15.97±1.87②14.75±2.06②14.66±2.33②14.10±1.76②
2.2 各组大鼠卵巢TGF-β1、TGF-β1R表达水平的比较表2,图1~2结果显示:与空白组比较,模型组大鼠卵巢TGF-β1、TGF-β1R IOD值明显降低(P<0.01);与模型组比较,各治疗组大鼠卵巢TGF-β1、TGF-β1RIOD值明显升高(P<0.05或P<0.01),且各治疗组之间TGF-β1、TGF-β1R比较,差异无统计学意义(P>0.05)。
表2 各组大鼠卵巢TGF-β1、TGF-β1R表达水平的比较Table 2 Comparison of the expression levels of TGF-β1 and TGF-β1R in rat ovarian tissue of various groups (±s)
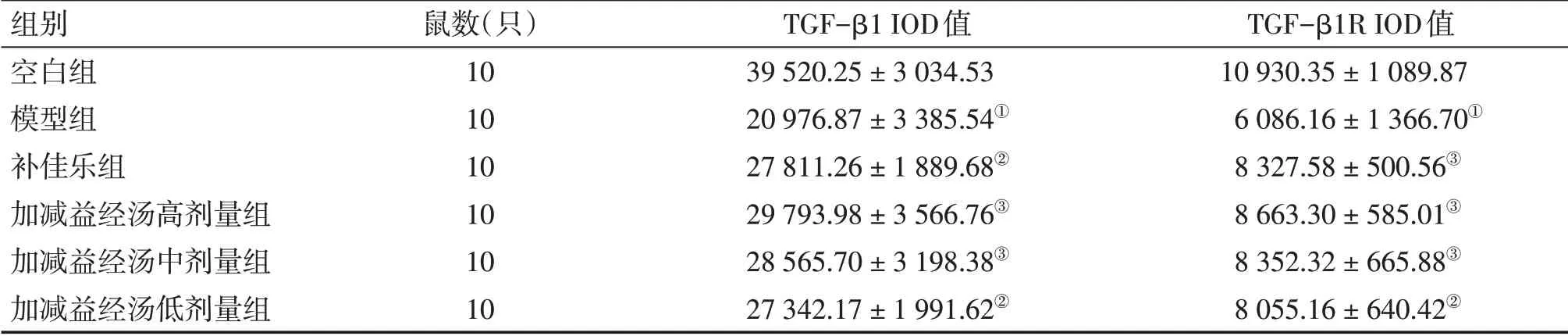
表2 各组大鼠卵巢TGF-β1、TGF-β1R表达水平的比较Table 2 Comparison of the expression levels of TGF-β1 and TGF-β1R in rat ovarian tissue of various groups (±s)
①P<0.01,与空白组比较;②P<0.05,③P<0.01,与模型组比较
组别空白组模型组补佳乐组加减益经汤高剂量组加减益经汤中剂量组加减益经汤低剂量组TGF-β1RIOD值10 930.35±1 089.87 6 086.16±1 366.70①8 327.58±500.56③8 663.30±585.01③8 352.32±665.88③8 055.16±640.42②鼠数(只)10 10 10 10 10 10 TGF-β1 IOD值39 520.25±3 034.53 20 976.87±3 385.54①27 811.26±1 889.68②29 793.98±3 566.76③28 565.70±3 198.38③27 342.17±1 991.62②

图1 各组大鼠卵巢TGF-β1阳性表达分布的比较(免疫组织化学法,×400)Figure 1 Comparison of the distribution of positive expression of TGF-β1 in rat ovarian tissue of various groups(by immunohistochemistry,×400)

图2 各组大鼠卵巢TGF-β1R阳性表达分布的比较(免疫组织化学法,×400)Figure 2 Comparison of the distribution of positive expression of TGF-β1 in rat ovarian tissue of various groups(by immunohistochemistry,×400)
2.3 各组大鼠卵巢AMH、BMP-15表达水平的比较表3,图3~4结果显示:与空白组比较,模型组AMH、BMP-15的IOD值明显降低(P<0.01);与模型组比较,各治疗组AMH、BMP-15 IOD值明显升高(P<0.05或P<0.01),且各治疗组之间AMH、BMP-15 IOD值比较,差异无统计学意义(P>0.05)。
表3 各组大鼠卵巢AMH、BMP-15表达水平的比较Table 3 Comparison of the expression levels of AMH and BMP-15 in ovarian tissue of various groups (±s)

表3 各组大鼠卵巢AMH、BMP-15表达水平的比较Table 3 Comparison of the expression levels of AMH and BMP-15 in ovarian tissue of various groups (±s)
①P<0.01,与空白组比较;②P<0.05,③P<0.01,与模型组比较
组别空白组模型组补佳乐组加减益经汤高剂量组加减益经汤中剂量组加减益经汤低剂量组BMP-15 IOD值340 535.46±27 495.48 222 745.08±20 023.42①278 137.75±34 202.27②294 423.19±22 992.96③290 052.26±20 929.47③282 033.55±25 234.15②鼠数(只)10 10 10 10 10 10 AMH IOD值24 276.68±3 122.93 12 083.57±1 396.84①20 237.66±1 276.56③21 201.72±1 544.98③21 208.65±2 483.95③19 479.61±2 019.62③

图3 各组大鼠卵巢AMH阳性表达分布的比较(免疫组织化学法,×400)Figure 3 Comparison of the distribution of positive expression of AMH in rat ovarian tissue of various groups(by immunohistochemistry,×400)

图4 各组大鼠卵巢BMP-15阳性表达分布的比较(免疫组织化学法,×400)Figure 4 Comparison of the distribution of positive expression of BMP-15 in rat ovarian tissue of various groups(by immunohistochemistry,×400)
3 讨论
中医学将卵巢功能减退归属于“经水早断”“血枯”“不孕”等病证范畴。《傅青主女科》将其描述为“年未老而经水断”,采用益经汤治疗。张玉珍教授[9]认为本病病机为脾肾亏虚,肝郁血瘀,治法为补肾健脾、疏肝活血,采用加减归肾丸治疗。陶莉莉教授认为此病肾虚乃是根本,情志因素是诱发卵巢功能减退的重要病因,采用加减益经汤治疗[1-3]。加减益经汤是在益经汤的基础上加减化裁而来,方中:以熟地黄、菟丝子、党参为君,补肾健脾;以杜仲、丹参、北沙参为臣,补肾活血,补而不燥;当归、白芍为佐,补血柔肝;柴胡为使,疏肝气。全方配伍合理、简洁,肾、脾、肝、心、肺五脏同调,共奏补肾健脾,疏肝活血之功。前期临床研究发现,加减益经汤可改善肾虚肝郁证卵巢功能减退患者的临床症状,提高妊娠率,降低卵泡刺激素(FSH)、促黄体素(LH)水平,升高雌二醇(E2)含量[1-3];动物实验证实,加减益经汤可恢复环磷酰胺导致的卵巢功能减退大鼠的动情周期,改善各级卵泡数目,降低FSH、LH水平,升高E2含量,但机制尚不明确[1]。
卵巢衰老的机制是由多种生理及外界因素相互作用和逐渐积累的生物学现象,卵泡数目减少、卵泡质量降低是导致卵巢衰老从而引起生育问题以及绝经的关键原因。卵泡启动、生长发育、退化及甾体激素合成除受下丘脑-垂体-卵巢轴(HPOA)调节外,还受多种卵巢局部分泌的生长因子、细胞因子和激素等所构成的复杂调控网络调节[10]。近年来,许多研究表明,TGF-β超家族中的AMH、INHB、TGF-β1、BMP-15参与了卵巢生理和病理过程的调控,对卵泡的发育起着重要的调控作用[11]。因此,本研究从TGF-β超家族中对卵巢发育起重要作用的细胞因子与受体入手,以环磷酰胺诱导的卵巢功能减退模型大鼠为研究对象,观察卵巢功能减退大鼠TGF-β超家族中AMH、INHB、BMP-15、TGF-β1、TGF-β1R的变化以及高、中、低剂量加减益经汤干预的作用机制。
AMH主要由卵巢窦前卵泡及小的窦状卵泡的颗粒细胞分泌,它可以相对真实地反映原始卵泡库存量[1,12]。它的作用是维持原始卵泡持续处于静止状态,抑制其向初级卵泡的转化,可作为预测卵巢储备功能及促排卵过程中卵巢反应性的血清学标记物[13]。AMH作为评估卵巢储备功能的指标,对卵巢损伤的评估具有意义[14-15]。本研究结果显示,卵巢功能减退模型大鼠血清AMH与卵巢AMH的表达降低,经加减益经汤治疗后,卵巢功能减退大鼠血清与卵巢AMH的表达升高。表明加减益经汤可通过上调AMH的表达而促进卵泡发育,抑制卵泡过度闭锁,提高卵巢储备力。
INHB作为早期预测卵巢储备功能下降的指标,是诊断卵巢功能减退的敏感指标之一[16]。Yong等[17]发现,INHB的上升与卵巢颗粒细胞功能的恢复呈正相关,推测INHB可作为评估卵泡发育或预测卵母细胞恢复的标志物。研究发现,补肾中药可增加血清INHB水平,改善卵巢储备功能,抑制卵泡过度闭锁[18]。本研究结果显示,卵巢功能减退模型大鼠卵巢INHB分泌减少,经加减益经汤干预后,血清INHB分泌增加,且呈现出剂量依赖性,高、中剂量组明显,而补佳乐作用不大。表明加减益经汤可通过上调INHB的分泌而提高卵巢储备功能。
TGF-β1在原始卵泡的募集及原始卵泡池的维持方面起重要调控作用[19]。TGF-β1R是TGF-β1发挥作用的重要组成部分。有研究发现,卵巢功能减退和POF患者血清中TGF-β1的水平较正常人明显降低[20]。本研究结果显示,卵巢功能减退模型大鼠卵巢TGF-β1、TGF-β1R表达水平降低,经加减益经汤干预后,卵巢TGF-β1与TGF-β1R的表达水平升高。表明加减益经汤可通过上调卵巢TGF-β1、TGF-β1R的表达,促进卵泡的生长、发育。
BMP-15是X染色体上首个被证实的对维持卵巢储备及决定绝经年龄有着关键作用的剂量效应基因[21]。BMP-15对卵泡的早期发育极其重要,其基因突变可能是卵巢功能减退或POF发生、发展的机制之一[22]。本研究结果显示,卵巢功能减退模型大鼠卵巢BMP-15表达降低,经加减益经汤干预后,卵巢BMP-15的表达升高。表明加减益经汤可通过上调卵巢BMP-15的表达促进卵泡早期发育,从而提高卵巢储备功能。
综上所述,加减益经汤改善卵巢储备功能可能与调节卵巢TGF-β超家族成员AMH、INHB、BMP-15、TGF-β1、TGF-β1R的表达有关。

