香灰菌和毛韧革菌碳水化合物活性酶基因和次生代谢物合成基因的比较分析
薛治峰 张树竹 刘金涛 姬梦琳 田青霖 薛笑然 陈本佳 杨立凡 田霄


摘要香灰菌( Annulohypoxylonstygium)和毛韧革菌( Stereumhirsutum)分别是银耳和金耳的伴生菌,对银耳和金耳的栽培、品质和产量起着关键作用。本研究对香灰菌和毛韧革菌的基因组进行了碳水化合物活性酶(CAZymes)基因、细胞壁降解酶基因、次生代谢物相关基因注释和比较分析。结果发现:(1)香灰菌和毛韧革菌CAZymes基因数量分别为525和519,其中 GH、AA家族的基因数量最多;(2)香灰菌和毛韧革菌细胞壁降解酶数量分别为495和467,主要涉及纤维素、半纤维素、木质素、果胶、淀粉和菊粉降解相关酶类;(3)毛韧革菌纤维素酶和木质素酶编码基因数量多于香灰菌,而半纖维素酶编码基因数量少于香灰菌;(4)香灰菌和毛韧革菌次生代谢物合成相关基因数量分别为1458和547个,合成产物主要为萜类、聚酮类、非核糖体多肽合成酶类次生代谢物质。以上结果表明,香灰菌相较于毛韧革菌木质纤维素降解相关细胞壁降解酶数量更多,可能具有更强的木质纤维素降解能力,能够适应更多种类的木质纤维素基料,2种伴生菌对基质中木质纤维素成分具有一定偏好性。另外,香灰菌和毛韧革菌均能合成多种不同的次生代谢物,特别是香灰菌合成的次生代谢物种类明显多于毛韧革菌,可能增加了银耳和金耳的食药用价值。本研究挖掘了银耳和金耳伴生菌的营养吸收和食药用活性相关基因,为银耳和金耳的人工栽培和品质改良提供一定分子遗传基础。
关键词香灰菌;毛韧革菌;碳水化合物活性酶;细胞壁降解酶;次生代谢物合成相关基因
中图分类号 S567.34;Q933 文献标识码 A DOI:10.12008/j.issn.1009-2196.2021.12.016
Comparative Analysis of Genes Encoding Carbohydrate Active Enzyme and GenesRelated to Secondary Metabolite Synthesis in Annulohypoxylonstygium and Stereumhirsutum
XUE Zhifeng1) ZHANG Shuzhu1) LIU Jintao1) JI Menglin1) TIAN Qinglin1) XUE Xiaoran1) CHEN Benjia1) YANG Lifan1) TIAN Xiao2)
(1 College of Agriculture/Resource Plant Research Institute, Yunnan University, Kunming, Yunnan 650000, China;
2 Kunming Academy of Agricultural Sciences, Kunming, Yunnan 650000, China)
Abstract Annulohypoxylonstygium and Stereumhirsutum are companion fungi and play a key role in the cultivation, quality and yield of Tremella aurantialba and Tremella fuciformis. In order to explore the genetic basis of the environmental adaptability of the two fungi and provide theoretical basis for strain optimization and substrate improvement, carbohydrate active enzymes (CAZymes) genes, cell wall degrading enzyme genes (CWDEs), and secondary metabolite-related genes were annotated and comparatively analyzed on the genomes of A. stygium and S. hirsutum. The results showed that theCAZymes genes of A. stygium and S. hirsutum were 525 and 519 in number, respectively, of which the genes in the GH and AA family were the most. The CWDEs were 495 and 467, respectively, capable of degrading cellulose, hemicellulose, pectin, starch and inulin. The genes encoding cellulase and ligninase are more in S. hirsutum than in A. stygium, and the genes encoding hemicellulase is less in S. hirsutum than in A. stygium. The secondary metabolite synthesis genes of A. stygium and S. hirsutum were 1458 and 547, respectively. The synthesized products were mainly terpenes, polyketides, non-ribosomal polypeptide synthetase and other secondary metabolites. The above results indicate that A. stygium has a stronger carbon source utilization capacity than S. hirsutum, and can degrade the carbon source of the substrate more thoroughly. The two companion fungi have a certain preference for the content and type of lignocellulose. In addition, both A. stygium and S. hirsutum can synthesize a variety of different secondary metabolites. In particular, the types of secondary metabolites synthesized by A. stygium are significantly more than those of S. hirsutum, which increases the value of food and medicine of the fruiting bodies of T. aurantialba and T. fuciformis. This study has unearthed the genes related to nutrient absorption and edible and medicinal activity of the companion fungi, and provided a certain molecular genetic basis for the artificial cultivation and quality improvement of T. aurantialba and T. fuciformis. Keywords Annulohypoxylonstygium ; Stereumhirsutum ; CAZymes ; CWDEs ; secondary metabolite synthesis related gene
银耳 ( Tremella aurantialba) 和金耳( Tremella fuciformis)是银耳属( Tremella)的食药用真菌,具有很高的经济价值[1]。银耳或金耳的栽培基质主要以碳源(木质纤维素)为主,氮源、无机盐和维生素等物质含量较少[2-3]。单独的银耳或金耳菌丝不能在以木质纤维素为主的基质中形成子实体并完成其生活史,必须依靠香灰菌或毛韧革菌伴生进行营养物质交换和传递[4]。而香灰菌或毛韧革菌在伴生或单独存在的情况下均能在基质上正常生长,说明两者均具有强大的碳源利用能力,是银耳或金耳制种和栽培的重要影响因素[5]。大型真菌利用次生代谢响应外界环境变化,且部分次生代谢物具有抗菌、抗癌、抗氧化,以及治疗糖尿病等药理活性[6]。研究表明,香灰菌的代谢产物对银耳菌丝的稳定生长具有重要的促进作用[7]。香灰菌和毛韧革菌基因组序列的公布[8-9],为探究2种伴生菌营养吸收、次生代谢产物生物合成途径,以及伴生菌与银耳或金耳的共生机制和环境适应性提供新的方向。
碳水化合物活性酶( carbonhydrate-active enzymes,CAZymes)是真菌吸收碳源营养和适应环境的重要工具,CAZymes的种类及数量与真菌的营养偏好性和生活方式密切相关[10]。CAZymes根据催化活性分为辅助活性(auxiliary activities,AA)、碳水化合物结合域(carbohydrate-binding modules,CBM)、碳水化合物酯酶( carbohydrate esterases, CE)、糖苷水解酶 (glycoside hy‐drolases, GH)、糖基轉移酶(glycosyl trans ‐ferases, GT)和多糖裂解酶(polysaccharide lyases, PL)家族[11]。寄生或共生真菌分泌的细胞壁降解酶 (cell wall degrading enzymes, CWDEs)属于CAZymes,能够帮助真菌分解植物细胞壁,释放小分子碳水化合物供其生长[12]。目前基因组进化研究表明,食药用菌木质纤维素相关降解酶系的多样性与其生态类型具有显著关联性,食药用菌基因组中木质纤维素降解相关酶数量呈现以下规律:草腐真菌>白腐真菌>褐腐真菌>共生营养真菌[13],然而香灰菌和毛韧革菌目前尚未有 CWDEs 基因数量和种类的全基因组分析。因此,明确毛韧革菌和香灰菌的CAZymes和 CWDEs 编码基因种类,从基因组水平理解2种伴生菌碳源环境适应性的遗传基础,可为银耳和金耳菌种优化和基质改良提供理论依据。
食药用菌产生的次生代谢产物是农业、食品、医药、香料等产业天然产物的理想来源,具有结构新颖、活性多样的特点,包括萜类、甾体、类固醇、酚酸、脂肪酸、聚炔烃等[14]。真菌次生代谢产物主要是由聚酮合成酶(polyketide syn ‐thase, PKS)和非核糖体多肽合成酶(nonribo‐somal peptide synthetase, NRPS),以及氢化酶、氧化酶和转运蛋白等共同调控合成[15]。然而目前银耳和金耳及其伴生菌的次生代谢物研究还尚少,通过基因组挖掘香灰菌和毛韧革菌次生代谢产物的种类及其生物合成途径,可为探究金耳和银耳菌丝复合体的药理活性和化学防御机制提供新思路,也可为银耳和金耳的发酵加工和产品研制提供参考。
本研究通过香灰菌和毛韧革菌基因组数据挖掘和比较分析,明确香灰菌和毛韧革菌CAZymes、 CWDEs 和次生代谢物合成相关基因的种类和组成,为银耳和金耳的栽培条件改良和活性物质发酵条件优化提供遗传基础。
1材料与方法
1.1材料
香灰菌和毛韧革菌的基因组数据由美国国家生物信息中心 (The National Center for Bio ‐ technology Information, NCBI)数据库下载。香灰菌基因组大小为38.68 Mbp, Contig N50为713963 bp,基因数为11880,基因组 ID 为 PRJ ‐ NA454572。毛韧革菌基因组大小为46.51 Mbp, Contig N50为245271 bp,基因数为14072,基因组 ID 为 PRJNA52843。随后利用GeneMark-ES 软件对基因组序列进行基因预测,得到对应基因组gtf、cds和 pep文件[13]。
1.2方法
1.2.1 CAZymes注释
利用 Carbohydrate-Active enZYmes Database (CAZy) 数据库[16] 和 Database for automated carbohydrate active enzyme annotation (dbCAN)注释工具(https://bcb. unl. edu/dbCAN2/)[17] 对香灰菌和毛韧革菌的基因组进行CAZymes比对和注释,采用 HMMER 方法,参数为 E-Value<1e-15, coverage>0.35。
1.2.2细胞壁降解酶分析方法
根据CAZymes-based ranking of fungi ( CBRF)网站[18] 对细胞壁降解酶的分类标准,将纤维素酶、半纤维素酶、果胶酶、木质素酶、淀粉酶和菊粉酶所在的CAZymes家族,结合dbCAN注释信息,对香灰菌和毛韧革菌细胞壁降解酶进行分析和统计。
1.2.3次生代谢产物合成基因的预测
利用微生物次级代谢物合成基因簇注释数据库antiSMASH 5.0(https://antismash.second‐ arymetabolites.org)对香灰菌和毛韧革菌次生代谢物合成基因簇进行注释。选择 Known Cluster Blast、Cluster Blast、SubCluster Blast、Ac ‐tive Site Finder、MIBiG cluster comparison、RREFinder、Cluster Pfam分析和Pfam-based GO注释,均采用默认参数。
1.2.4统计学分析
使用 Excel 2020和 GraphPad Prism 9.0统计数据并绘制相关图表。
2结果与分析
2.1 CAZymes基因的注释和分析
结合CAZy数据库和dbCAN工具的注释,香灰菌CAZymes基因数量为525个,占全基因组基因总数的4.42%。香灰菌CAZymes基因分属于116个亚家族,包括144个 AA、3个 CBM、39个 CE、243个 GH、85个 GT和11个 PL基因,分属于14个 AA、2个 CBM、10个 CE、57个 GH、28个 GT 和5个 PL 亚家族(图1-A)。毛韧革菌CAZymes基因数量为519个,占全基因组基因总数的3.69%。毛韧革菌CAZymes基因分属于116个亚家族,包括126个 AA、1个 CBM、30个 CE、275个 GH、68个 GT和19个 PL基因,分属于11个 AA、1个 CBM、10个 CE、58个 GH、29个 GT 和7个 PL 亚家族(图1-A)。2种伴生菌 CA ‐ Zymes家族根据基因种类从多到少排列均为 GH>GT > AA>CE>PL>CBM;基因数量从高到低排列均为 GH>AA>GT>CE>PL>CBM (图1-B)。香灰菌和毛韧革菌 GH 家族基因数量分别占CAZymes基因总数的46.3%和53.0%(图1-B),其中香灰菌 GH3亚家族基因数量最多,而毛韧革菌 GH16亚家族基因数量最多。香灰菌和毛韧革菌 AA 家族基因数量分别占CAZymes基因总数的27.4%和24.2%(图1-B),其中香灰菌 AA7亚家族基因数量最多,而毛韧革菌 AA3亚家族基因数量最多。
对2种伴生菌CAZymes基因比较分析发现,香灰菌 AA、CBM 家族的基因种类和数量多于毛韧革菌,而毛韧革菌 GH 和 PL 家族的基因种类和数量多于香灰菌(图1)。香灰菌 CE 家族种类与毛韧革菌相同,但基因数量多于毛韧革菌(图1)。毛韧革菌 GT 家族种类少于香灰菌,但基因数量多于香灰菌(图1)。香灰菌和毛韧革菌具有不同的CAZymes家族基因,香灰菌特有CAZymes家族基因来源于 AA11、 AA12、 AA13、 CBM67、 CE3、 GH25、 GH36、 GH45、 GH54、 GH64、 GH67、 GH94、 GH132、 GT34、 GT62、GT109、PL3、PL20亚家族;毛韧革菌特有CAZymes家族基因来源于 GH9、GH12、GH23、GH27、 GH44、 GH85、 GH88、 GH109、 GH135、 GH140、 GH152、GT28、GT48、GT49、PL8、PL14、PL35和 PL38亚家族。另外,2种伴生菌CAZymes基因数量在 AA1、AA7、AA9、CE1、CE5、CE16、GT1、GH2、 GH16、GH28、GH43和 GH76亚家族中存在较大差异(图1-A)。以上结果说明,香灰菌和毛韧革菌对碳源利用主要依靠 GH 和 AA 家族基因,并且2种伴生菌对碳源的利用能力存在一定差异。
2.2 CWDEs 基因的预测
对 CWDEs 的降解底物和所属CAZymes家族分析
发现,香灰菌共有495个 CWDE基因,包括36种 CWDEs,分属于30个 GH、11个 AA、8个 CE、4个 PL、1个 CBM 和1个 GT家族(表1)。毛韧革菌共有467个 CWDE基因,包括35种 CWDEs,分属于30个 GH家族、9个 AA 家族、7个 CE家族、3个 PL家族、1个 CBM 家族和1个 GT 家族(表1)。香灰菌 CWDEs 数量由高到低均为半纤维素酶>纤维素酶>木质素酶>果胶酶>淀粉酶>菊粉酶;毛韧革菌 CWDEs 数量由高到低均为纤维素酶>半纤维素酶>木质素酶>果胶酶>淀粉酶>菊粉酶(图2)。毛韧革菌纤维素酶和木质素酶数量明显多于香灰菌,而半纤维素酶明显少于香灰菌。2种伴生菌在果胶酶、淀粉酶和菊粉酶编码基因数量上无明显差异(图2)。以上结果说明,香灰菌或毛韧革菌 CWDEs 以纤维素、半纤维素、木质素为主,同时也具有一定数量的果胶酶,以及少量淀粉酶和菊粉酶,因此,2 种伴生菌除了可以利用木质纤维素外,还可以利用果胶和淀粉成分。香灰菌 CWDEs 基因数量多于毛韧革菌,且木质纤维素 CWDEs 基因数量多于毛韧革菌,说明香灰菌相较于毛韧革菌可能具有较强的木质纤维素降解能力,能够对适应更多种类的木质纤维素。另外,毛韧革菌纤维素酶和木质素酶的数量多于香灰菌,香灰菌半纤维素酶的数量多于毛韧革菌,说明香灰菌和毛韧革菌对木质纤维素成分具有一定偏好性,推测香灰菌偏好半纤维素含量丰富的栽培基料,而毛韧革菌偏好纤维素和木质素含量丰富的栽培基料。
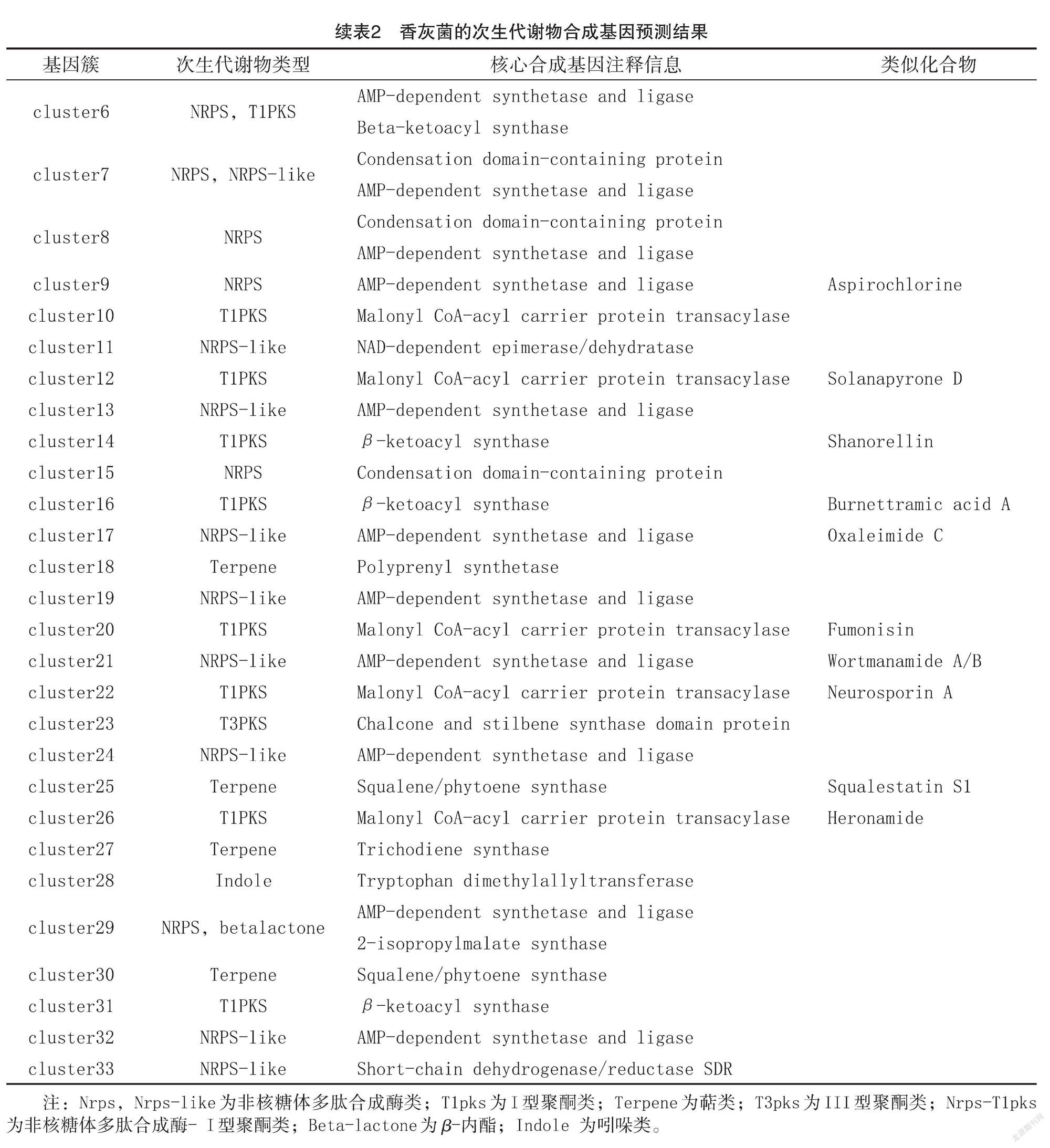
2.3次生代谢物合成基因的注释和分析
通过antiSMASH数据库注释,香灰菌共鉴定出1458个次生代谢物合成相关基因(图3),占全基因组基因总数的12.3%,可分类到33个次生代谢产物合成基因簇(表2),合成产物为14种非核糖体多肽合成酶(Nrps,Nrps-like)、11种 I型聚酮类( T1pks)、4种萜类(Terpene)、1种 III 型聚酮类( T3pks)、1种非核糖体多肽合成酶- I 型聚酮类(Nrps-T1pks)、1种β-内酯( Beta-lactone)和1种吲哚(Indole)。其中,聚酮类次生代谢产物类似化合物为甜菜酮 ( Betaenone)、安卡黄素(Ankaflavin)、红曲霉素(monasci)、茄吡酮(Solanapyrone)、Shanorellin、Burnettramic acid A、伏马菌素( Fumonisin)、神经孢菌素 A (Neurosporin A)、Heronamide;非核糖体多肽合成酶类次生代谢产物类似化合物为Dimethylcoprogen、Aspirochlorine、Oxaleimide C、Wort ‐manamide;萜類次生代谢产物类似化合物为角鲨烯素 S1(Squalestatin S1)。毛韧革菌共鉴定出547个次生代谢物合成相关基因(图3),占全基因组基因总数的3.89%,可分类到12个次生代谢产物合成基因簇(表3),合成产物为6种萜类( Ter ‐pene)、2种 I 型聚酮类( T1pks)、2种非核糖体多肽合成酶 (Nrps-like)、1种铁载体 (Sidero‐phore)和1种反式酰基转移酶结构域聚酮化合物合酶( TransAT-PKS)。其中 T1PKS类次生代谢产物类似化合物为镰刀菌酸 ( Fusarin)和黑色素(Melanin)。上述结果表明,香灰菌合成的次生代谢物种类明显多于毛韧革菌,说明银耳的伴生菌对其菌丝子实体的食药用价值可能更加重要。
3讨论与结论
银耳和金耳人工栽培的产量和品质形成的关键影响因素是其对基质原料的利用能力大小[19-20],2种食用菌的段木栽培和袋料栽培基质主料都是以木质纤维素为主。单一型的银耳和金耳没有分解纤维素、半纤维素和木质素的能力,必须依靠与亲和性的伴生菌混合培养才能正常出菇[4]。因此,香灰菌或毛韧革菌基因组中CAZymes的种类和组成在一定程度上能反映出银耳或金耳对培养基质中各种组分的利用规律。本研究发现,香灰菌和毛韧革菌CAZymes基因数量相近,其中 GH 和 AA 家族的CAZymes基因数量最多。这与猪块菌(Choiro‐myces venosus)、普通羊肚菌(Morchella coni ‐ ca)、灰拟鬼伞(Coprinopsis cinerea)等食药用菌基因组分析结果相似[13]。目前已知食药用菌基因组中至少26个 GHs亚家族的CAZymes基因可以参与植物木质纤维素的降解,而 AA 亚家族在已知的食药用菌基因组中也广泛存在,参与木质素和相关芳香化合物的降解和转化[21]。
本研究发现,香灰菌和毛韧革菌的 CWDEs 主要以纤维素酶、半纤维素酶和木质素酶为主。木质纤维素降解相关 CWDEs 由21种酶类组成,其中内切-β-1,4-葡聚糖酶、β-葡萄糖苷酶、纤维二糖脱氢酶、内切-β-1,4-木聚糖酶、乙酰木聚糖酯酶、漆酶、芳醇氧化酶、多糖单加氧酶的数量较多。香灰菌或毛韧革菌还具有一定数量的果胶酶和少量淀粉酶,说明2种伴生菌还可利用植物细胞壁中胶层和细胞内淀粉。目前在伴生菌与银耳或金耳混合培养研究中可检测到纤维素酶、半纤维素酶、木质素酶、木聚糖酶、漆酶、淀粉酶、果胶酶和蛋白酶等一系列胞外酶的表达[22-23],说明木质纤维素降解成为小分子糖的过程复杂,需要这一系列酶的协同作用。
人工栽培中银耳相较于金耳生长更加稳定,栽培技术更加成熟[24]。出菇不整齐、生物转化率低是金耳袋料栽培的主要问题,严重影响金耳袋料栽培的推广和规模化生产[25]。本研究发现,香灰菌木质纤维素降解相关的 CWDEs数量多于毛韧革菌,说明香灰菌的木质纤维素利用效率更高,且能适应多种木质纤维素。已有研究表明,银耳除了可以利用常规的木屑、棉籽壳,还能利用油菜秸秆、玉米秸秆、菌草等多种栽培主料[26-29]。而金耳栽培主料目前以木屑、棉籽壳和玉米芯为主[30]。本研究还发现,香灰菌半纤维素酶的编码基因数量更多,而毛韧革菌纤维素酶和木质素酶的编码基因数量更多,说明香灰菌和毛韧革菌对木质纤维素的偏好性有一定差异。已有研究表明,基质中木质纤维素组成、结构和各成分的比例不同,直接影响银耳和金耳子实体形成的快慢、产量和质地,最终影响其营养成分和风味特征[19, 31]。不同纤维素含量培养料也会造成平菇营养成分的显著差异[32]。因此,银耳和金耳在袋料栽培基质配方优化时,应注意木质纤维素的组成和含量,可考虑银耳选用富含半纤维素的主料,而金耳选用富含纤维素和木质素的主料。
目前银耳和金耳的食药用研究主要集中在多糖物质[33-34],伴生菌对银耳或金耳的药用活性价值,特别是其次生代谢物活性和应用的研究还较少。本研究发现,香灰菌和毛韧革菌基因组中含有多种次生代谢产物合成基因簇,其产物主要属于非核糖体多肽合成酶类、萜类和聚酮类。非核糖体肽合成酶合成的非核糖体肽是抗生素、免疫抑制剂的重要化合物来源,具有抗菌、杀虫、抗胆固醇和抗癌等活性[35]。萜类化合物是由异戊二烯单位组成的碳氢化合物,大型真菌中分离的单萜、倍半萜、二萜和三萜类化合物具有抗肿瘤、抗菌、抗炎、抗氧化、降血糖等药理活性[36]。聚酮类化合物是由聚酮合酶催化合成的天然产物,具有抗氧化、抗肿瘤、免疫抑制、抗菌活性、抗炎症和抗寄生虫等生物活性[37]。
香灰菌和毛韧革菌合成次生代谢产物种类具有明显差异,说明2种伴生菌的生物活性和药理成分具有一定区别;同时,香灰菌合成的次生代谢产物数量多于毛韧革菌,说明香灰菌对银耳生物活性和药理价值的贡献高于毛韧革菌对金耳。根据已鉴定出的次生代谢物类型和类似的化合物生物活性,可将2种伴生菌次生代谢物的功能分为以下4类:(1)响应环境变化的化学防御物质。香灰菌能够合成Dimethylcoprogen和神经孢菌素 A (Neurosporin A)。Dimethylcoprogen属于异羟肟酸盐类铁载体,能够帮助真菌竞争环境中的铁元素[38];神经孢菌素 A (Neurosporin A)在粗糙脉孢菌中可以调控食真菌动物的食物偏好性[39]。毛韧革菌能够合成黑色素 (Melanin)。黑色素(Melanin)在真菌细胞壁中的积累,可以保护菌体免受紫外线等环境压力的影响[40]。明确伴生菌次生代谢物对银耳或金耳的环境适应性作用,能够为伴生菌与银耳属食用菌互作研究提供新思路。(2)食药用活性物质。香灰菌能够合成安卡黄素(Ankaflavin)、红曲霉素(monasci)、Aspiro‐ chlorine、Burnettramic acid A、角鲨烯素 S1(Squalestatin S1)、β-内酯( Beta-lactone)和吲哚(Indole)。安卡黃素(Ankaflavin)和红曲霉素(monasci)是曲霉属真菌产生的天然聚酮类化合物色素,具有抗菌、抗真菌、抗病毒、抗氧化、细胞毒性、杀线虫和抗炎活性等效用[41];Aspirochlorine是曲霉中发现的一种高选择性和高活力的真菌蛋白质合成抑制物质[42]; Bur ‐nettramic acid A是在曲霉属中发现的一类新型抗生素,具有抗菌、抗真菌、抗病毒等活性[43];角鲨烯素 S1(Squalestatin S1)是一种新型萜烯类化合物,具有治疗高胆固醇和广谱抗真菌的特性[44];吲哚及其衍生物具有抗癌,降血压等功效[45];β-内酯中的β-丙内酯可作为血浆、疫苗的杀菌消毒剂[46]。毛韧革菌能够合成 Trans-AT 聚酮化合物,Trans-AT 聚酮化合物目前主要作为抗生素进行医学应用[47]。(3)植物病原真菌毒素。香灰菌能够合成甜菜酮( Betaenone)、茄吡酮(Solanapyrone)和伏马菌素( Fumonisin)。甜菜酮是从甜菜茎点霉菌( Phomabetae)中分离出来的一种植物毒素,可导致甜菜枯萎[48];伏马菌素( Fumonisin)是从定殖于小麦、玉米等谷物作物中的镰刀菌属( Fusarium sp.)中分离的一种聚酮类真菌毒素,对哺乳动物具有急性毒性和致癌性[49];茄吡酮(Solanapyrone)是多种植物病原真菌的致病因子,能够选择性抑制哺乳动物 DNA 聚合酶活性[50]。毛韧革菌可形成镰刀菌酸( Fusa‐rin),该毒素是镰刀菌属产生的一种非寄主选择性聚酮类毒素,能够破坏植物细胞的代谢机能,还对哺乳动物具有致癌性[51]。在进行银耳或金耳活性成分发酵研究时,需考虑降低对人体具有潜在危害的次生代谢产物含量,优化相关发酵条件,保证食品安全。(4)未知功能。香灰菌和毛韧革菌基因组还有大部分的未知功能次生代谢物合成基因簇,其合成产物具体类型和功能目前还无法与已有的食药用菌次生代谢产物的生物活性研究结果进行匹配。例如毛韧革菌目前已分离出112种次生代谢产物,包括倍半萜类、甾醇类、苯甲酸酯类、苯丙氨酸衍生物以及一些杂环化合物等,但这些代谢产物生物合成途径的研究较少[52]。因此本研究对香灰菌和毛韧革菌的次生代谢物合成相关基因簇的分析,有望为理解香灰菌和毛韧革菌的生物活性物质合成机制和挖掘新型生物活性物质提供依据。
本研究通过挖掘香灰菌和毛韧革菌基因组,对2种伴生菌CAZymes、CWDEs 和次生代谢物合成基因进行了比较分析,明确了2种伴生菌对银耳和金耳营养吸收及食药用活性相关分子遗传基础,为伴生菌与2种食用菌互作机制研究提供了参考。
参考文献
[1]李曦,邓兰,周娅,等.金耳、银耳与木耳的营养成分比较[J].食品研究与开发, 2021, 42(16):77-82.
[2]上官端琳,龚凤萍,竹玮,等.我国银耳段木栽培技术研究现状[J].食用菌, 2020, 42(2): 1-3.
[3]唐松明,何俊,张小雷,等.金耳栽培技术研究进展[J].中国食用菌, 2018, 37(4): 1-4.
[4]田云霞,童江云,汪威,等.银耳属伴生现象研究进展[J].食用菌, 2019, 41(4): 1-3.
[5]林辉,赖淑芳,郑珠霜,等.香灰菌与银耳混合培养过程中酶系的相互作用[J].中国食用菌, 2015,34(4): 57-61.
[6]刘文.微生物次生代谢产物的生物合成[J].微生物学通报, 2021, 48(7): 2295-2297.
[7]陈明,汪国莲,陈立国.香灰菌浸出液对银耳菌丝体生长的影响[J].食用菌, 2000(4): 10-11.
[8] Huiying Li,Surui Wu , Xiao Ma, et al. The Ge ‐nome Sequences of 90 Mushrooms [J]. Scientific Reports, 2018, 8(1): 9982.
[9] FloudasDimitrios, Binder Manfred , Riley Rob ‐ert, et al. The Paleozoic origin of enzymatic lignin decomposition reconstructed from 31 fun ‐ gal genomes [J]. Science, 2012, 336(6089):1715-1719.
[10] Andrade Ana Camila, Fróes Adriana , Lopes Fabyano?lvares Cardoso, et al. Diversity of Microbial Carbohydrate-Active enZYmes ( CA ‐ZYmes) Associated with Freshwater and Soil Samples from Caatinga Biome [J]. Microbial Ecology, 2017, 74(1): 89-105.
[11] Park Young-Jin, Kong Won-Sik. Genome-Wide Comparison of Carbohydrate-Active Enzymes ( CA ‐ Zymes) Repertoire of Flammulinaononidis [J]. Mycobiology, 2018, 46(4): 349-360.
[12] Hématy Kian ,Cherk Candice , Somerville Shau‐na . Host-pathogen warfare at the plant cell wall [J]. Current Opinion in Plant Biology, 2009,12(4): 406-413.
[13]吳冰,章小灵,崔宝凯,等.食 (药)用真菌比较基因组分析揭示其生态特性 [J].菌物学报,2015, 34(4): 742-760.
[14] Khan Abid Ali, Bacha Nafees , Ahmad Bashir , et al. Fungi as chemical industries and genetic engineering for the production of biologically active secondary metabolites [J].Asian Pacific Journal of Tropical Biomedicine, 2014, 4(11): 859-870.
[15] Keller Nancy P. Metabolic Pathway Gene Clusters in Filamentous Fungi [J]. Fungal Genetics & Biology, 1997, 21(1): 17-29.
[16] Lombard Vincent ,GolacondaRamuluHemalatha,Drula Elodie , et al. The carbohydrate-active enzymes database (CAZy) in 2013[J]. Nucleic Acids Research, 2014, 42: 490-495.
[17] Han Zhang,Yohe Tanner , Le Huang, et al. db‐ CAN2: a meta server for automated carbohydrate- active enzyme annotation [J]. Nucleic Acids Research, 2018,46( W1): W95-W101.
[18] KameshwarAyyappa Kumar Sista, Ramos Luiz Pereira,Wensheng Qin. CAZymes-based ranking of fungi ( CBRF): an interactive web database for identifying fungi with extrinsic plant bio ‐ mass degrading abilities [J]. Bioresources and Bioprocessing, 2019, 6(1): 1-10.
[19]王泽辉,林占熺,马运龙,等.鲜菌草工厂化栽培银耳的营养成分分析与评价 [J].中国食用菌,2020, 39(12): 73-77.
[20]游金坤,伍娟霞,邓雅元,等.金耳椴木栽培与代料栽培营养成分与风味特征分析比较[J].中国食用菌, 2020, 39(11): 89-94+100.
[21] Levasseur Anthony ,Drula Elodie , Lombard Vincent , et al. Expansion of the enzymatic repertoire of the CAZy database to integrate auxiliary redox enzymes [J]. BiotechnolBiofu‐els, 2013, 6(1): 41.
[22]林辉,赖淑芳,郑珠霜,等.香灰菌与银耳混合培养过程中酶系的相互作用[J].中国食用菌,2015, 34(4): 57-61.
[23]杨学英,赵芳娟,邓百万,等.金耳胞外酶代谢研究[J].食品研究与开发, 2021, 42(10):165-170.
[24]方白玉,傅晓仪,陈旭鹏,等.粤北地区金耳栽培与银耳栽培的比较研究 [J].韶关学院学报,2015, 36(12): 32-34.
[25]杨学英.金耳液体制种及袋料栽培技术研究[ D].汉中:陕西理工大学, 2021.
[26]孙治民,蒋学杰.银耳代料栽培技术[J].特种经济动植物, 2021, 24(3): 43-44.
[27]刘延岭,邓林,陶瑞霄,等.油菜秸秆基料对银耳产量和活性成分的影响 [J].食品研究与开发,2020, 41(9): 56-60.
[28]张紫华,王长文,林辉,等.玉米芯部分替代棉籽壳栽培银耳最佳配方的筛选[J].贵州农业科学,2018, 46(3): 81-84.
[29]项丽娟,黄玉琴,林占熺,等.温室菌草袋栽银耳产量及其品质的研究 [J].西南农业学报,2015, 28(1): 339-343.
[30]田果廷,陳卫民,苏开美,等.金耳代料栽培技术研究[J].食用菌学报, 2012, 19(1): 43-46.
[31]李翔,徐宏,邓杰,等.不同栽培方法银耳挥发性成分的 HS-SPME/GC-MS 分析[J].中国食用菌,2019, 38(1): 45-50+63.
[32]江云涛.不同纤维素含量培养料对平菇营养成分的影响分析 [J].武汉轻工大学学报, 2020, 39(2): 22-26+34.
[33]高磊,张帆,王毅飞,等.银耳多糖研究进展[J].安徽农业科学, 2020, 48(24): 13-16+19.
[34]杨林雷,李荣春,曹瑶,等.金耳及金耳多糖的药用保健功效及其机理研究进展[J].食药用菌,2021, 29(3): 176-182.
[35]魏小雅,刘欣,于宏伟,等.微生物非核糖体多肽的合成基因簇挖掘及其合成研究进展[J].中国抗生素杂志, 2021, 46(5): 353-361.
[36]李兆坤,王凤寰,陈彬,等.大型真菌萜类化合物活性研究进展 [J].天然产物研究与开发,2017, 29(2): 357-369.
[37]庞子萱,吴季恒,严豪,等.聚酮类化合物研究进展[J/OL].食品与发酵工业: 1-13[2021-11-13].https://doi.org/10.13995/j.cnki.11-1802/ ts.028069.
[38] LiHung Chen, Ching-Hsuan Lin,Kuang-Ren Chung . A nonribosomal peptide synthetase medi‐ates siderophore production and virulence in the citrus fungal pathogen Alternaria alternata [J]. Molecular plant pathology, 2013, 14(5): 497-505.
[39] Yanxia Zhao,Jianing Ding,Weihua Yuan, et al. Production of a fungal furocoumarin by a polyketide synthase gene cluster confers the chemo-resistance of Neurospora crassa to the predation by fungivorous arthropods [J]. Envi ‐ronmental Microbiology,2017, 19(10): 3920-3929.
[40] Kihara Junichi ,Moriwaki Akihiro , Tanaka No ‐zomi, et al. Characterization of the BMR1 genee ncoding a transcription factor for melanin biosynthesis genes in the phytopathogenic fun ‐gusBipolarisoryzae [J]. FEMS microbiology letters,2008, 281(2): 221-227.
[41] Balakrishnan Bijinu, Karki Suman , Shih-Hau Chiu , et al. Genetic localization and in vivo characterization of a Monascusazaphilone pig ‐ment biosynthetic gene cluster [J]. Applied Microbiology and Biotechnology, 2013, 97(14): 6337-6345.
[42] ChankhamjonPranatchareeya,Boettger-Schmidt Daniela ,Scherlach Kirstin , et al. Biosyn‐ thesis of the halogenated mycotoxin aspirochlo‐rine in koji mold involves a cryptic amino acid conversion [J]. AngewandteChemie, 2014, 53(49): 13409-13413.
[43] Hang Li, Gilchrist Cameron L M, Lacey Heather J, et al. Discovery and Heterologous Biosyn‐ thesis of the Burnettramic Acids: Rare PKS- NRPS-Derived BolaamphiphilicPyrrolizidinedio‐nes from an Australian Fungus, Aspergillus burnettii [J]. Organic Letters.2019, 21(5): 1287-1291.
[44] BonschBeate, Belt Verena ,Bartel Chris ‐ toph , et al. Identification of genes encoding squalestatin S1 biosynthesis and in vitro pro ‐ duction of new squalestatin analogues [J]. Chemical Communications,2016, 52(41): 6777-6780.
[45]于瀟,祝琳琳,刘婕,等.钩藤中单萜吲哚类生物碱成分及其药理活性的研究进展 [J].中草药,2021,52(19):6052-6065..
[46]姜立民,林晓波,高磊,等.β-丙内酯对狂犬病病毒的灭活效果[J].国际流行病学传染病学杂志,2014, 41(2): 137-139.
[47]南春利,薛永常.顺式和反式-AT 型聚酮合酶研究进展及应用[J/OL].微生物学通报: 1-11[2021-11-29]. https://doi. org/10.13344/j. microbiol. china.210178.
[48] Ugai Takahiro , Minami Atsushi ,FujiiRyuya, et al. Heterologous expression of highly reducing polyketide synthase involved in betaenone biosynthesis [J]. Chemical Communi ‐ cations,2015, 51(10): 1878-1881
[49] Cendoya Eugenia , Nichea Maria J, Monge MaríaP, et al. Fumonisin occurrence in wheat-based products from Argentina [J]. Food additives & contaminants,2019, 12(1): 31-37.
[50] Mizushina Yoshiyuki ,Kamisuki Shinji , Kasai Nobuyuki , et al. A plant phytotoxin,solana‐ pyrone A, is an inhibitor of DNA polymerase be ‐ ta and lambda [J]. The Journal of Biological Chemistry, 2002, 277(1): 630-638.
[51] Thiel Pieter G,Gelderblom Wentzel C,Marasas Walter F O, et al. Natural occurrence of monil‐iformin and fusarin C in corn screenings known to be hepatocarcinogenic in rats [J]. Journal of Agricultural and Food Chemistry, 1987, 34(5): 773-775.
[52]类成智,韩海燕,刘成伟,等.毛韧革菌次生代谢产物研究进展[J/OL].菌物学报, 2021,40(8):1918-1937.DOI:10.13346/j.mycosystema.210136.
(编辑排版:龙娅丽)

