具有生防潜力的枯草芽孢杆菌KC-1 培养基及培养条件的优化
王晴,朱成诚,王欣悦,文雪,王文中,马超,马爽,王彦杰
(1.黑龙江八一农垦大学生命科学技术学院/寒区环境微生物与农业废弃物资源化利用重点实验室,大庆 163319;2.黑龙江省农业科学院克山分院)
植物病害是影响农业生产的主要因素之一,如由多种真菌引起的穗脏病(Dirtypanicle disease(DPD))导致水稻产量和品质严重损失[1];水稻稻瘟病、白叶枯病和纹枯病更是严重影响着水稻的高产稳产[2]。目前植物病害的防治主要是化学试剂防治、生物防治以及水肥控制等田间管理的防治方法[3-4]。其中生防菌[5]的研究成为热点研究方向之一。近年来,国内外学者已经筛选了不同种类的细菌、放线菌、真菌用于植物病害的防治[6-7]。芽孢杆菌(Bacillus)作为一种理想的植物病害生防微生物,其在控制病害,提高作物产量等方面表现出了显著的应用前景[8-9]。枯草芽孢杆菌(Bacillus subtilis)是重要的生防菌之一[10],它是一种嗜温好氧、产芽孢的杆状细菌,具有生长快、芽孢抗逆性强等特点[11]。王红丽等[12]将枯草芽孢杆菌(Bacillus subtilis GLB191)和短小芽孢杆菌(Bacillus pumilus GLB197)生防菌株单独或混合接种,结果表明混合生防菌在田间防效试验中对葡萄灰霉病有很好的防治效果,与化学药剂无显著差异,防效可达到70.02%。枯草芽孢杆菌的有效菌数是枯草芽孢杆菌发挥作用的前提,也是进行扩大培养工业发酵的重要指标。通过优化其培养基和培养条件能够有效提高该菌株的活菌数[13],叶碧霞等[14]优化培养基及培养条件后的芽孢杆菌数目达到1.03×1010CFU·mL-1;饶犇等[15]通过Plackett-Burman 试验、最陡爬坡试验、中心组合设计和响应面分析对枯草芽孢杆菌进行优化培养,优化后比未优化的芽孢数目提高了37%;刘宽博等[16]采用单因素试验与正交试验法对枯草芽孢杆菌C3 增菌培养条件进行优化,结果表明优化后活菌数可达到7.1×1010CFU·mL-1,比优化前提高了7.89 倍。
实验前期分离筛选得到一株枯草芽孢杆菌KC-1,对病原菌进行拮抗试验[17]发现该菌种对禾谷镰刀菌(Fusarium graminearum)、镰孢菌(Fusarium spp)、玉米链格孢(Maize Alternaria tenuis Nees)、稻梨孢(Piricularia oryzae)和尖孢镰刀菌(Fusarium oxysporum)具有良好的拮抗作用,是一株具有开发潜力的枯草芽孢杆菌。在前期研究的基础上,通过单因素试验与正交试验结合,对枯草芽孢杆菌KC-1 培养条件及培养基组分进行优化,获得最优的培养基及最佳培养条件,提高KC-1 有效活菌数,为该菌后续的研究和开发应用提供理论参考。
1 材料与方法
1.1 供试材料
1.1.1 供试菌种
枯草芽孢杆菌KC-1 菌种由黑龙江八一农垦大学生命科学技术学院寒区环境微生物与农业废弃物资源化利用重点实验室提供。
1.1.2 培养基
NB 培养基[18]:牛肉膏0.5%、蛋白胨1.0%、氯化钠0.5%、葡萄糖1.0%、pH 值(7.2~7.5);
营养琼脂培养基:牛肉膏0.3%、蛋白胨1.0%、氯化钠0.5%、琼脂2.0%、蒸馏水1 000 mL、pH(7.2~7.4)。
1.2 试验方法
1.2.1 菌种活化和接种物的制备
将KC-1 接种于营养琼脂培养基中,置于恒温培养箱37 ℃培养1~2 d。挑取营养琼脂培养基上生长良好的单菌落接种至液体牛肉膏蛋白胨培养基中,置于37 ℃,180 r·min-1恒温摇床上振荡培养24 h 后,置于4 ℃冰箱作为接种物备用。
1.2.2 培养时间对菌体生长的影响
按照1.3.2 测定生长曲线。
1.2.3 培养基
成分和浓度的优化试验:
(1)碳源种类及浓度对KC-1 生长量的影响
分别选用0.5%的葡萄糖、D-果糖、蔗糖、乳糖和可溶性淀粉为碳源,其他成分及添加量与NB 培养基相同,每种碳源设置3 个重复处理,培养条件为pH 值7.2,4%的接种量接种至培养基,置于37 ℃,180 r·min-1转速摇床上培养12 h,平板菌落计数法测定其活菌数[19]。
在筛选获得的最佳碳源基础上,设置1.0%、2.0%、3.0%、4.0%和5.0% 5 个梯度浓度,其他成分及添加量不变,每种浓度设置3 个重复处理,培养条件为pH 值7.2,4%的接种量接种至培养基,置于37 ℃,180 r·min-1转速摇床上培养16 h,每2 h 取样,按照1.3.2 测定生长曲线,以最大活菌数确定最佳的碳源浓度。
(2)氮源种类及浓度对KC-1 生长量的影响
选取氯化铵(NH4Cl)、尿素、酵母粉、牛肉膏、蛋白胨和硫酸铵6 种氮源分别为氮源,添加量均为1.0%,培养基其他成分及添加量不变,每种氮源设置3 个重复处理,培养条件、取样方法、测定方法同最佳碳源的筛选试验。
在筛选获得的最适氮源基础上,分别设置0.5%、1.0%、1.5%、2.0%、2.5%和3.0%的6 种不同梯度浓度,其他成分及添加量不变,每种浓度设置3 个重复处理,培养条件、取样方法、测定方法同最佳碳源的最优浓度的筛选试验。
(3)无机盐种类及浓度对KC-1 生长量的影响
选取的NaCl、MgSO4·7H2O、Na2HPO4·NaH2PO4(1∶1)、K2HPO4·KH2PO4(1∶1)和FeSO4作为培养所需的无机盐,添加量均为0.5%,培养基其他成分及添加量不变,pH 值7.2,每种无机盐设置3 个重复处理,培养条件、取样方法、测定方法同最佳碳源的筛选试验。
在筛选获得的最适无机盐基础上,设置浓度分别为0.2%、0.4%、0.6%、0.8%、1.0%及不添加无机盐的处理,其他成分及添加量与基础培养基相同,每种浓度设置3 个重复处理,培养条件、取样方法、测定方法同最佳碳源的最优浓度的筛选试验。
(4)培养基优化的正交试验
根据单因素试验结果,确定碳源、氮源和无机盐的种类,利用碳源、氮源和无机盐三因素对菌体生长情况的影响,采用三因素五水平L25(53)的正交试验,确定最佳培养基组合。正交试验试验因素和水平见表1,试验布置见表2。培养方法同(1)。
1.2.4 培养条件优化试验
在装有150 mL 优化后培养基的250 mL 锥形瓶中分别以接种量3%、4%、5%、6%、7%和8%接种,调节pH 值7.2~7.4,每种梯度设置3 个重复处理,在180 r·min-1转速、37 ℃条件下振荡培养12 h 后,通过测定OD600确定最适接种量。
在装有150 mL 优化后培养基的250 mL 锥形瓶中,分别设置不同初始pH 值、不同培养温度和不同摇床转速,接种量均为4%,其他非单因素试验培养条件和测定指标与接种量优化试验相同,每种处理设置3 个重复试验。分别确定最适培养温度、初始pH 值和摇床转速。供试的培养温度分别设置为28、31、33、37、40 ℃和43 ℃,初始pH 值设置为4.0、5.0、6.0、7.0、8.0、9.0 和10.0,摇床转速设置为140、160、180、200 r·min-1和220 r·min-1。
1.2.5 优化前后结果比较
将150 mL 优化后的最适培养基装入250 mL 锥形瓶中,在优化后的培养条件下,摇床培养12 h,平板菌落计数法测定其活菌数。将150 mL 未优化液体牛肉膏蛋白胨培养基装入250 mL 锥形瓶中,在预设培养条件下,摇床培养12 h,平板菌落计数法测定其活菌数。
1.3 测定方法
1.3.1 有效活菌数的测定
采用平板菌落计数法。
1.3.2 生长曲线的测定
将制备好的接种菌液以4%的接入量接种到装有150 mL 培养基的250 mL 锥形瓶中,置于37 ℃,180 r·min-1摇床上恒温振荡培养,分别测定在培养0、2、4、6、8、10、12、14、16、18、20、22 h 和24 h 时间点上的OD600值,设置3 次重复。
1.4 数据统计分析
碳源、氮源、无机盐、培养温度、pH 值、接种量以及摇床转速对菌体生长影响实验数据采用SPSS 软件对数据统计分析并进行绘图处理(图中小写字母a、b、c…代表组间差异显著性),其他实验数据均采用Excel 软件对3 次重复试验的结果进行求均值,同时进行绘图处理。
2 结果与分析
2.1 培养时间对菌体生长的影响
图1 为枯草芽孢杆菌KC-1 的生长曲线,从图1可见菌体生长量呈先升高后下降的趋势,在12 h 时OD600值最高,达到1.884。
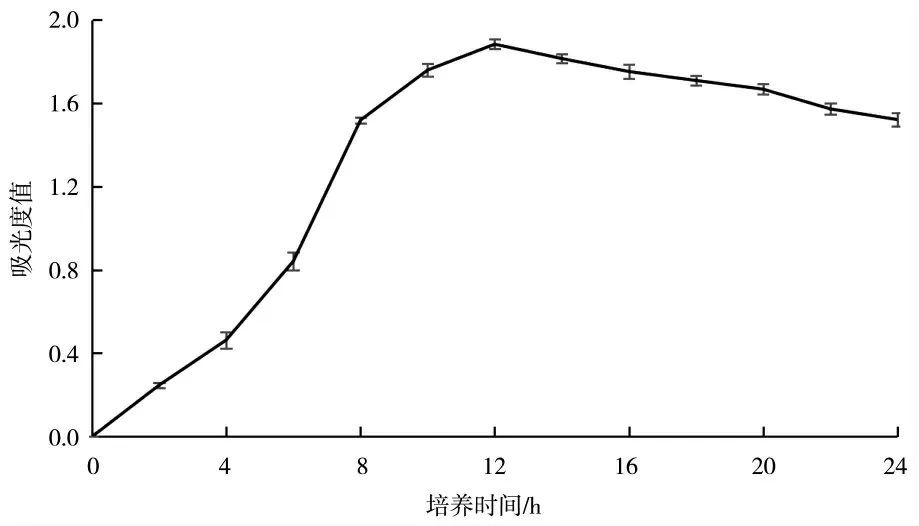
图1 培养时间对菌体生长量的影响Fig.1 The effects of cultivate time on growth rate of bacteria
2.2 培养基成分和浓度的优化
2.2.1 碳源种类及浓度对KC-1 生长量的影响
图2 为不同碳源种类对KC-1 生长量的影响,不同组别间差异显著,葡萄糖作为碳源时,KC-1 有效活菌数显著高于其他碳源处理;图3 为不同浓度的葡萄糖对KC-1 生长量的影响,随着培养时间的延长,不同处理的有效活菌数均呈上升的趋势,供试浓度为2.0%时,KC-1 有效活菌数显著高于其他葡萄糖浓度处理。
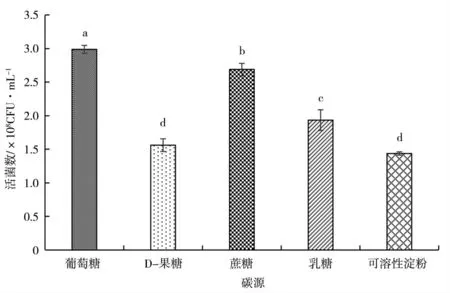
图2 碳源种类对KC-1 活菌数的影响Fig.2 The effects of kinds of carbon sources on the KC-1 viable count
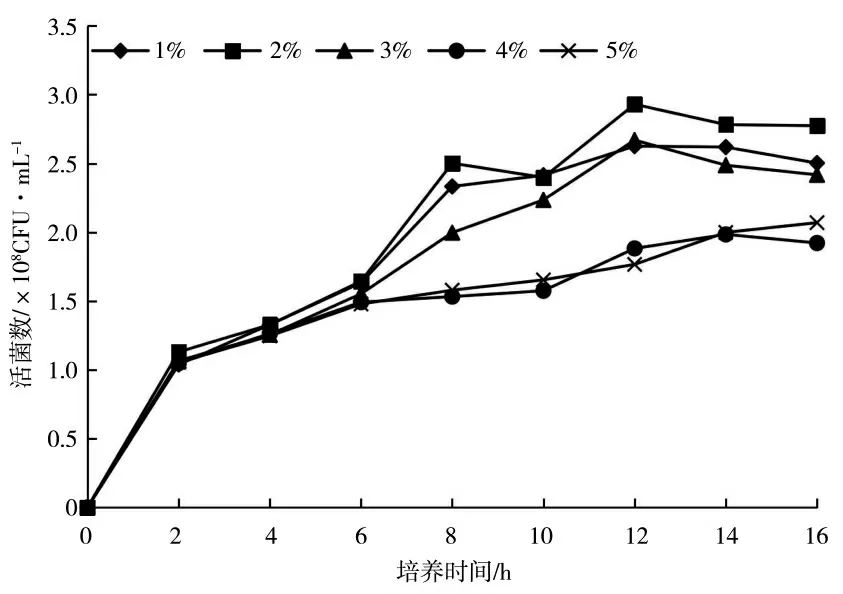
图3 葡萄糖浓度对KC-1 活菌数的影响Fig.3 The effects of glucose concentration on the KC-1 viable count
2.2.2 氮源种类及浓度对KC-1 生长量的影响
氮源主要作用是维持胞内需氮化合物的合成,如氨基酸、蛋白质和核酸[20]等。不同氮源对KC-1 生长量的影响有一定差异(图4),有机氮作氮源的有效活菌数显著高于无机氮,其中酵母粉的作用效果最优。图5 为不同浓度的酵母粉对KC-1 生长量的影响,不同处理的有效活菌数均随培养时间的延长呈上升趋势,在12 h 时开始趋于平缓,供试添加量中浓度为1.0%的处理有效活菌数显著高于其他处理。
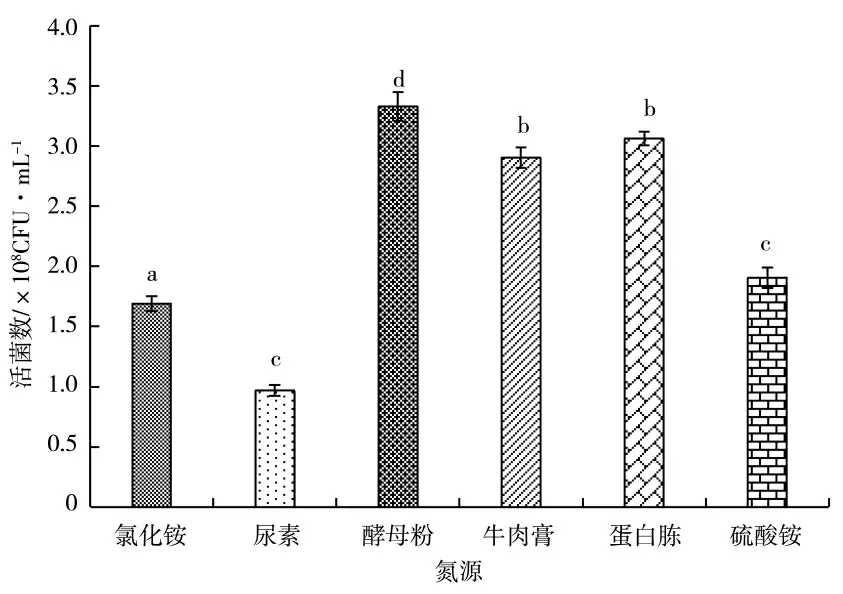
图4 氮源种类对KC-1 活菌数的影响Fig.4 The effects of kinds of nitrogen sources on the KC-1 viable count
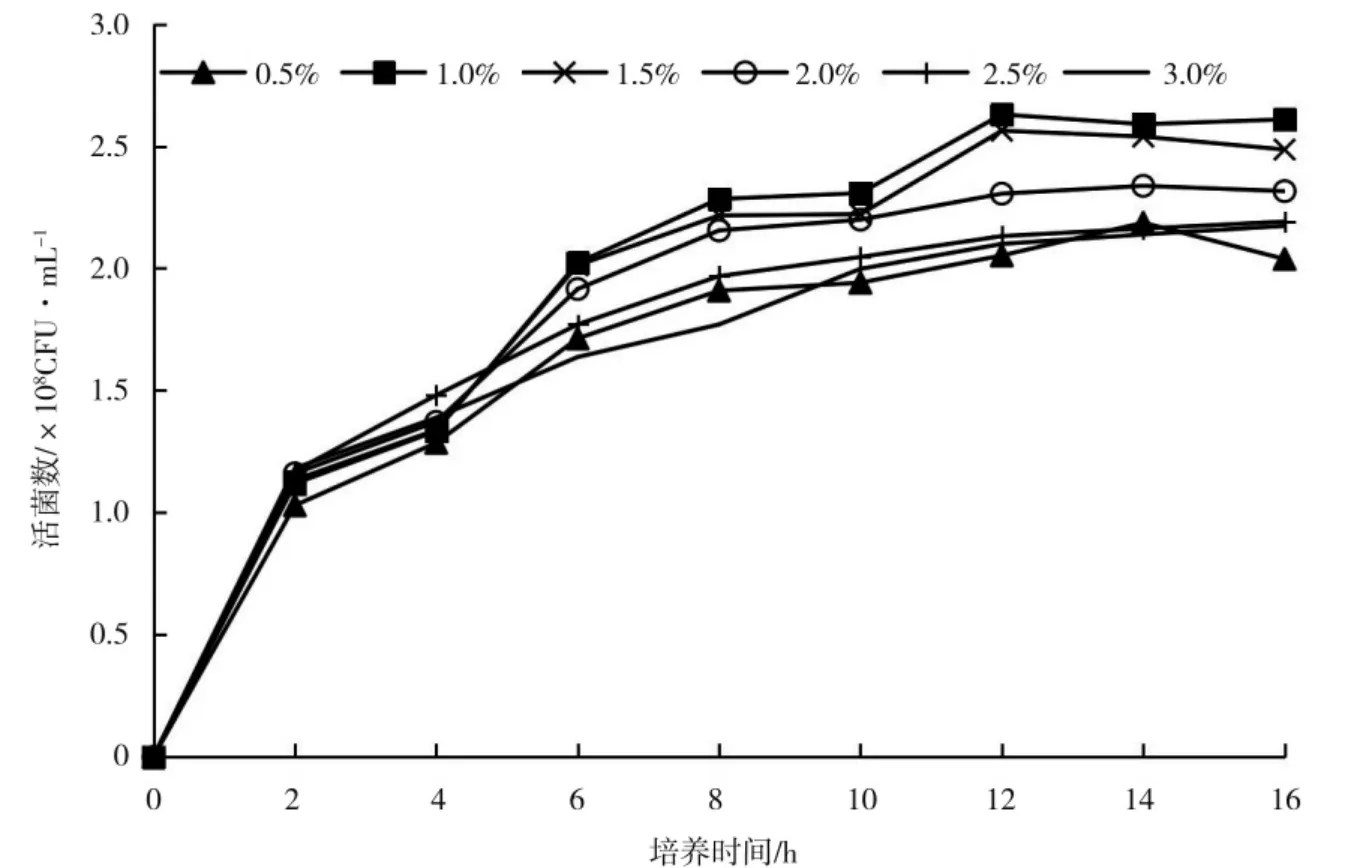
图5 酵母粉浓度对KC-1 活菌数的影响Fig.5 The effects of yeast concentration on the KC-1 viable count
2.2.3 无机盐种类及浓度对KC-1 生长量的影响
无机盐在微生物生长过程中起着重要的作用[21]。不同无机盐种类对KC-1 生长量影响如图6,K2HPO4·KH2PO4(1∶1)作为无机盐时菌体生长情况显著优于其他处理。图7 为不同浓度的K2HPO4·KH2PO4(1∶1)对KC-1 生长量的影响,其中浓度为0.4%的处理有效活菌数显著高于其他处理。
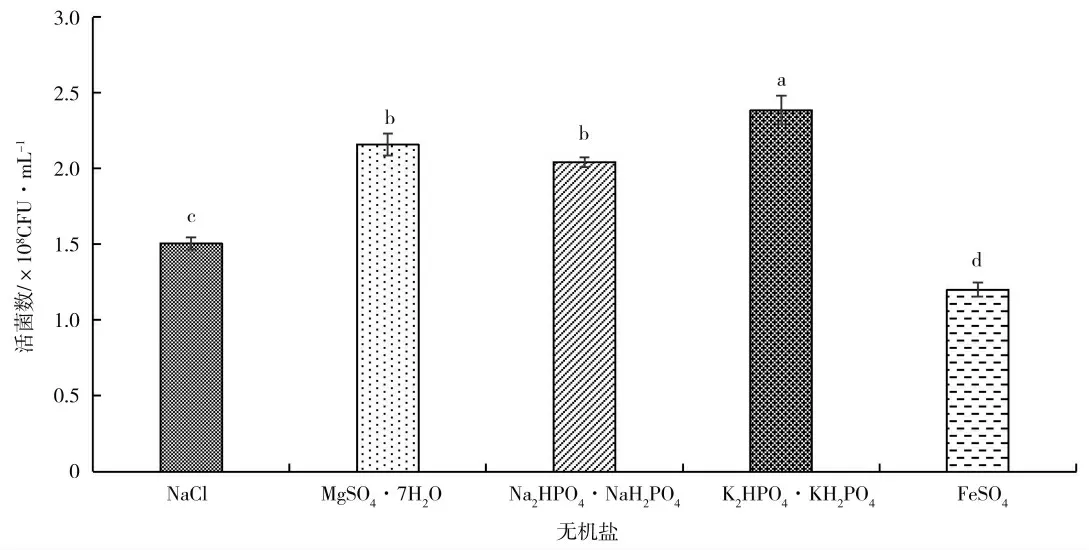
图6 无机盐种类对KC-1 活菌数的影响Fig.6 The effects of kinds of Inorganic salts on the KC-1 viable count

图7 K2HPO4·KH2PO4(1∶1)浓度对KC-1 活菌数的影响Fig.7 The effects of K2HPO4·KH2PO4(1∶1)concentration on the the KC-1 viable count
2.2.4 培养基优化正交试验结果
L25(53)的变量及水平如表1 所示,表2 为25 个实验组培养12 h 的OD600结果及极差分析,从极差R看出,此三因素对菌体生长影响的主次顺序为酵母粉>葡萄糖>K2HPO4·KH2PO4(1∶1);从吸光值可看出,19 号处理的组合最优,两表结合分析筛选得到培养基组合为葡萄糖2.50%,酵母粉1.25%和K2HPO4·KH2PO4(1∶1)0.3%。

表1 正交试验因素水平表Table 1 Orthogonal factor level table
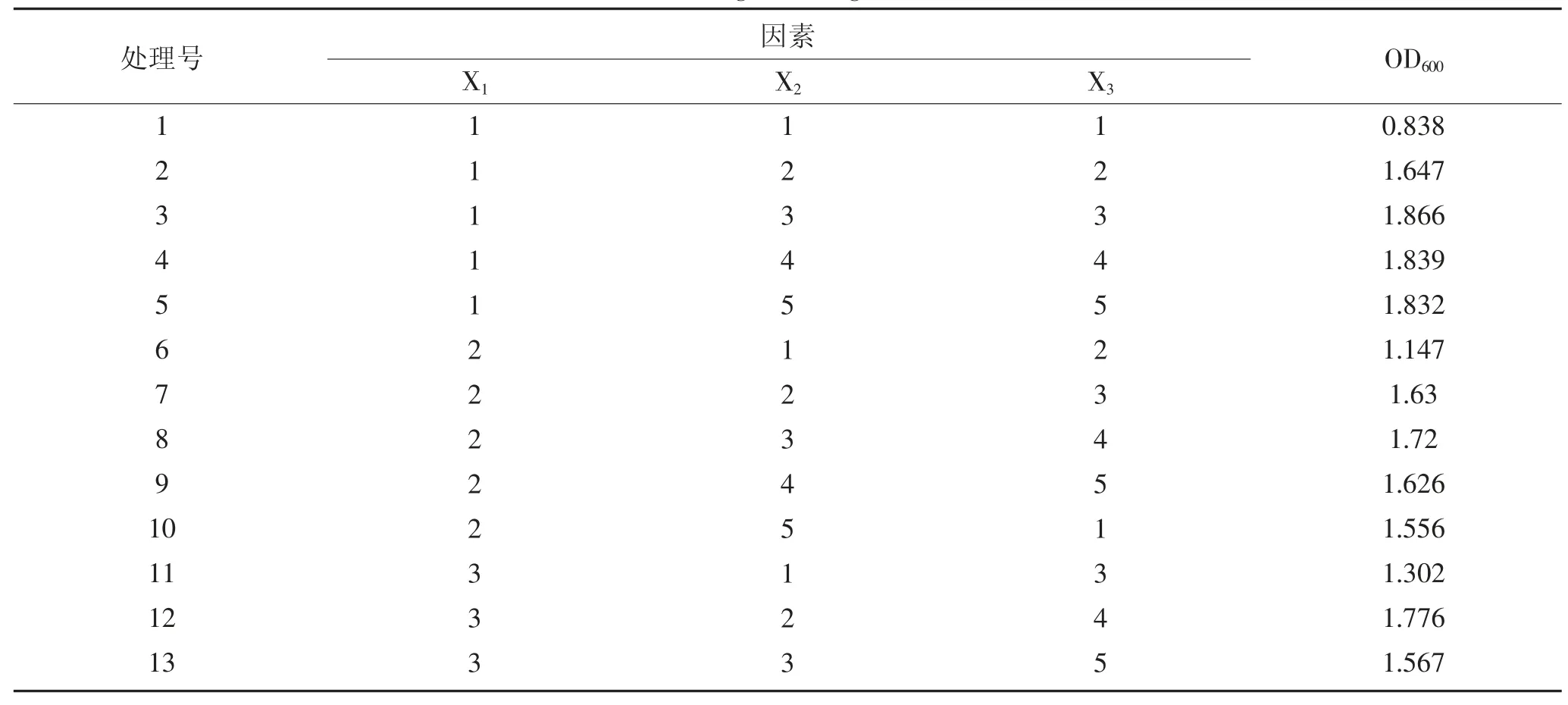
表2 正交试验设计及结果Table2 Orthogonal design and results

续表2 正交试验设计及结果Continued table 2 Orthogonal design and results
2.3 培养条件的优化
2.3.1 培养温度对KC-1 生长量的影响结果
不同培养温度对菌体生长的影响如图8 所示,菌体生长量随温度的升高呈先上升后下降的趋势,37 ℃时菌体生长量最高。

图8 温度对菌体生长量的影响Fig.8 The effects of temperature on bacteria growth
2.3.2 初始pH 值对KC-1 生长量的影响结果
不同初始pH 对菌体生长量的影响如图9 所示,初始pH 值为5.0 时菌体生长量最高,且初始pH 值为4.0、8.0、9.0 和10.0 时菌体生长均受到抑制,说明在过酸或过碱环境下,均不利于菌体的生长。

图9 初始pH 值对菌体生长量的影响Fig.9 The effects of initial pH value on bacteria growth
2.3.3 接种量对KC-1 生长量的影响结果
不同接种量对KC-1 生长量的影响如图10,接种量小于7%时,菌体生长量呈上升趋势,接种量为7%时菌体生长量达到最大值,接种量过高不利于菌体生长。
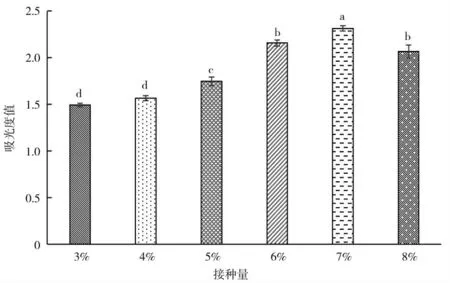
图10 接种量对菌种生长量的影响Fig.10 The effects of inoculation amount on bacteria growth
2.3.4 摇床转速对KC-1 生长量的影响
不同摇床转速对KC-1 生长量的影响见图11,小于200 r·min-1时随着转速的增加,菌体生长量随之增加,200 r·min-1时生长量显著高于其他转速。

图11 转速对菌体生长量的影响Fig.11 The effects of rotation speed on bacteria growth
2.4 优化前后结果比较
将优化后的培养基及培养条件同最初的液体牛肉膏蛋白胨培养基及预设培养条件相对照,优化前活菌数在12 h 达到2.61×108CFU·mL-1,优化后最适活菌数在12 h 达到4.29×108CFU·mL-1,比优化前活菌数提高了1.64 倍。

图12 优化处理对KC-1 有效活菌数的影响Fig.12 The effects of optimization process on effective KC-1 effective viable count
3 结论与讨论
目前,芽孢杆菌开发的生防菌剂和生物制剂应用广泛,在农业上的应用已取得了长足的进步,但在生产应用中仍存在一些如拮抗物质不耐贮存、热稳定性较差、不耐酸碱和在田间无法发挥稳定有效的防治效果等问题[22]。因此,通过筛选、优化、基因改造[23]等,生产出适用于田间具有广谱效果的生防菌株还需加强研究[24]。试验对枯草芽孢杆菌KC-1 基本培养条件及培养基进行优化,显著提高了KC-1 有效活菌数,为KC-1 的培养优化及利用提供科学的参考依据。通过绘制枯草芽孢杆菌KC-1 的生长曲线图,发现枯草芽孢杆菌的指数生长期是第2~12 h,在第12 h时枯草芽孢杆菌的生长开始趋于平缓,从而确定枯草芽孢杆菌的最适宜培养时间。为提高枯草芽孢杆菌KC-1 菌株有效活菌数,通过单因素试验和正交试验相结合的方法,对枯草芽孢杆菌KC-1 培养基、培养条件进行优化。
结果表明,优化后的培养基组分为2.50%葡萄糖,1.25%酵母粉和0.30%K2HPO4·KH2PO4(1∶1);优化后的最适培养条件为:培养温度37 ℃,初始pH 值5.0,接种量7%,摇床转速200 r·min-1,培养时间为12 h。菌体培养达到37 ℃后,菌体生物量开始随着温度的升高而下降,是由于菌体内的酶为蛋白质,温度过高使其失活导致活菌数下降;该菌种在pH 值为5.0~7.0 之间可以生长,最适为pH 值5.0,该菌的pH耐受范围较小,只有在这个范围中菌体才可生长。经过优化处理后,KC-1 在最优培养基以及培养条件下,有效活菌数可达4.29×108CFU·mL-1,较优化前提高1.64 倍。

