副溶血性弧菌外膜蛋白VP1008的原核表达及诱导条件的优化
袁倩云,梁夏夏,刘 蕾,郭珊珊,王文彬*
(1.江苏海洋大学食品科学与工程学院,江苏 连云港 222005;2.江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;3.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
由副溶血性弧菌(Vibrioparahaemolyticus,VP)引起的食物中毒已居微生物食源性疾病暴发的首位[1],引起的弧菌病给养殖业造成严重的损失[2]。因此,建立一种快速、简便、高效的副溶血性弧菌检测方法,对海水养殖中弧菌感染的预防与控制具有重要理论意义和应用价值,也为筛选具有较高免疫保护作用的疫苗候选靶位提供理论基础[3]。
外膜蛋白是革兰氏阴性细菌细胞壁的主要成分,是一种典型的由蛋白、多糖和脂质共同构成的磷脂双分子层结构[4],其在维持细菌细胞结构稳定、细胞营养吸收及物质交换过程中起着十分重要的作用。部分外膜蛋白具有黏附作用,可作为清除和逃避宿主防御机制的毒力因子[5],在细菌致病性和免疫性中的作用日益受到重视[6];部分外膜蛋白具有较好的免疫原性,是一种潜在的诊断抗原[7]。研究发现,外膜蛋白OmpA是宿主免疫系统清除细菌的靶向识别蛋白[8]。外膜蛋白OmpK制备多株用于检测副溶血性弧菌的单克隆抗体具有高度的灵敏性,开发了一种快速、灵敏、简便的副溶血性弧菌检测方法[9]。外膜蛋白OmpU具有免疫交叉保护性,可以作为弧菌广谱疫苗的候选抗原[10]。外膜蛋白OmpC具有很好的免疫原性[11]。免疫候选抗原通过纯化重组蛋白或在异源载体中表达的蛋白亚基制成,具有安全性和特异性,因此被广泛用作鱼类弧菌的检测和预防。
本实验室前期筛选出17种保守性大于92%的差异性副溶血性弧菌外膜蛋白。其中,外膜蛋白VP1008在弧菌属中具有广泛保守性,具有作为弧菌免疫检测抗原的潜力。目前,关于副溶血性弧菌外膜蛋白VP1008的生物学功能及重组表达的研究报道较少,其作为诊断抗原和疫苗抗原的价值仍不清楚。因此,作者以副溶血性弧菌为研究主体,运用蛋白质组学技术筛选及鉴定外膜蛋白VP1008,进行原核诱导表达,优化了诱导表达条件[IPTG浓度、起始菌液浓度(OD600)、诱导温度、诱导时间],为制备VP1008多克隆抗体,研究VP1008的结构、功能及免疫原性奠定基础。
1 实验
1.1 材料、试剂与仪器
大肠杆菌DH5α、BL21(DE3) 和原核表达载体pET-28a(+),本实验室保存;副溶血性弧菌(CICC 21617),中国工业微生物菌种保藏管理中心。
限制性内切酶NcoⅠ和XhoⅠ,宝生物工程有限公司;牛血清蛋白(BSA),Sigma公司;DNA Marker、双色预染蛋白 Marker、胶回收试剂盒、质粒抽提试剂盒、卡那霉素、异丙基硫代-β-D半乳糖苷、SDS-PAGE凝胶电泳所需试剂,生工生物工程(上海)股份有限公司;其它化学试剂,上海国药化学试剂有限公司。
立式压力蒸汽灭菌锅,上海博迅医疗生物仪器公司;单人净化工作台,苏州净化设备有限公司;水平摇床、核酸电泳仪,北京六一仪器厂;高速冷冻离心机,湖南赫西仪器;超声波破碎仪,上海领成生物科技;DGGE变性梯度凝胶电泳仪、凝胶成像仪,伯乐公司;磁力搅拌器,舟山海源公司;电热恒温水浴锅,上海精宏实验设备有限公司。
1.2 外膜蛋白VP1008的结构模拟、生物信息学分析和目的基因扩增
从NCBI数据库中下载VP1008氨基酸序列,通过Swiss-Modle在线服务器进行结构模拟。用Mega 7(version:7.0.26)软件结合NCBI数据库构建系统发育树,在NCBI数据库中Blast检索出与VP1008同源性较高的10个不同的副溶血性弧菌外膜蛋白和4个弧菌属外膜蛋白,序列对比分析后用邻接法(Neighbor Joining,NJ)进行建树。从NCBI数据库中下载VP1008的核苷酸序列,以此为模板,在目的基因序列上插入限制性酶切位点XhoⅠ、NcoⅠ后,使用Premier 5.0软件设计上下游引物,目的基因扩增参照文献[12]。
1.3 重组质粒的构建、筛选与鉴定
将纯化后的目的基因和载体pET-28a(+)质粒分别用限制性核酸内切酶XhoⅠ和NcoⅠ进行酶切后,通过T4连接酶于16 ℃连接过夜,重组质粒的构建、筛选与鉴定参照文献[12]。
1.4 重组外膜蛋白VP1008的诱导表达及表达条件的优化
重组外膜蛋白VP1008的诱导表达参照文献[12]。
为提高重组外膜蛋白的表达量,对诱导剂IPTG浓度、OD600、诱导温度、诱导时间进行优化。将IPTG浓度设计为0.2 mmol·L-1、0.5 mmol·L-1、0.8 mmol·L-1、1.0 mmol·L-1,37 ℃摇床振荡培养至对数生长期OD600为 0.6,诱导时间为12 h;OD600设计为0.4、0.6、0.8,IPTG浓度为1.0 mmol·L-1,诱导温度为37 ℃,诱导时间为12 h;诱导温度设计为16 ℃、28 ℃、37 ℃、42 ℃,OD600为0.6,IPTG浓度为1.0 mmol·L-1,诱导时间为12 h;诱导时间设计为6 h、12 h、18 h,OD600为0.6,IPTG浓度为1.0 mmol·L-1,诱导温度为37 ℃。菌体超声破碎、离心,分别收集上清和沉淀,进行10% SDS-PAGE电泳表征,分析蛋白表达情况。
2 结果与讨论
2.1 外膜蛋白VP1008的结构类型及生物进化树分析
VP1008为预测的外膜蛋白,相关研究较少。通过Swiss-Modle模拟结构,VP1008具有典型的β-桶状结构,说明是副溶血性弧菌外膜蛋白。系统发育树(图1)表明,VP1008在副溶血性弧菌菌株间同源性较高,在弧菌属内仅与部分弧菌有一定的同源性。

图1 VP1008系统发育树Fig.1 Phylogenetic tree of VP1008
2.2 目的基因扩增与重组质粒的构建、筛选与鉴定
PCR验证结果表明,4个单菌落扩增出与VP1008基因大小相近的条带,经双向测序后与原序列进行比对,符合度均在98.5%以上,表明重组质粒构建成功。
2.3 重组外膜蛋白VP1008的表达
重组外膜蛋白VP1008经SDS-PAGE凝胶电泳分析发现,沉淀在约为40 kDa出现了明显的特异性目的条带,与目的蛋白理论分子量39.325 kDa相符;而上清液中无目的条带。表明,重组外膜蛋白主要以包涵体形式存在于沉淀中。
2.4 重组外膜蛋白VP1008表达条件的优化
2.4.1 IPTG浓度
挑取阳性重组质粒单菌落置于液体培养基中,37 ℃摇床振荡培养至OD600为0.6,诱导时间为12 h,考察IPTG浓度对蛋白表达量的影响,结果见图2。
由图2可知,随着IPTG浓度的增加,蛋白表达量升高,但IPTG有一定的毒性,IPTG浓度过高会影响蛋白的表达[13],当IPTG浓度为1.0 mmol·L-1时,蛋白表达量最高。因此,确定最优IPTG浓度为1.0 mmol·L-1。
2.4.2OD600的优化
固定IPTG浓度为1.0 mmol·L-1、诱导温度为37 ℃、诱导时间为12 h,考察OD600对蛋白表达量的影响,结果见图3。

M.DNA分子量标准 1,2.0.2 mmol·L-1IPTG诱导的上清、沉淀3,4.0.5 mmol·L-1IPTG诱导的上清、沉淀 5,6.0.8 mmol·L-1IPTG诱导的上清、沉淀 7,8.1.0 mmol·L-1IPTG诱导的上清、沉淀
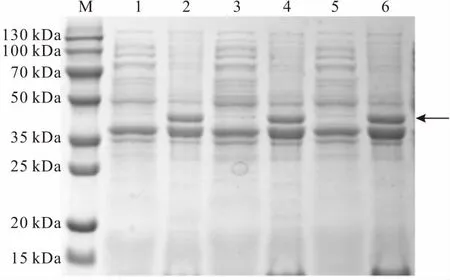
M.DNA分子量标准 1,2.OD600 为0.4诱导的上清、沉淀 3,4.OD600为0.6诱导的上清、沉淀 5,6.OD600 为0.8诱导的上清、沉淀
由图3可知,随着OD600的增加,蛋白表达量升高,当OD600增至0.6时,细菌处于对数生长期,数量增加极快,活性最高,蛋白表达量最高;当OD600继续增至0.8时,蛋白表达量没有明显升高,基本趋于稳定。因此,确定最优OD600为0.6。
2.4.3 诱导温度的优化
固定OD600为0.6、IPTG浓度为1.0 mmol·L-1、诱导时间为12 h,考察诱导温度对蛋白表达量的影响,结果见图4。
由图4可知,随着诱导温度的升高,蛋白表达量升高不明显;诱导温度为16 ℃、42 ℃时,蛋白表达量较少;诱导温度为28 ℃时,蛋白表达量略微升高;当诱导温度为37 ℃即大肠杆菌的最适生长温度时,蛋白表达量最高。因此,确定最优诱导温度为37 ℃。
2.4.4 诱导时间的优化
固定OD600为0.6、IPTG浓度为1.0 mmol·L-1、诱导温度为37 ℃,考察诱导时间对蛋白表达量的影响,结果见图5。

M.DNA分子量标准1,2.16 ℃时诱导的上清、沉淀3,4.28 ℃时诱导的上清、沉淀5,6.37 ℃时诱导的上清、沉淀7,8.42 ℃时诱导的上清、沉淀
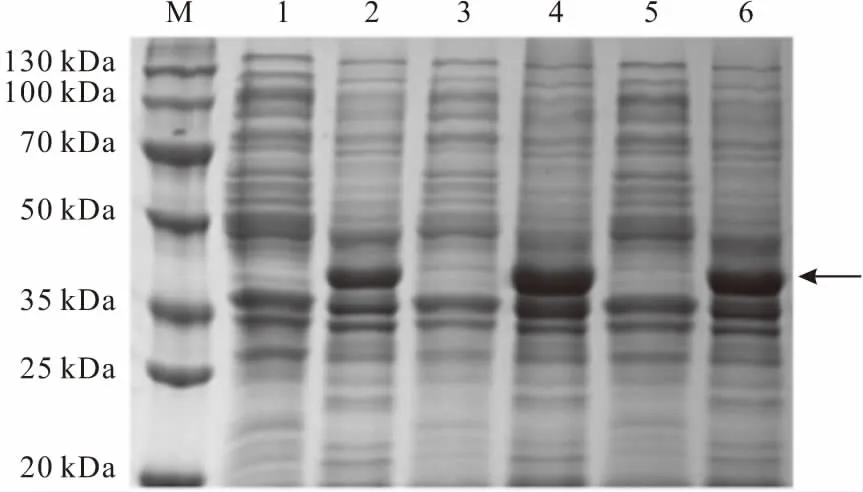
M.DNA分子量标准 1,2.诱导6 h的上清、沉淀 3,4.诱导12 h的上清、沉淀 5,6.诱导18 h的上清、沉淀
由图5可知,随着诱导时间的延长,蛋白表达量逐渐升高,当诱导时间为12 h时,蛋白表达量最高;诱导时间延长到18 h时,蛋白表达量没有明显升高。因此,确定最优诱导时间为12 h。
3 结论
成功构建了VP1008原核表达系统,确定重组外膜蛋白VP1008的最优诱导条件为:IPTG浓度1.0 mmol·L-1、OD6000.6、诱导温度37 ℃、诱导时间12 h,重组蛋白以包涵体的形式存在。制备的重组外膜蛋白VP1008的表达量较高,为下一步制备该蛋白多克隆抗体,研究该蛋白的结构、功能、免疫原性奠定了基础。

