FGF5基因编辑细毛羊的健康状况评估
胡慧宇,任思睿,刘晨曦,韩 冰,李忠慧,玛依拉,刘明军,李文蓉*
(1.新疆农业大学动物科学学院,乌鲁木齐830052;2.新疆畜牧科学院生物技术研究所,乌鲁木齐830011;3.新疆维吾尔自治区动物生物技术重点开放实验室,乌鲁木齐830011)
目前转基因动物的潜在安全问题是人们广泛关注的热点问题之一。依照我国《转基因生物安全评价管理条例》、《转基因动物安全评价指南》,明确了转基因动物评价应包括分子特征、遗传稳定性、健康状况、功能效率评价、环境适应性、转基因动物逃逸(释放)及其对环境的影响和食用安全7个主要方面。其中,转基因及基因编辑动物健康状况用一般指标、生理学指标和其他适合的指标进行评价。
基因编辑技术是一项在生物体基因组水平上对DNA序列进行定向改造的新型技术,主要包括锌指核酸酶(zinc finger nuclease,ZFN)、类转录激活因子效应物核酸内切酶(transcription activator-like effector nucleases,TALEN)和规律成簇的短回文重复序列/Cas9(clustered regularly inter-spaced short palindromic repeats/Cas9,CRISPR/Cas9)等介导的技术[1-3]。其中,CRISPR/Cas9技术只需较短的sgRNA序列便可引导Cas9蛋白在内源性基因组特定位点进行切割、精准编辑,相较于其它基因编辑技术具有更加高效便捷的特点[4,5]。同时,该技术不导入外源DNA序列进入动物基因组中。因此CRISPR/Cas9从理论上更加安全、更易为公众所接受。成纤维细胞生长因子5(Febroblast Growth factor 5,FGF5)是23个FGF家族的成员之一,具有阻止毛乳头细胞的激活和增殖,有效抑制毛发生长发育的作用[6]。目前的研究表明,FGF5与毛囊的发育和被毛的生长密切相关,能有效控制毛囊从生长期向休止期的转化[7]。羊毛长度是绵羊重要的经济性状之一,属复杂数量性状,利用常规遗传手段改良难度大、周期长[8]。利用CRISPR/Cas9基因编辑技术对细毛羊FGF5基因进行靶向修饰,能有效阻断FGF5功能,从而促进羊毛生长。
本课题组前期采用CRISPR/Cas9技术对中国美利奴细毛羊的FGF5基因进行InDel突变,成功获得了一批相较于野生型细毛羊(即非转基因正常细毛羊),其毛长和毛产量显著提高的基因编辑羊[9]。为了评价FGF5基因突变后细毛羊的健康状况,本研究比较分析了基因编辑羔羊和同龄野生型细毛羊羔羊的0、2、4、6、8月龄生长发育性状,比较了周岁及成年的基因编辑羊与野生型羊的生理生化指标,分析了周岁基因编辑羊、成年基因编辑羊以及成年野生型羊的直肠微生物群落结构组成,旨在通过对基因编辑羊与野生型羊健康状况的全面检测分析,阐明FGF5基因编辑羊的生物安全性,为基因编辑动物安全评价相关法规政策的制定提供理论依据,推动FGF5基因编辑细毛羊的产业化发展。
1 材料与方法
1.1 实验动物
本实验所用FGF5基因编辑羊(genetically modified,GM)、野生型细毛羊(wild-type,WT)群体均饲养在新疆畜牧科学院生物技术研究所绵羊繁育基地,羊只饲养管理一致、体况健康、自由采食和饮水。挑选同一时期(相差不超过15 d)出生的FGF5基因编辑羔羊(GM,n=40)和野生羔羊(WT,n=25)用于生长发育性状测定;分别选取成年羊(GM 54只,WT 22只)和羔羊(GM 36只,WT 13只)用作生理生化指标检测;随机选取3组公羊用作直肠微生物群落分析,其中成年野生型羊(A组)8只、周岁FGF5基因编辑羊(B组)6只、成年FGF5基因编辑羊(C组)8只。
1.2 实验试剂及仪器
一次性使用真空注血管(抗凝管)、一次性使用真空采血管(普通管),购自南昌市赣达医疗器械有限公司;大动物血清生化加强诊断试剂盒,购自天亮医疗器材股份有限公司;BC2800Vet全自动动物血液细胞分析仪、BS-180迈瑞全自动血清生化检测仪,均为深圳迈瑞生物医疗电子股份有限公司的产品;台式低速离心机TD-4M,为博科控股集团有限公司的产品。
1.3 实验方法
1.3.1 羔羊生长发育性状测定
分别在FGF5基因编辑羔羊和野生型羔羊的0、2、4、6、8月龄时,测量其体高、体斜长、胸围和体重。具体方法如下:用尺子从测量羔羊的肩隆高到地面的垂直距离,即体高;肩胛前端至坐骨结节后端的直线距离,即体斜长;在肩胛骨后端,围绕胸部一周的长度即胸围。
1.3.2血液样品采集及检测
将羊只保定,采集约3 mL血液,立即分别注入含肝素钠的抗凝采血管和无抗凝剂的采血管中。将抗凝血轻轻颠倒混匀,用于血常规测定。该样品须在采血4 h内进行检测;用于血清生化检测的样品需带回实验室,3 000 r/min离心10 min后,吸出的血清送往检测机构进行分析。血常规检测和血清生化检测均由新疆畜牧科学院兽医研究所动物中心完成。
1.3.3 直肠粪便采集及测定
清洗羊只肛门后,戴上无菌手套从肛门伸入直肠,用手指将粪抠出。使用无菌培养皿接取直肠处粪样,再移入50 mL无菌离心管中,封口后将盛有粪样的离心管放入预先备好的冰袋上。样品低温运送至北京诺禾致源生物科技有限公司,进行16S rDNA微生物群落测序。
1.3.4 统计分析
GM羊与WT羊的生长性状、生理生化指标利用SPSS软件进行独立样本t检验,以P<0.05表示差异显著;直肠微生物群落测序结果利用诺禾致源生信分析云平台对测序有效数据进行OTU聚类和物种注释、样本复杂度分析、多样本差异分析,同样以P<0.05表示差异显著。
2 结果与分析
2.1 羔羊生长发育性状分析
将FGF5基因编辑羔羊(GM,n=40)和野生羔羊(WT,n=25)分别于出生、2月龄、4月龄、6月龄和8月龄测定的体重、体高、胸围和斜体长进行了数据统计和比较。从表1结果显示,GF5基因编辑羊与野生型羊的各项指标随羔羊月龄增长均呈上升趋势,FGF5基因编辑羊与野生型羊不同月龄的各项生长性状均无显著差异(P>0.05)。

表1 羔羊的生长发育速度统计(平均数±标准差)
2.2 血常规及血清生化结果
血常规检测各项指标中红细胞数、血红蛋白浓度、红细胞压积、平均红细胞体积、平均血红蛋白含量、平均血红蛋白浓度和红细胞体积分布宽主要检测羊是否存在贫血;平均血小板体积、血小板分布宽度和血小板计数主要检测羊是否存在血液疾病;白细胞数、淋巴细胞百分比、中性粒细胞百分比、嗜酸性粒细胞百分比和单核细胞百分比主要检测羊是否存在炎症及细菌病毒感染。血清生化检测所选的加强诊断试剂盒中,针对羊的肾功能检测项目有血尿素氮和肌酐,肝功能检测项目有碱性磷酸酶、白蛋白和总蛋白,醣类代谢检测项目有葡萄糖,电解质检测项目有钠、钾、无机磷、钙。
分别对FGF5基因编辑羊与野生型对照羊的生理生化检测结果进行T检验分析。结果显示,不论是羔羊组还是成年组,FGF5基因编辑羊与野生细毛羊的血常规各项指标以及血清生化各项指标均无显著差异(P>0.05),如表2和表3所示。

表2 FGF5基因编辑羊与野生细毛羊血常规指标(平均数±标准差)
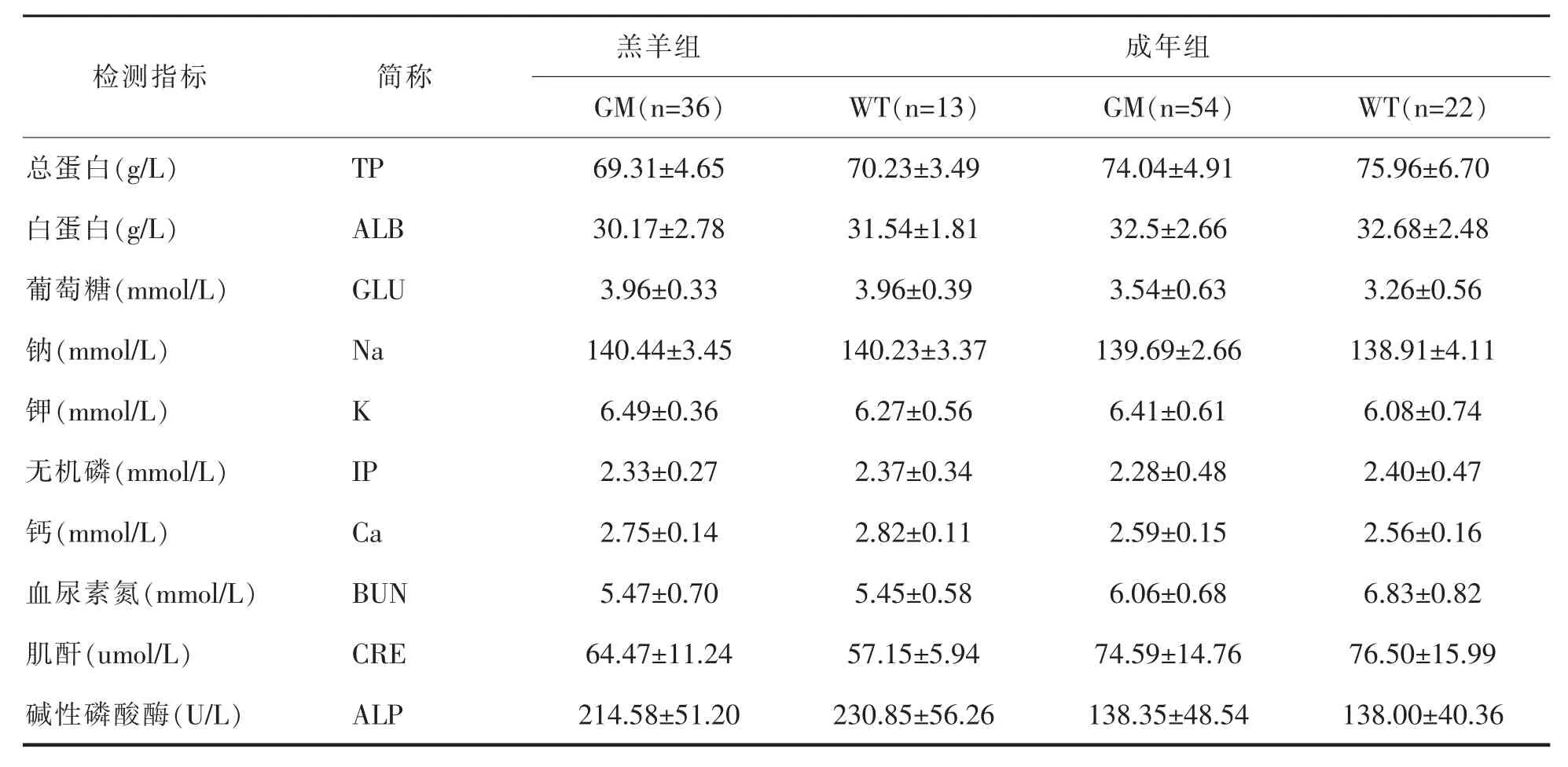
表3 FGF5基因编辑羊与野生细毛羊血清生化指标(平均数±标准差)
2.3 直肠微生物群落分析
2.3.1 样品测序结果及OTU分析
将直肠粪便送至北京诺禾致源生物科技有限公司进行16S rDNA微生物群落测序。根据测序结果得出每个样品至少产生174 476条有效数据,平均测序长度为409~413 bp。测序质量值Q20%、Q30%分别达到98%和94%以上,GC含量在52%~55%之间,测序质量合格。得到原始数据后以97 %的相似度作为一个OTU的划分标准,对所有样品的有效序列进行聚类,对每个OTU的代表序列进行物种注释。共计得到了29个phylum(门),49个class(纲),99个order(目),181个family(科),344个genus(属)和177个species(种)。
在门水平上(图1),按照组(图1a)和样本个体(图1b)分别展示,相对丰度较高的菌门均为Firmicutes(厚壁菌门)和Bacteroidetes(拟杆菌门),其次是Fibrobacteres(纤维杆菌门)、Verrucomicrobia(疣微菌门)、Proteobacteria(变形菌门)、Spirochaetes(螺旋体门)。以上菌门丰度占据总丰度96.2%以上,A、B、C、三组间无显著差异。

图1 羊直肠粪便菌群门水平的分布
在科水平上(图2),按照组(图2a)和样本个体(图2b)分别展示,在三组样本中Ruminococcaceae(瘤胃菌科)、Ruminococcaceae(理研菌科)、Ruminococcaceae(克里斯滕森菌科)、Lachnospiraceae(毛螺旋菌科)、Prevotellaceae(普雷沃氏菌科)、Akkermansiaceae(疣微菌科)、Bacteroidaceae(拟杆菌科)是丰度最高的菌科。不论是基因编辑羊还是野生型羊的直肠微生物群落中Ruminococcaceae、Ruminococcaceae、Ruminococcaceae和Lachnospiraceae这四个菌科均占优势。

图2 羊直肠粪便菌群科水平的分布
2.3.2 α多样性分析
将所有样本绘制稀释曲线(图3)和等级聚类曲线(图4),每个图中右上角标出每个样本所对应的曲线颜色。在稀释曲线图3中,每个样本使用对应颜色的曲线表示,用来反映测序深度情况。横坐标代表了随机抽取的测序条数,纵坐标为根据测序条数量可构建的OTU数量。如图所示每个样本的曲线已经趋于平缓,说明测序数据量渐进合理,增加测序深度和数据量只会产生少量新的物种,对观测新的OTU的影响不大。在等级聚类曲线图4中,每个样本使用对应颜色的折线表示。横坐标为OTUs丰度排序的序号,纵坐标为对应OTUs的相对丰度。如图4所示,每个曲线在横轴的宽度和在纵轴的平滑程度所反映的丰富度和均匀度差异不大,没有陡峭曲线所反映的优势菌种。

图3 样本稀释曲线
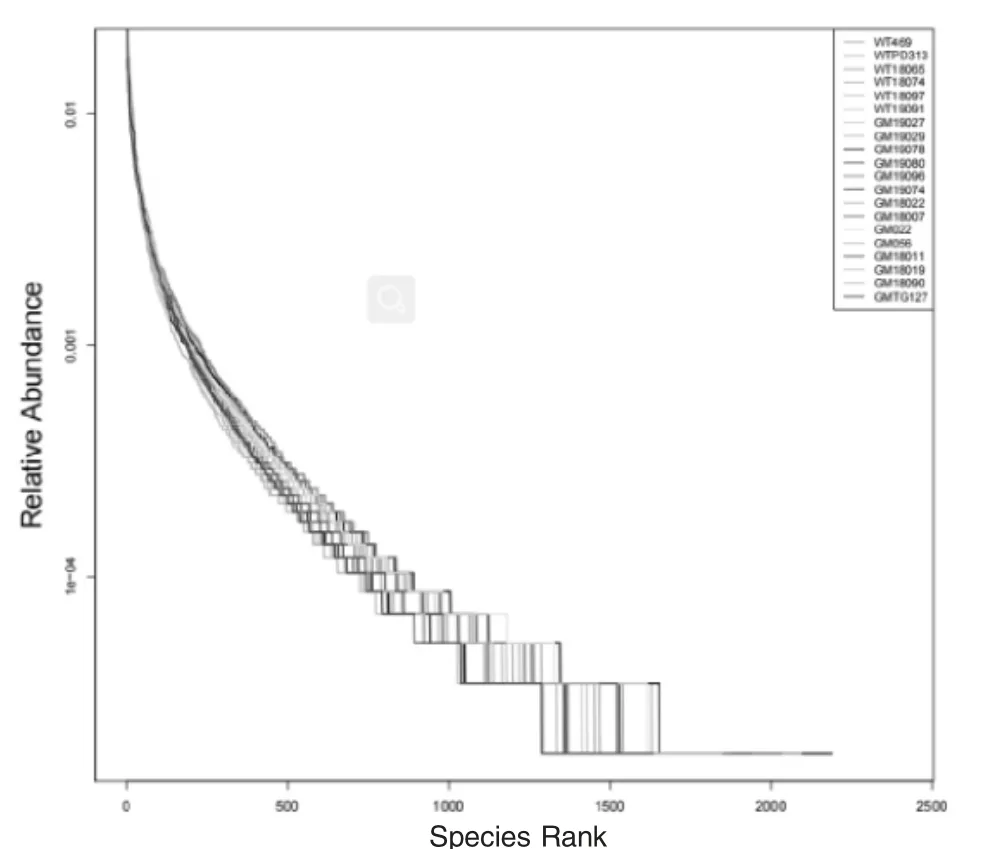
图4 样本等级聚类曲线
在分析样本内多样性中,常用的α指数有Shannon指数、Simpson指数、Chao指数、Ace指数、Goods_coverage指数。其中用来反映菌群丰富度的有Chao指数和Ace指数;用来衡量群落多样性的有Shannon指数以及Simpson指数;Goods_coverage指数则是用来反应测序深度。为分析基因编辑羊与野生对照羊的群落差异和基因编辑羊成年与周岁间群落差异,按照A组(野生型成年羊)与C组(基因编辑成年羊),B组(基因编辑周岁羊)与C组(基因编辑成年羊)的分组模式进行α多样性指数组间差异分析Ttest检验(表4),可以看到每组的Ace,Chao1,Simpson,Goods_coverge和Observed_species指数P值均大于0.05,均无显著性差异。

表4 各指数组间T-test检验结果
2.3.3 β多样性分析
通过主成分分析(PCA分析)比较组间群落结构差异。分析结果如图5a所示,A组野生型成年羊对应实心正方型,C组基因编辑成年羊对应空心正方型,两组各样本分布趋势较近,群落组成较相似。但存在个别偏离样本,如C组的GM18022、GM18090;如图5b所示,B组基因编辑周岁羊对应实心正方型,C组基因编辑成年羊对应空心正方型,两组样本间分布趋势较近,群落组成较相似。但同样存在偏离样本,如C组的GM18090。在两组比较中,GM18090个体都与主群较远,但其它个体无论是GM羊还是WT羊均聚为一类。
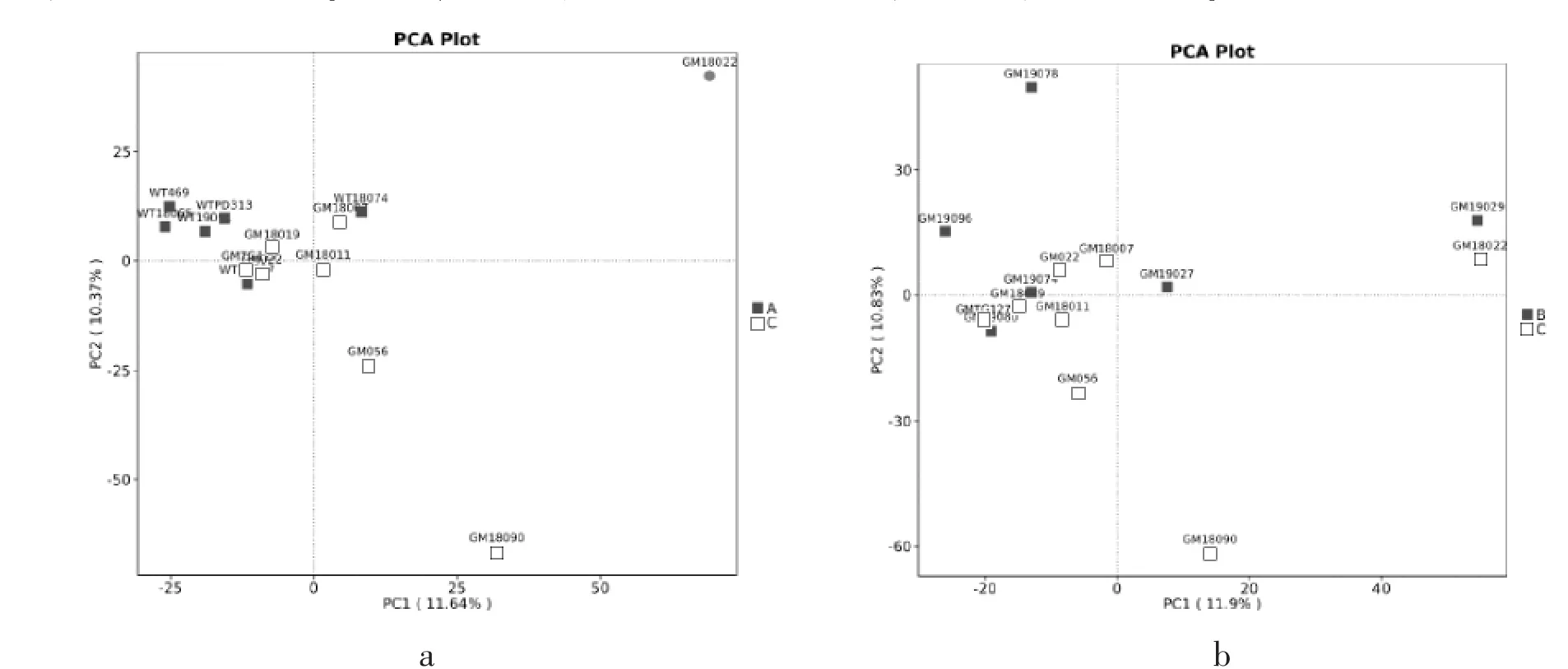
图5 PCA分析
进一步利用ANOSIM相似度分析进行评价,计算A、B、C组间差异大小及显著性。R-value是ANOSIM检验的统计量,介于-1和1之间。R-value大于0且越接近1,说明组间差异越大、组内差异越小;R-value小于0且越接近-1,说明组内差异大于组间差异;当R-value=0时,说明样本的分组属于随机分配,分组无统计意义。统计分析的可信度用P-value表示,P<0.05表示统计具有显著性。由表5可知,成年的基因编辑羊与野生型羊的组间比较(A-C)R-value为0.193说明分组具有统计意义,且P值为0.069大于0.05,组间差异不显著;基因编辑羊成年与周岁的组间比较(B-C)R-value为-0.053,说明样本分组属于随机分布,且P值为0.665大于0.05,组间差异不显著。这说明基因编辑成年羊与周岁羊的直肠群落结构基本无差别。提示,基因编辑羊的肠道微生物群落结构与其年龄无关。

表5 ANOSIM结果
2.3.3 组间差异物种分析
LEfSe(LDA Effect Size)能够在组与组之间寻找具有统计学差异的Biomarker,从而能够识别不同丰度的特征以及相关联的类别。在阈值为3的情况下,从下图6可以看出C组(基因编辑成年羊)的弯曲杆菌科(f_Campylobacteraceae)和弯曲杆菌属(g_Campylobacter)为优势菌,均属于革兰氏阴性菌,常与绵羊肠胃炎等疾病相关;A组(野生型成年羊)的瘤胃菌属(g_unidentified_Ruminococcaceae)和另枝菌属(g_Alistipes)为优势菌。其中,瘤胃菌属为肠道内常见益生菌,另枝菌属为革兰氏阴性菌,与炎症疾病相关菌。

图6 LEfSe分析
为了进一步证实基因编辑羊肠道群落与年龄无关,本实验又进行了基因编辑羊不同年龄组的LEfSe分析。在阈值设为3的情况下,没有找到具有显著差异的Biomarker。
LDA值分布柱状图中展示了LDA Score大于设定值3的物种,即组间具有统计学差异的Biomarker。展示了不同组中丰度差异显著的物种,柱状图的长度代表差异物种的影响大小(即为LDA Score)。
3 讨 论
转基因动物的健康评估一直是转基因动物安全评价最重要的组成部分之一。目前我国对转基因动物健康状况评价一般分为表型评价和非表型评价[10]。首先对转基因动物的表型如外貌、行为、生长发育速度等进行评价;其次对已知表型健康的转基因动物进行生理学检测、肠道微生物检测、生殖激素检测等一系列技术手段对其进行非表型评价。为此,本研究采用了生长发育性状检测、生理生化指标检测以及直肠微生物群落结构分析对FGF5基因编辑羊进行综合性健康评估分析。
血液生理生化指标能在不同程度上反映出器官功能的变化及疾病的发生与发展情况,对了解动物的生理状态具有重要意义。血常规通常检测红细胞、白细胞、血小板等多项指标。其中红细胞具有黏附、杀伤抗原,清除免疫复合物,参与集体免疫调控等作用,其功能发挥主要靠血红蛋白[11];白细胞包含淋巴细胞、中性粒细胞、嗜酸性粒细胞等,是动物血液中极为重要的免疫细胞。可以很大程度上反映动物是否存在炎症及细菌病毒感染;血小板等参数在正常范围内是恒定的,对炎症反应、伤口愈合、血栓形成等生理过程中具有重要作用[12]。血清生化指标可以反映动物机体的健康情况。如肝功能损害型疾病可检测血清中的白蛋白、白蛋白和碱性磷酸酶;肾功能疾病可检测血清中的血尿素氮和肌酐[13];葡萄糖水平检测间接反映动物胰岛功能[14];血清中的无机盐电解质检测也可以反映动物的多项生理功能。本研究比较了基因编辑羊与野生对照羊的成年时期和幼年时期的生理生化检测结果,其血常规检和血清生化检测的各项参数均没有差异。揭示了FGF5基因的突变未对细毛羊的健康产生影响。这与蔡文涛[15]对转ATⅢ基因、转IFNβ基因、转HBs Ag基因山羊与非转基因山羊检测的生理学指标相似的结果一致。
肠道微生物群落对机体的免疫功能、消化功能和抗病力等有着重要的影响。在转基因动物健康评估实验中,可以通过粪便间接获取机体的肠道微生物群落结构,从而反映机体的营养代谢水平。此外,肠道微生物群落还会受到许多其它因素的影响,比如动物年龄[16]、动物健康[17]和饲养模式[18]等。因此,本研究分别比较在同一饲养模式下基因编辑羊的成年与周岁之间的肠道群落差异和均已成年的基因编辑羊与野生对照羊的肠道群落差异。从结果来看,基因编辑羊与野生对照羊的肠道群落基本无明显差异。李陇平[19]等人利用CRISPR/Cas 9介导的MSTN/FGF5基因编辑陕北白绒山羊与野生对照羊的肠道粪便菌群分析中发现,两者之间不存在显著差异,这与本研究结果一致;而在不同年龄的分组比较下,基因编辑羊的肠道群落也不存在差异,但其个体分组属于随机分布。由此推测,周岁基因编辑羊的肠道发育已经完善,与成年羊基本无差别,但还需进一步证实。从LEfSe分析结果看到,基因编辑羊具有统计学差异的微生物标志物为弯曲杆菌科和弯曲杆菌属,弯曲杆菌可与宿主共生或致病,是世界上从细菌角度引起胃肠炎的最常见病因。目前还未有报道解释内源基因的改造与肠道内弯曲杆菌增多之间是否有关。在野生型对照羊的微生物标志物中,瘤胃菌属为肠道内常见益生菌,而另枝菌属为革兰氏阴性菌是一种较新的细菌属,常与炎症疾病相关。然而,上述四种菌均属于反刍动物肠道内的常见菌。说明FGF5功能的缺失未改变细毛羊肠道微生物菌群的总体结构。
4 结 论
本研究分析结果初步证实,FGF5基因功能的缺失并未对羔羊的生长发育速度造成影响。FGF5基因编辑羊和野生对照羊的生理生化各项指标和肠道微生物群落无显著差异。FGF5基因编辑羊自身健康状况良好,为转基因动物生物安全评价奠定基础,推动了FGF5基因编辑细毛羊的产业化发展。

