坡面方胸材小蠹鉴定与风险分析
王立超,陈凤毛*,仇才楼,唐进根,丁学农,任吉星
(1.南京林业大学林学院,南方现代林业协同创新中心,江苏 南京 210037;2.江苏省森林病虫害防治检疫站,江苏 南京 210036;3.江苏省东台林场,江苏 盐城 224200)
坡面方胸材小蠹(Euwallaceainterjectus),原属于鞘翅目(Coleoptera)小蠹科(Scolytidae)材小蠹族(Xyleborini)材小蠹属(xyleborus)[1],后因材小蠹属虫数众多且不同小蠹生活习性和形态特征多样,1980年Wood[2]将材小蠹属提升,并对材小蠹属内昆虫重新进行分类,坡面材小蠹、阔面方胸小蠹(E.validus)以及小圆方胸小蠹(E.fornicatus)等也逐渐由材小蠹属归类到方胸材小蠹属(Euwallacea)之中。此外,小蠹科也由原先独立的科级分类单元降级为象虫科下的一个亚科单元[3]。因此,目前坡面方胸材小蠹分类地位属于鞘翅目,象甲科(Curculionidae)小蠹亚科(Scolytinae)方胸材小蠹属。
方胸材小蠹属昆虫具有很强的入侵性,中国、日本、美国等国家口岸曾多次截获多种随木材调运的方胸材小蠹属昆虫,其中包括坡面方胸材小蠹[4]。据文献报道坡面方胸材小蠹为东亚本土物种,目前分布在美国、日本、阿根廷、泰国、马来西亚、孟加拉国等地[5-10],于1976年在美国纽约地区发现,2011年首次报道在泰国橡胶树中发现该小蠹,2019年在阿根廷枯死杨树内第1次发现该小蠹虫分布。有文献记载坡面方胸材小蠹在我国境内有分布,也曾多次在来自马来西亚、菲律宾、新加坡等国家的木材中发现该小蠹虫[8,11-12]。现有文献资料表明坡面方胸材小蠹已在我国江苏、安徽、浙江等地区分布[13-15],而国内尚有大部分地区有寄主植物分布,因此该小蠹虫在国内仍存在进一步扩散的可能。
由于小蠹虫自身体型小,且近似种之间差异不明显,因此很难用肉眼准确鉴定,如坡面方胸材小蠹和阔面方胸材小蠹十分相似,两者区别仅在于小蠹虫鞘翅斜面上第2沟间部齿瘤分布特征[5],造成小蠹虫种类鉴定困难;此外若在检疫过程中仅有幼虫或小蠹虫残体存在,此时小蠹虫的形态检疫则根本无法进行。如今,分子生物学技术逐渐运用到小蠹虫鉴定工作中,已有文献报道用于小蠹虫分子鉴定的基因有线粒体基因COI、核糖体基因28S rDNA、核蛋白编码基因CAD和ArgK基因以及延长因子基因EF-1α[16],但是国内对小蠹虫分子鉴定研究较少[15,17],对坡面方胸材小蠹的研究更是鲜见[4,18]。
2019年7月,在江苏省东台林场有大量杨树死亡,调查中发现一种小蠹虫,数量十分庞大。但由于其体型小,加之小蠹虫不同种类间的形态相似,难以准确区分。为此采用形态和分子生物学技术对枯死杨树内小蠹虫的种类进行鉴定,同时对该小蠹虫在中国境内的分布进行风险评估,以期为准确识别坡面方胸材小蠹及防控该小蠹虫进一步传播提供参考。
1 材料与方法
1.1 小蠹虫采集及形态鉴定
2019年8月1在江苏省盐城东台林场(120°48′E,32°43′N)枯死杨树中选择有大量小蠹虫蛀道的树干,截取厚约为20 cm的圆盘置于泡沫盒中(425 mm ×300 mm×245 mm),保存于南京林业大学江苏省有害生物预防与控制重点实验室,待小蠹虫羽化后收集该虫并浸泡于75% 酒精溶液中,将其命名为JSYC-beetle,以备后续形态学鉴定和分子生物学鉴定试验使用。
将采集的小蠹虫置于SteREO Discovery V28蔡司体视显微镜(德国卡尔蔡司公司)下拍照,记录小蠹虫头部、前足、前胸背板等主要形态特征,并对小蠹虫鞘翅和前胸背板进行形态测定,其中雌虫测量20头,雄虫测量1头,使用Photoshop CS 6.0对照片进行处理。
1.2 小蠹虫基因组DNA提取
采用CTAB法提取小蠹虫基因组DNA[19],主要步骤如下:①液氮研磨小蠹虫至粉末状,置于1.5 mL 离心管中,加入100 μL 2× CTAB,10 μL二硫苏糖醇(DTT)和 4 μL的蛋白酶,浸没小蠹虫粉末;②涡旋混匀,65 ℃金属浴裂解45 min;③加入等体积氯仿/异戊醇(体积比 24∶1),12 000 r/min 离心 20 min;④取上清,加入 300 μL 冰冻异丙醇混匀,室温条件下静置 30 min;⑤12 000 r/min离心 30 min,弃上清液,70%(体积分数)酒精洗涤自然风干后加20 μL去离子水溶解DNA,置于-20 ℃保存备用。
1.3 引物序列
选取常用基因引物包括COI、28S rDNA以及CAD等对枯死杨树内小蠹虫基因组DNA进行扩增,扩增引物由南京金斯瑞生物科技有限公司合成,具体引物碱基序列见表1[13]。
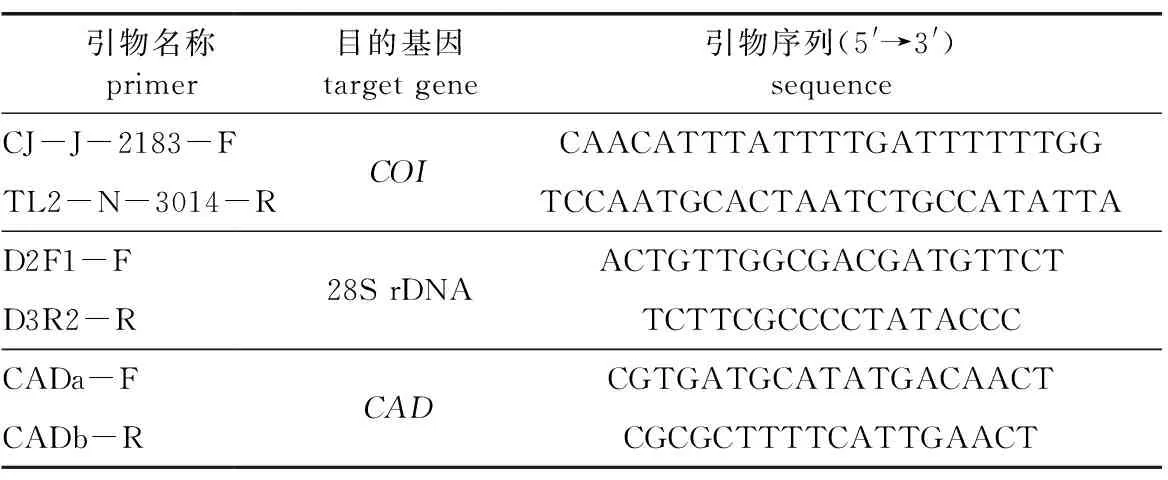
表1 COI、28S rDNA和 CAD引物序列Table 1 Primers sequence of COI,28S rDNA and CAD
1.4 PCR扩增
PCR反应体系50 μL:2 μL的正向引物,2 μL的反向引物,2 μL的模板,25 μL 2×PCR MIX和19 μL ddH20。其中COI扩增程序为:94 ℃预变性4 min;94 ℃变性1 min,45 ℃退火1 min,72 ℃延伸1 min,共35个循环;最后72 ℃条件下延伸10 min。28SrDNA的扩增程序为:95 ℃预变性4 min;95 ℃变性1 min,55 ℃退火45 s,72 ℃延伸1 min,共35个循环;最后72 ℃延伸7 min。CAD扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火30 s,72 ℃延伸40 s,共35个循环;最后72 ℃延伸10 min。
1.5 电泳检测
取PCR扩增产物8 μL,用1.0%(质量分数)的琼脂糖凝胶电泳分离PCR产物(电压为80V,电泳时间为45 min),GelRed 染色,置凝胶于302 nm 透射紫外灯上观察、拍照。
1.6 序列比对以及系统发育树的制作
3个基因的PCR扩增产物送由上海生工生物工程公司测序。用DNAMAN 6.0软件对每个基因正反向测序的结果进行拼接,得到完整序列。将得到的3个基因序列分别在NCBI网站上进行BLAST 相似性比对,查看相似性数据。使用MEGA 6软件,以NJ法构建小蠹虫COI、28S rDNA和CAD的系统发育树,其中COI外群为Ipswoodi,28S rDNA和CAD的外群为Ipsacuminatus。
1.7 坡面方胸材小蠹在中国的风险评估
根据林业有害生物风险分析指标体系[20-21],依据坡面方胸材小蠹在国内分布 (P1),传入、定殖和扩散可能性(P2),潜在危害(P3),受害寄主经济重要性(P4)以及危险性管理难度(P5)等5 个准则层(Pi)分别对其评价赋分,由综合评判公式最终确定其风险值(R),综合评判公式如下:
P1=P11;
P3=0.4×P31+0.4×P32+0.2×P33;
P4=max(P41,P42,P43);
P5=(P51+P52+P53)/3;
风险分级标准设定按照:2.5 ≤R<3.0 为特别危险,2.0 ≤R<2.5为高度危险,1.5 ≤R<2.0 为中度危险,1.0 ≤R<1.5 为低度危险。
2 结果与分析
2.1 坡面方胸材小蠹的形态鉴定
经观测发现(表2,图1),雌虫体色红褐色至黑色(图1),体长3.3~3.7 mm,宽1.49~1.64 mm(表2);雄虫体色黄褐色(图1),体长2.264 mm,宽1.195 mm。该小蠹虫体金属光泽强,触角鞭节5节,第1节长度小于其余各节,触角末节球状,有2条明显的横缝,复眼肾形,从小蠹虫的背面看不到头部,头部无喙,前胸背板近方形状,凸出明显,前缘阔圆形,宽略大于长,前半部分分布鳞状齿,后半部分光滑。小盾片舌状,鞘翅宽略大于前胸背板的宽度,鞘翅斜面从基部至端部逐渐倾斜,鞘翅轮廓如舌,鞘翅列间部上的刻点与沟内刻点大小相近,分布均匀,鞘翅茸毛长。前足胫节具有8~14个齿瘤不等,第1跗节小于其余跗节长度之和,依据以上形态特征初定为坡面方胸材小蠹(图1)。
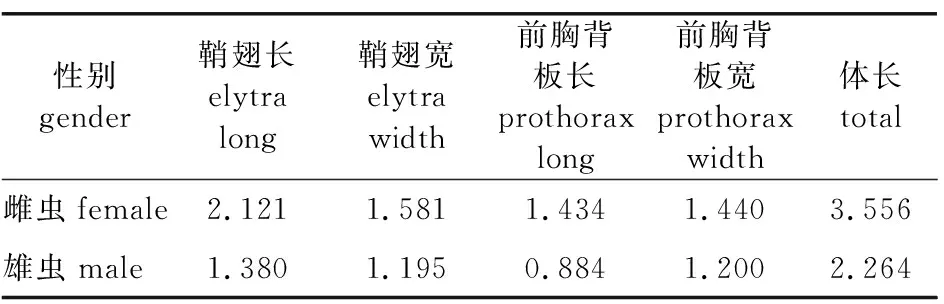
表2 坡面方胸材小蠹形态指标测量值Table 2 The measurement value of E. interjectus mm

A-C. 雄虫male; D-F. 雌虫female; A+D. 背面观dorsal view; B+E. 侧面观lateral view; C+F. 腹面观ventral view。图1 坡面方胸材小蠹形态Fig.1 Optical photograph of E. interjectus
2.2 PCR扩增结果
以坡面方胸材小蠹基因组DNA为模版,分别对COI、28S rDNA和CAD基因进行扩增,电泳结果表明(图2),3对引物均能扩增出单一、明亮条带。其中COI基因扩增引物扩增出的条带大小为700~1 000 bp,28S rDNA基因扩增引物扩增出的条带大小约为500 bp,CAD基因扩增引物扩增出的条带大小为400~500 bp。

M. DL 1 000 DNA marker; 1. COI; 2. 28S rDNA; 3. CAD.图2 坡面方胸材小蠹基因扩增结果Fig.2 Amplification results of E. interjectus gene
2.3 NCBI序列比对和系统发育树分析
经NCBI 序列比对和系统发育树的分析结果见图3。由图3可以看出,该小蠹虫3个基因测序序列在NCBI基因库中均与坡面方胸材小蠹E.interjectus相关基因的相似度最高(其中COI基因比对相似度为99.14%;28S rDNA 基因比对相似度为99.38%;CAD基因比对相似度为99.36%)。基于COI、28S rDNA和CAD,采用NJ法构建小蠹的系统进化树结果显示:本试验收集的小蠹虫JSYC-beetle 虫株均与坡面方胸材小蠹(E.interjectus)聚在一个分支上(图3),进一步确证形态学鉴定结果,即本试验收集的小蠹虫JSYC-beetle虫株为坡面方胸材小蠹。
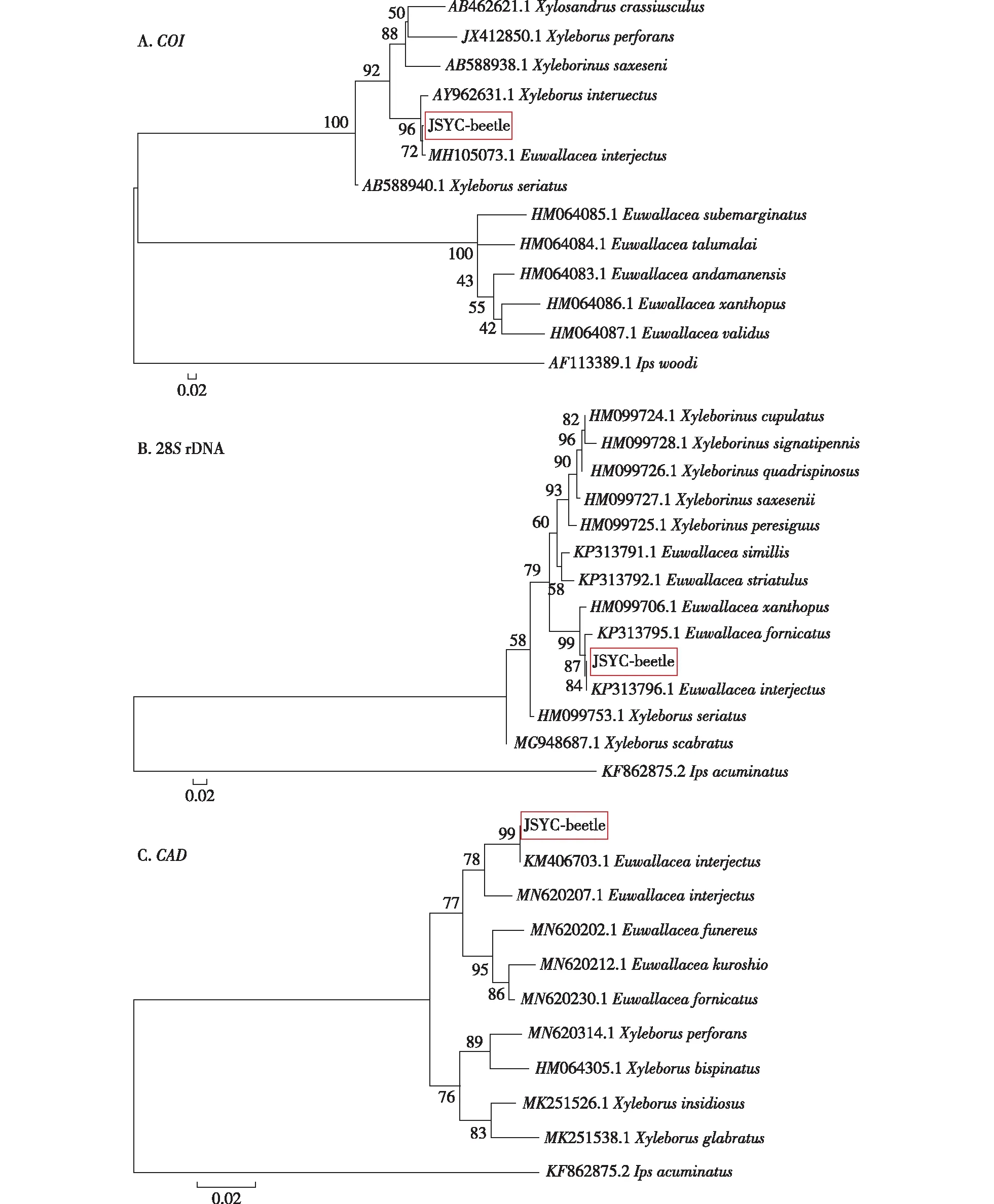
图3 基于邻接法构建的坡面方胸材小蠹系统发育树Fig.3 Neighbor-joining tree of E. interjectus
2.4 坡面方胸材小蠹在中国的风险分析
坡面方胸材小蠹在综合评价赋分体系中的具体赋分值及赋分理由如表 3 所示。经计算,各准则层P1= 1.8,P2= 1.9,P3= 1.88,P4=2.5,P5=2.06,最终计算出风险值R=2.01,对照风险分级标准,坡面方胸材小蠹在中国流行风险性较高,需加强检疫。
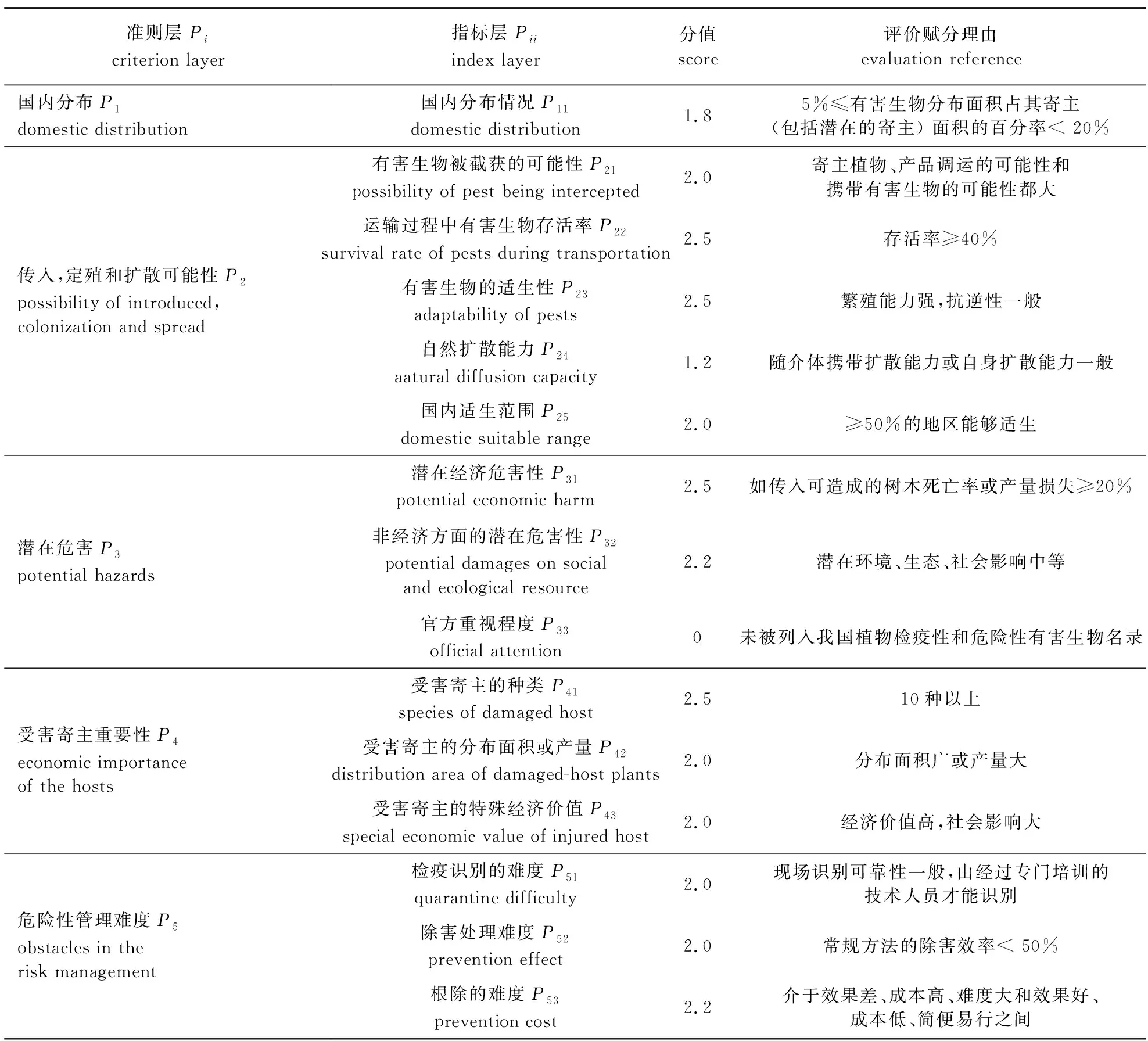
表3 坡面方胸材小蠹多指标综合评价体系Table 3 The index layer evaluation of integrated multi index evaluation system for E. interjectus
3 讨 论
小蠹虫是一类重要的蛀干害虫,根据其食性可分为树皮小蠹和食菌小蠹。方胸材小蠹是唯一能培养真菌的食菌小蠹,是食菌小蠹虫中典型代表,方胸材小蠹可帮助镰刀菌扩散和繁殖,而小蠹培养的镰刀菌则可作为幼虫和成虫的食物资源,两者之间形成强烈的共生关系,称之为镰刀菌-方胸材小蠹共生体(Fusarium-Euwallaceamutualism)[22]。虽然镰刀菌为弱寄生菌,但是可以在多种植物上引起植物枯萎病[23-25],已有文献报道小圆方胸小蠹和小圆方胸小蠹近似种(Euwallaceanr.fornicatus)携带的镰刀菌在Platanus×acerifolia和Perseaamericana上引起严重枯萎病[26-27],但前提是需要携带镰刀菌的小蠹虫入侵寄主植物。此外,日本学者发现坡面方胸材小蠹可以携带无花果角孢菌(Ceratocystisficicola),该病原物可以引发无花果树(Ficuscarica)产生一种系统性病害无花果溃疡病,由于前期对无花果溃疡病的流行规律认识不足,导致该病害已在日本果园广泛存在,对当地的果园造成重大经济损失[28]。因此在日本坡面方胸材小蠹被认为是果园中的一种毁灭性害虫,至今没有良好的防控措施。
方胸材小蠹属昆虫一直被认为是次期性害虫,不会危害健康寄主植物,但随着研究的深入,发现方胸材小蠹属昆虫也可能危害健康寄主植物[22]。2019年,在阿根廷报道种植美洲黑杨(Populusdeltoides)上发现坡面方胸材小蠹,该研究同时指出坡面方胸材小蠹可以危害健康寄主[6]。而本次试验所鉴定的坡面方胸材小蠹从江苏东台枯死杨树中收集,林场内出现大量的杨树死亡,推测可能是由坡面方胸材小蠹以及携带的病原微生物所致。杨树作为我国主要的材用树种,因生长速度快、适应能力强,在我国大面积种植,具有重要的经济和生态价值[29]。坡面方胸材小蠹虽曾多次在调运木材发现,但未被列入检疫名单,而且该小蠹虫体积小,寄生在寄主植物体内,因此在检疫和防治工作中容易被忽略。若坡面方胸材小蠹可以直接危害健康杨树,则会对北方杨树安全构成威胁。对坡面材小蠹在中国风险分析表明,该生物在中国属于高危物种,需要加强检疫。
坡面方胸材小蠹目前在国内虽有,但尚未爆发成灾,因此国内对坡面方胸材小蠹研究较少。本研究以坡面方胸材小蠹为材料,通过传统形态学结合分子生物学技术对该小蠹进行鉴定,为将来防治坡面方胸材小蠹提供支持,但对于坡面方胸材小蠹的具体防治措施还需要建立在小蠹虫生活习性、危害特征以及传播规律的基础之上,因此还需要对坡面方胸材小蠹进行深入研究。

