青岛近海样品中聚丙烯微塑料降解微生物的富集培养及活性研究*
李 肸,张晓华,2,3,于 敏,2,3**
(1.中国海洋大学海洋生命学院,山东 青岛 266003;2.青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,山东 青岛 266237;3.中国海洋大学深海圈层与地球系统前沿科学中心,山东 青岛 266100)
微塑料是指粒径小于5 mm的塑料碎片,广泛存在于海洋环境中[1-3]。微塑料占塑料垃圾的92.4 %[4],主要包括以下几种类型:如聚乙烯(Polyethylene,PE)、聚丙烯(Polypropylene,PP)、聚苯乙烯(Polystyrene,PS)和聚氯乙烯(Polyvinylchloride,PVC)等[3,5-6]。2017年全球的塑料生产已达到3.5亿t,并且在逐年增加[7]。每年约有4×106~1.2×107t的塑料进入海洋,据估计到2050年海洋中的微塑料数量将超过鱼类数量[6]。另外,持久性塑料短期内可以降解为微塑料和纳米塑料并长期存在于海洋环境中[8],对海洋生态环境造成严重影响。近海受人类活动影响较大,渔业、航运、沿海工业、污水处理厂等领域是沿海微塑料入海的主要源头[9],且微塑料的丰度与人口密度之间存在显著相关性[10]。因此,近海也是微塑料污染较为严重的海域。已有研究发现,PE和PP是近海海水和沉积物中存在的主要微塑料类型[11]。这两种微塑料难以降解并在海洋环境中大量积累,造成严重的海洋生态问题。因此,本实验选择PP微塑料作为唯一碳源,对青岛近海微生物进行富集培养、多样性分析及PP降解菌的筛选。
塑料的降解可分为非生物降解和生物降解。非生物降解包括物理降解、光降解和化学降解。非生物降解可以改变聚合物的性质并产生脆化,将塑料降解为微塑料甚至更小粒径的纳米塑料,降解过程非常缓慢[12]。在生物降解塑料的过程中,聚合物由于过大不能渗透进微生物的细胞膜,因此生物降解的第一步是在微生物胞外酶的作用下裂解聚合物的侧链或主链从而形成较小的聚合物单元(如低聚物、单体),微生物可以吸附在这些小分子上并对其进行降解[13]。生物降解是目前最经济环保高效的一种微塑料处理措施。微塑料作为一种新型的海洋基质,水生微生物定植其上并进行传播,这些附着微生物可能对降解微塑料有一定的贡献[7,14-16]。已有研究报道,变形菌门、拟杆菌门和放线菌门细菌是微塑料附着细菌群落的主要优势类群[17],且其多样性与暴露时间、地理位置和微塑料类型有关[2,18]。不同微塑料类型上定植的细菌群落与微塑料基质表面的疏水性质有关[19]。以PP微塑料为唯一碳源富集培养微塑料降解细菌,目前发现降解PP能力较强的细菌主要包括γ-变形菌纲(γ-Proteobacteria)的假单胞菌属(Pseudomonas)[20-21]和弧菌属(Vibrio)[20],厚壁菌门(Firmicutes)的芽孢杆菌属(Bacillus)[21-23]和放线菌纲(Actinobacteria)的红球菌属(Rhodococcus)[23]等。近年来,已有诸多研究关注微塑料附着细菌的群落多样性及微塑料降解菌的功能活性,如Xu等[2]通过16S rRNA基因高通量测序技术,分析了有限时间内中国近海原位海水中微塑料表面细菌群落的多样性,也有研究分析了芽孢杆菌属和红球菌属等细菌对微塑料的降解活性[22-23],但通过富集培养筛选获得微塑料降解细菌的相关研究较少,关于微塑料的生物降解机制仍然没有定论[22]。目前对微塑料生物降解过程的认识大多基于实验室研究,且通常集中于微塑料单一降解机制的研究,在若干降解机制同时发生的环境中微塑料降解相关的研究十分有限[24]。另外,关于微塑料的降解多集中于研究其物理及化学性质的变化,在分子水平上对细菌裂解塑料聚合物的过程仍然是未知的[25]。
本研究通过16S rRNA基因高通量测序技术对青岛近海微生物随富集时间的不同在PP颗粒上的群落演替进行了分析,并对富集40 d后的PP附着细菌进行了分离纯化及鉴定,进一步对获得菌株的PP降解能力进行了检测。本研究旨在揭示以PP微塑料为唯一碳源的富集过程中微生物的群落演替,并结合分离培养获得PP降解能力较强的细菌,为缓解微塑料对海洋生态系统的污染提供潜在降解菌资源。
1 材料和方法
1.1 聚丙烯微塑料
本研究所用聚丙烯(Polypropylene,PP)微塑料为白色球状,直径为4~5 mm,在25 ℃密度为0.9 g/mL。由Sigma Aldrich Chemical Co.(USA)生产(见图1A)。
1.2 采集样品收集与处理
本研究于2019年7月在青岛栈桥(Zhanqiao,ZQ)采集的沉积物及在第三海水浴场(The third bathing beath,SY)采集的海水样品用于富集培养。采集样品用无菌离心管收集,置于冰上随后带回实验室进行富集培养。具体的站位信息见图1B。

(ZQ:栈桥;SY:第三海水浴场。A.PP微塑料颗粒;B.采样图。ZQ:Zhanqiao;SY:The third bathing beach.A.Polypropylene microplastic particles;B.Location of the sample.)图1 PP微塑料颗粒及采样站位图Fig.1 Polypropylene microplastic particles and location of the sample
1.3 培养基
富集所用培养基为以PP颗粒为唯一碳源的矿物盐培养基(Mineral salt medium,MSM)培养基[26]。将MgSO40.2 g,CaCl20.02 g,KH2PO41.0 g,K2HPO41.0 g,NH4NO31.0 g,FeCl30.05 g溶于1 L三蒸水中。用NaOH将培养基pH调至7.0,121 ℃高压灭菌20 min,冷却后添加经紫外灭菌后的0.5 g/L PP于培养基。
采用改良的NA培养基[27]对附着在PP上的细菌进行分离纯化。将胰蛋白胨10 g,牛肉粉3 g,氯化钠5 g溶于1 L 海水中。用NaOH将培养基pH调为7.3左右。121 ℃高压灭菌20 min。固体培养基添加20 g/L的琼脂。
1.4 富集培养
将栈桥采集的沉积物样品(0.5 g样品与50 mL的0.85%无菌生理盐水与混匀),第三海水浴场采集的海水以1%接种量接种于以PP为唯一碳源的600 mL MSM培养基。分设0、7、21、40和60 d 5个时间段,每个时间段各3个平行。以未接种含PP为唯一碳源的MSM培养基作为对照。对照组与实验组均放置在室温下静置培养。
1.4.1 富集水样及PP颗粒的收集 每个时间段取400 mL 富集培养物进行0.22 μm滤膜(直径为47 mm)过滤,滤膜收集在2 mL无菌保种管中,液氮速冻,随后保存在-80 ℃冰箱;同时收集全部的PP颗粒,与滤膜处理相同。
1.4.2 菌株的分离纯化与保藏 收集富集培养40 d后的PP颗粒。将微塑料颗粒置于无菌生理盐水中涡旋振荡3 min,随后将PP颗粒振荡后的生理盐水涂布于NA培养基,放置于28 ℃恒温培养箱中培养,待长出菌落后,按照菌落大小、形态、颜色等特征挑取单菌落,纯化3次后获得纯菌株。纯菌株接种于NA斜面,用15%的甘油保种液(15%甘油:85%的生理盐水,V:V)进行保种并置于-80 ℃冰箱低温保存。
1.4.3 细菌基因组DNA的提取、16S rRNA基因序列扩增及系统发育分析 采用煮沸法或酚-氯仿抽提法[28]提取菌株的基因组。采用细菌通用引物27F[29](5’-AGAGTTTGATCCTGGCTCAG-3’)和1490R[29](GGTTACCTTGTTACGACTT-3’)、PCR扩增体系[30]、酶切体系[30]对16S rRNA基因进行扩增及酶切。酶切产物用1%琼脂糖凝胶电泳检测后挑选条带不同的PCR产物送至生工生物工程(上海)股份有限公司进行测序。采 用 Chromas 软件分析测序所得的16S rRNA 基因序列,去除低质量的测序碱基后得到的有效序列长度约1 400 bp,将序列提交至EZbiocloud (https://www.ezbiocloud.net/)数据库进行序列比对,以16S rRNA基因序列相似性大于等于98.65%作为同种菌株的划分标准[31]。将目的序列与近缘菌株的16S rRNA基因序列用MEGA 7.0 软件以邻接法(Neighbor-Joining)构建系统发育树,1 000 次自展(Bootstrap)评估系统发育树的准确性。
1.4.4 PP降解活性检测 将从富集培养40 d的PP样品上分离得到的细菌进行PP降解活性检测。将细菌接种到新鲜的NA培养基,活化后转接到NB培养基,待菌株长到对数期(OD600为0.4)后以1%及10 %的接种量接种到以PP为唯一碳源的MSM培养基中。每50 mL MSM培养基含0.1 g的PP微塑料。室温培养4周。以不接菌含PP为唯一碳源的MSM培养基为对照。每个菌株设置3个平行。
1.4.5 PP降解率计算 将培养前处理过的微塑料称重并记录,记为W0。将放置在室温培养4周的微塑料过滤回收后,采用70 %乙醇进行四阶段清洗(每个阶段孵育2 min后震荡2 min,重复4次)。清洗后放入50 ℃烘箱中过夜干燥后称重,记为W1。计算公式如下:

1.5 扫描电镜观察
用无菌蒸馏水冲洗栈桥泥样富集40 d后的PP颗粒,以洗去多余的培养基并干燥,以未接菌的PP颗粒作为对照。扫描电镜在0.3 MPa氩气环境,25 mA电流下在塑料球表面喷金后进行观察。
1.6 富集样品DNA的提取及16S rRNA基因高通量测序
采用Power Soil DNA Isolation Kit(MO BIO)试剂盒对每个时间段富集的水样滤膜和PP颗粒上的DNA进行提取。采用NanoDrop ND 2000紫外分光光度计以及琼脂糖电泳检测DNA样品的纯度与浓度。采用微生物通用引物515FmodF,806RmodR进行PCR扩增,检测合格后使用Illumina Miseq平台测序。测序工作委托上海美吉生物医药科技有限公司完成。
样品采用“站位+W/P_富集天数”进行命名,其中W为富集水样,P为富集微塑料样品。如SW_0d,SP_0d。
1.7 数据处理与分析
采用FLASH软件[32]对原始reads进行质控,按照97%相似性使用UPARSE软件[33]对非重复序列进行OTU聚类,获得OTU代表序列,采用Silva数据库对OTU进行注释,最终生成OTU表格。将得到的OTU表按照样品的最小序列数对OTU表进行抽平。在97%的相似度水平上对注释得到的总细菌OTU进行Alpha和Beta多样性分析。Alpha多样性分析主要采用mothur[34]计算Ace指数、Chao I指数、Simpson指数、shannon指数、Coverage指数等;Beta多样性分析通过采用NMDS分析,即非度量多维尺度分析(Non-metric multidimensional scaling)以研究样本群落的相似性或差异性。使用PRIMER6软件中的ANOSIM单因子分析进行组间差异检验。Alpha多样性指数在富集水体样品和微塑料样品之间的差异显著性检验由t检验-平均值的成对二样本分析实现。所有统计学分析及检验都使用SPSS软件及R语言完成。
2 结果与分析
2.1 不同富集时间PP颗粒上附着细菌的多样性和丰富度指数
对20个样品使用Illumina Miseq平台进行16S rRNA高通量测序,共得到1 282 567条序列,按照97%相似度划分得到1 081个OUT(可操纵单元)。按照最小样本序列数对样本进行抽平,抽平后共得到860 660条序列。每个样品抽平后有效序列为43 033条,912个OTU。从抽平后的序列筛选出细菌序列,共860 580条序列,细菌OTU 907个。所有样品的Chao指数在158.50~586.14之间,Shannon指数在0.86~3.05之间(见图2)。SY海水的富集水样Chao I指数明显高于PP样品(P<0.01),说明SY海水的富集水样中细菌丰富度明显高于PP样品;ZQ沉积物富集后,不论是Chao I指数还是Shannon指数,富集水样和PP样品中细菌的丰富度和多样性均没有明显差别(见图2)。随着富集时间的增加,SY海水富集60 d后的细菌多样性明显高于0 d的富集样品(P<0.05),而ZQ沉积物富集60 d后的细菌多样性明显高于富集40、0 d的富集样品(P<0.05)(见图3)。
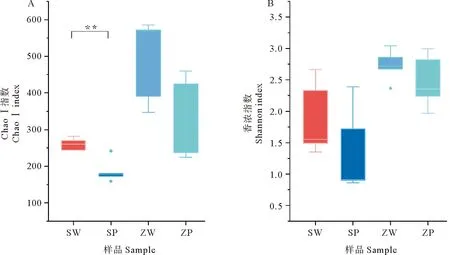
(SW:第三海水浴场海水富集后水样;SP:第三海水浴场海水富集后微塑料样品;ZW:栈桥沉积物富集后水样;ZP:栈桥沉积物富集后微塑料样品。SW:Water sample form the enrichment culture of on the third bathing beach’s seawater;SP:Microplastics sample form the enrichment culture of the third bathing beach’s seawater;ZW:Water sample form the enrichment culture of the Zhanqiao’s sediment;ZP:Microplastics sample from the enrichment culture of the Zhanqiao’s sediment.)图2 以PP为唯一碳源富集培养青岛近海海水和沉积物样品中细菌的Chao I指数(A)和香浓指数(B)箱式图Fig.2 Box plot of bacterial Chao I (A)和 Shannon(B)diversity indexes in enrichment culture of Qingdao’s coastal seawaters and sediment samples using PP as the sole carbon source
2.2 随富集时间的变化PP颗粒上的细菌群落演替
SY海水样品在富集过程中,在PP表面的附着细菌以γ-变型菌纲(γ-Proteobacteria,70.73%~99.37%)和α-变形菌纲(α-Proteobacteria,0.44%~23.39%)为优势细菌类群。富集21 d时放线菌纲(Actinobacteria)细菌丰度增加。而富集培养40 d后,拟杆菌纲(Bacteroidia)细菌丰度明显增加。随着富集时间的增加,α-变形菌纲、拟杆菌纲细菌丰度逐渐增加,γ-变形菌纲细菌丰度逐渐下降(见图4 A)。从属水平看,富集培养40 d时,假单胞菌属(Pseudomonas,75.47%),Methyloversatilis(8.57%),假黄色单胞菌属(Pseudoxanthomonas,2.11%)为富集出的优势属。在富集时间为60 d时,假单胞菌属(50.51%)、Methylotenera(12.59%)、生丝微菌属(Hyphomicrobium,6.34%)和鞘脂菌属(Sphingobium,5.09%)为富集优势属(见图4 B)。
ZQ沉积物富集培养后,PP表面的附着细菌中,优势纲为γ-变形菌纲(43.65%~95.66%),其次为α-变形菌纲(1.14%~45.66%)和拟杆菌纲。富集21 d时,放线菌纲细菌丰度增加。随富集时间的增加,α-变形菌纲、拟杆菌纲、放线菌纲细菌丰度在不断增加(见图4 A)。从属水平看,富集21 d时,假单胞菌属(Pseudomonas,35.44%),扎瓦尔金氏菌属(Zavarzinia,29.14%)、不动杆菌属(Acinetobacter,13.31%)为优势属;富集40 d时,扎瓦尔金氏菌属(29.39%)、亚硝化单胞菌属(Nitrosomonas,11.38%)、生丝微菌属(6.02%)为优势属;富集60 d 时,亚硝化单胞菌属(12.61%)、生丝微菌属(18.71%)和罗思河小杆菌属(Rhodanobacter,12.22%)为优势属(见图4 B)。

(A.SY海水富集水样中细菌和PP附着细菌的chao I指数;B.SY海水富集水样中细菌和PP附着细菌的shannon指数;C.ZQ沉积物富集水样中细菌和PP附着细菌的chao I指数;D.ZQ沉积物富集水样中细菌和PP附着细菌的shannon指数。A.Bacterial Chao I indexes of the water and microplastics samples from the enrichment culture of the third bathing beach’s seawater;B.Bacterial shannon indexes of the water and microplastics samples from the enrichment culture of the third bathing beach’s seawater;C.Bacterial Chao I indexes of the water and microplastics samples from the enrichment culture of the Zhanqiao’s sediment;D.Bacterial shannon indexes of the water and microplastics samples from the enrichment culture of the Zhanqiao’s sediment.)图3 SY海水与ZQ沉积物在不同富集培养时间水样中细菌和PP附着细菌Chao I指数和Shannon指数Fig.3 Bacterial Chao I and Shannon indexes of the water and microplastics samples form enrichment cultures of the third bathing beach’s seawater and the sediment of Zhanqiao at different culture times,respectively
使用NMDS(非度量多维尺度分析)依据PP附着细菌对富集时间、研究站位进行分析,结果表明PP上的附着细菌呈现明显的区域化特征(见图6),大体分为两簇,SY和ZQ样品各聚为一簇。此外,细菌群落随富集时间的不同也表现出明显的差异,相同富集时间的细菌群落聚为一簇,较为相似。
2.3 扫描电镜结果
通过对富集后的PP颗粒进行扫描电镜观察,发现未接种沉积物微生物且放置40 d后的对照组PP颗粒表面光滑平整(见图7A);ZQ沉积物在含PP为唯一碳源的培养基中富集40 d后,PP微塑料样品表面发生明显改变(见图7B),可以看到有细菌附着于PP微塑料表面。
2.4 富集后可培养细菌的多样性
将SY海水、ZQ沉积物样品富集40 d 后的PP样品上的附着细菌用无菌生理盐水振荡后进行分离纯化,共获得40株细菌,分属于3个门、10个属,15个种(见图8)。3个门分别为变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。变形菌门细菌占绝对优势,占分离菌株的87.5%,包括α-变形菌纲、β-变形菌纲和γ-变形菌纲。其中α-变形菌纲细菌共分离获得3个属,3个种,共6株;β-变形菌纲细菌分离获得1个属,2个种,共5株;γ-变形菌纲细菌共分离获得4个属,6个种,共24株。其次拟杆菌门获得2株细菌,其中一株为Sphingobacteriummizutaii,一株为Sphingobacteriumdaejeonense。放线菌门获得3株细菌,其中2株为Microbacteriumresistens,1株为Microbacteriumsuwonense。
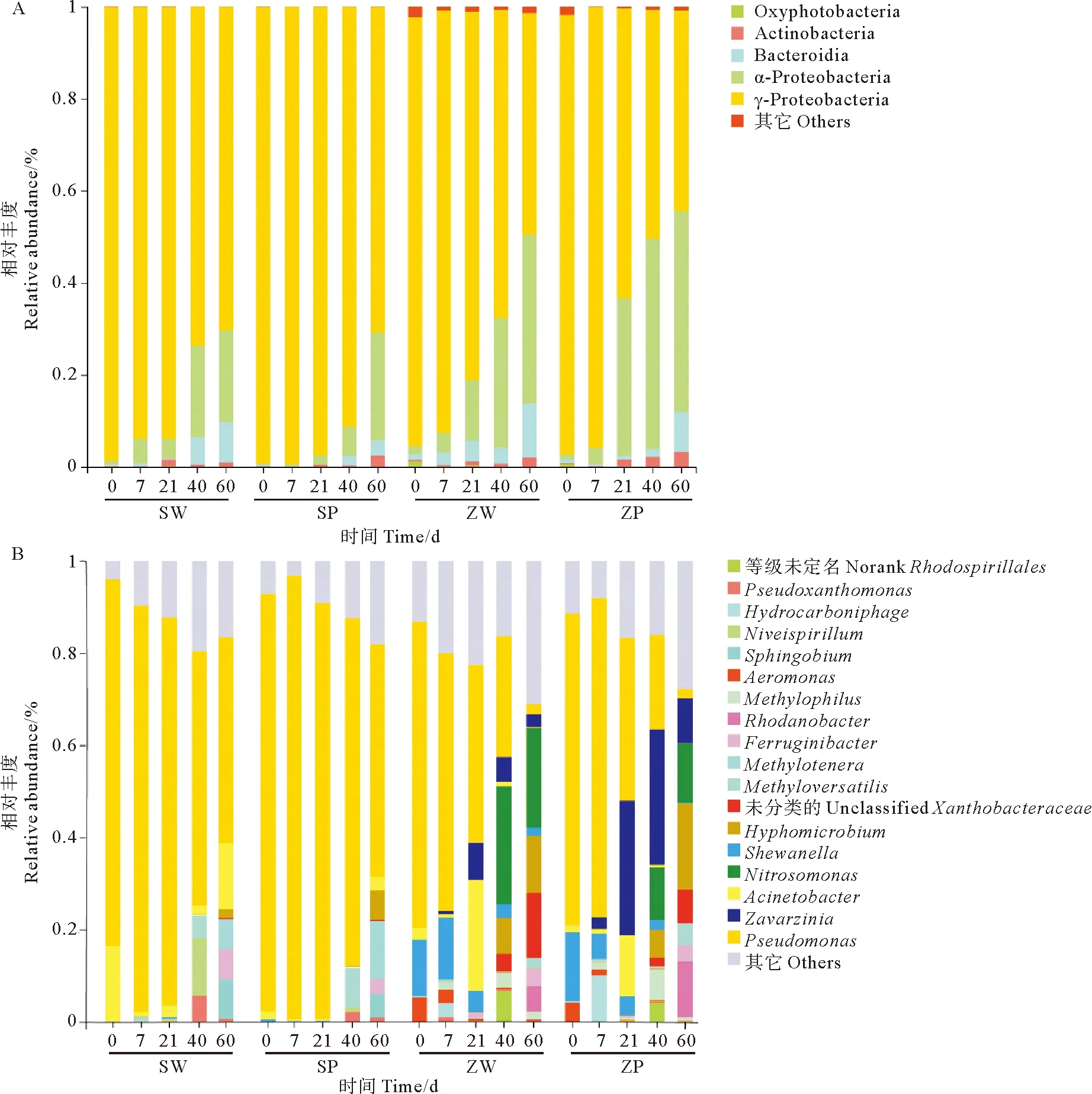
(SW:第三海水浴场海水富集后水样;SP:第三海水浴场海水富集后微塑料样品;ZW:栈桥沉积物富集后水样;ZP:栈桥沉积物富集后微塑料样品。SW:Water sample form the enrichment culture of on the third bathing beach’s seawater;SP:Microplastics sample form the enrichment culture of the third bathing beach’s seawater;ZW:Water sample form the enrichment culture of the Zhanqiao’s sediment;ZP:Microplastics sample from the enrichment culture of the Zhanqiao’s sediment.)图4 不同富集培养时间细菌群落在纲水平(A)和属水平(B)上的相对丰度Fig.4 Relative abundance of bacterial community at the class (A)and genus (B)levels at different culture times

(SW:第三海水浴场海水富集后水样;SP:第三海水浴场海水富集后微塑料样品;ZW:栈桥沉积物富集后水样;ZP:栈桥沉积物富集后微塑料样品。SW:Water sample form the enrichment culture of on the third bathing beach’s seawater;SP:Microplastics sample form the enrichment culture of the third bathing beach’s seawater;ZW:Water sample form the enrichment culture of the Zhanqiao’s sediment;ZP:Microplastics sample from the enrichment culture of the Zhanqiao’s sediment.)图5 不同富集培养时间PP微塑料附着细菌群落中丰度前10的细菌科Fig.5 Most abundant (top 10)bacterial families (OTUs)present in the PP microplastic-associated bacterial communities at different culture times
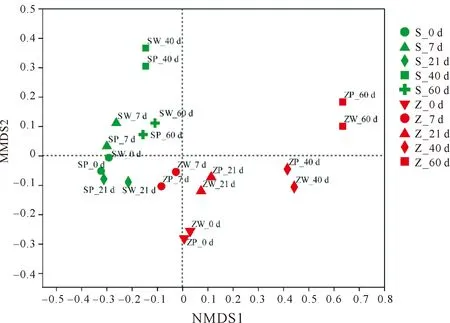
(SY的富集样品为绿色,ZQ富集样品为红色。相同的富集时间的样品形状相同。The enrichment samples of the third bathing beach are green,and the enrichment samples of the Zhanqiao are red.Samples with the same enrichment time have the same shapes.)图6 青岛近海微生物不同富集培养时间的细菌群落NMDS分析(stress=0.081)Fig.6 NMDS analysis of the bacterial community in the enrichment cultures of Qingdao’s coastal seawaters and sediment samples at different culture times (stress=0.081)
2.5 分离菌株降解PP的降解率
对富集40 d后的PP颗粒上分离得到的细菌选取15株不同种细菌进行PP降解活性的检测。分别以1%、10%接种量接种于含PP为唯一碳源的MSM培养基中,室温培养4周后,发现不论接种量为1%还是10%,铜绿假单胞菌LXI681(Pseudomonasaeruginosa)、反硝化无色杆菌LXI668(Achromobacterdenitrificans)对PP都有一定的降解作用,且在接种量为10%时,PP降解率分别达2.5%和0.57%。当接种量为1%时,石油假单胞菌LXI654(Pseudomonasoleovoranssubsp.oleovorans)、鞘氨醇杆菌LXI671(Sphingobacteriummizutaii)和罗思河小杆菌LXI601(Rhodanobactersoli)对PP有较高的降解率;抗逆微杆菌LXI659(Microbacteriumresistens)、弯曲假单胞菌LXI602(Pseudomonasgeniculata)对PP没有降解作用(见图9)。

(A.对照组;B.实验组。A.Control group;B.Experimental group.)图7 栈桥沉积物富集40 d后微塑料样品的扫描电镜图Fig.7 Scanning electron microscope (SEM)of microplastic samples from the enrichment culture of the Zhanqiao’s sediment after 40 days of cultivation
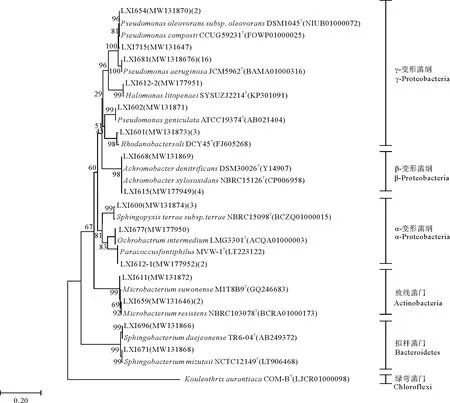
(选取绿弯菌门的Kouleothrix aurantiaca COM-B作为外种群,系统发育树上的数字代表自展值,括号中的编号和数字分别代表Genbank登录号和属于相同种的细菌菌株数。Kouleothrix aurantiaca COM-B from Chloroflexi is used as an out-group.Numbers at each branch point indicate the bootstrap values.The numbers inside brackets represent the Genbank accession numbers and the amount of strains within the same species.)图8 PP颗粒上分离获得的40株细菌的系统发育进化树Fig.8 Phylogenetic tree of 40 bacteria strains isolated from PP particles

图9 富集培养获得菌株的PP微塑料降解率Fig.9 Degradation rate of PP microplastics by the isolated bacterial strains from the enrichment
3 讨论
微塑料普遍存在于表层海水、深海、沉积物甚至是极地等极端环境中,严重影响了海洋生物的安全和健康。PP为近海主要的微塑料污染类型,难以降解导致其在海洋中大量积累,因此,解决微塑料造成的海洋污染逐渐引起科学家的重视。目前研究微生物在PP颗粒上的群落演替及PP降解微生物的筛选、活性检测等相关的研究较少。故本实验采用以PP为唯一碳源对青岛近海微生物进行富集培养,以期揭示微生物在PP微塑料上的优势类群并获得潜在的PP降解菌为缓解塑料污染带来的海洋生态问题提供微生物菌种资源。
通过对青岛近海微生物以PP为唯一碳源进行富集培养,其16S rRNA高通量测序结果表明,采用SY海水样品进行富集培养时,富集水样中的细菌丰富度明显高于富集微塑料样品。这一结果与Zettler等[35]分析北大西洋海水和PP微塑料上细菌群落的α-多样性结果一致。Harrison等[36]在研究中也指出微塑料上的微生物群落不同于周围海水,微塑料为微生物提供了新型的栖息地,特别是在早期定植阶段,微生物会选择性的附着在微塑料上。然而,采用栈桥沉积物富集培养时,富集水样与微塑料样品中细菌的多样性与丰富度没有明显区别。这可能与沉积物中微生物的多样性及富集培养时间有关。随富集时间的增加,PP附着细菌的多样性增加(见图3)。Lobelle等[15]发现随培养时间的增加,塑料的亲水性不断增加,生物被膜的产生量也不断增加。故推测富集培养早期细菌群落多样性低,可能由于微塑料的疏水性且表面营养物质匮乏从而不利于早期细菌的定植;富集培养后期,微塑料表面细菌多样性增加,可能由于生物被膜的形成改变了微塑料表面的性质使其利于细菌定植。NMDS分析结果显示相同富集时间的群落聚为一簇,表明相同富集时间细菌的群落结构较为相似,不同富集时间附着在微塑料上的细菌群落存在明显差异。这一结果与Xu等[2]在中国近海研究微塑料上细菌的群落演替结果较为一致。另外,微塑料上的细菌群落与样品来源和微塑料类型有关,不同的样品来源和微塑料类型,在富集培养过程中微塑料上的附着细菌群落有明显差异[18-19]。
本研究在分析微塑料附着细菌的物种组成时,发现不论是富集培养ZQ沉积物样品还是SY海水样品,γ-变形菌纲、α-变形菌纲细菌在PP微塑料上均占主导地位。该结果与Curren等[37]在研究热带沿海环境微塑料上的细菌群落组成相似。另外,Xu等[2]在研究中国近海海域细菌对地理位置、暴露时间和塑料类型的响应及群落演替中,发现γ-变形菌纲、α-变形菌纲、黄杆菌纲在微塑料(PP和PVC)附着细菌群落中占主导地位。需要注意的是,在富集培养早期,富集水样中的细菌群落与已报道的海水、沉积物微生物群落组成有所区别,推测是由于近海海域受人类活动影响较大从而影响其群落结构。
本研究在富集培养SY海水样品及ZQ沉积物后期,PP微塑料上丰度较高的科为假单胞菌科(Pseudomonadaceae)、Acetobacterales_Incertae_Sedis、亚硝化单胞菌科(Nitrosomonadaceae)、生丝微菌科(Hyphomicrobiaceae)、Rhodanobacteraceae和黄单胞菌科(Xanthomonadaceae)(见图5)。已有研究表明微塑料可以作为碳源为海洋微生物提供能量[20-23]。研究发现,从不同环境中分离出的假单胞菌属细菌可以降解多种微塑料,如PE、PP、PS、PVC、PET等[38]。Gyung Yoon等[39]从原油污染严重的海滩样品中分离出的假单胞菌属细菌具有降解低密度聚乙烯(Low-Molecular-Weight Polyethylene)的能力。因此,本研究以PP为唯一碳源富集培养获得的假单胞菌属细菌可能具有PP降解潜力。Amaral-Zettler等[40]从2013年7—11月在美国马萨诸塞州伍兹霍尔码头进行了海洋微生物在高密度聚乙烯(High-Density Polyethylene)上的原位定植实验,通过二代测序技术发现,随时间的推移黄单胞菌科细菌丰度增加,与本研究结果相似。Brandon等在分析粉虫肠道菌群中发现黄单胞菌科细菌与PS降解相关,因此推测富集后期丰度较高的黄单胞菌科细菌也具有PP降解潜力。另外,ZQ沉积物富集后期,PP附着细菌群落中扎瓦尔金氏菌属细菌的丰度增加,表明其可能具有PP降解潜力。Tourova 等[41]发现扎瓦尔金氏菌属细菌具有降解PS基因的操纵子,可能具有PS降解潜力。然而,在本研究的分离培养实验中,未获得扎瓦尔金氏菌属细菌菌株,可能与分离培养条件不适合其生长有关,在后续对微塑料降解菌的富集培养和分离纯化中应考虑采用多种培养基,包括以微塑料为唯一碳源的培养基进行筛选,以获得更多的微塑料降解菌。
本研究对选取的15株不同种细菌进行了PP微塑料降解活性检测。结果表明,当以10%接种量接种到含PP微塑料为唯一碳源的培养基中,室温培养4周后,铜绿假单胞菌LXI681、反硝化无色杆菌LXI668对PP微塑料有一定的降解活性,降解率分别为2.5%和0.57%。Rajandas等[42]发现在两个月的时间里,铜绿假单胞菌可以降解50.5%的低密度聚乙烯,而本实验中分离得到的铜绿假单胞菌LXI681在室温放置4周后对PP的降解率为2.5%,降解率较低。在Arkatkar等[43]的研究中也发现PP不论有无化学处理,生物都很难对其降解。因此后续降解实验可适当延长培养时间以增加其降解率。此外,Kowalczyk等[44]的研究证实无色杆菌属细菌对高密度聚乙烯有一定的生物降解作用,而本实验筛选得到的反硝化无色杆菌LXI668对PP有一定的降解能力,表明同种微塑料降解菌可能对多种类型的微塑料均具有一定的降解能力。
综上,本研究通过16S rRNA高通量测序技术分析了研究青岛近海微生物随富集时间的不同在PP颗粒上的群落演替,揭示了富集后期PP微塑料上附着细菌的优势类群。通过筛选发现了具有PP降解活性的细菌如铜绿假单胞菌LXI681、反硝化无色杆菌LXI668,丰富了PP微塑料降解细菌资源库,对缓解海洋微塑料污染及改善海洋生态具有重要的应用价值。

