中华蛸寄生丛集球虫(顶复亚门: 丛集球虫科)新种的形态学与分子生物学研究*
任 静 何卫彤 王丽华 唐 艳 郑小东①
(1. 中国海洋大学海洋生物多样性与进化研究所 青岛 266003;2. 中国海洋大学海水养殖教育部重点实验室 青岛 266003)
中华蛸(Octopus sinensisd’Orbigny, 1841)隶属于软体动物门(Mollusca)、头足纲(Cephalopoda)、八腕目(Octopoda)、蛸科(Octopodidae)、蛸属(Octopus), 主要分布在太平洋西北部(Guerraet al, 2010; Gleadall,2016), 曾被认为是真蛸(O. vulgarisCuvier, 1797)的同物异名(Warnkeet al, 2004; Okumuraet al, 2005;Iglesiaset al, 2007)。近年来, 基于形态特征和分子生物学分析, 从物种水平上将中华蛸与真蛸分开(Guerraet al, 2010; Amoret al, 2014; Gleadall, 2016)。中华蛸生长快, 具有重要的商业价值和开发潜力(Garridoet al, 2018; Danet al, 2019)。近几年, 有关中华蛸养殖和饵料选择(Danet al, 2018, 2019)、分类研究(Amoret al, 2017)等方面的研究相继开展, 但有关中华蛸寄生虫和疾病诊断等方面鲜有报道。
丛集球虫隶属于粘孢子总门(Myzozoa)、顶复亚门(Apicomplexa)、类锥体纲(Conoidasida)、真球虫目(Eucoccidiorida)、丛集球虫科(Aggregatidae)、丛集球虫属(Aggregata), 是头足类消化道中一类常见的寄生虫(Castellanos-Martínezet al, 2019)。丛集球虫的生命周期包括无性生殖阶段和有性生殖阶段, 无性生殖又称为裂体生殖, 有性生殖阶段包括配子生殖和孢子生殖, 在孢子生殖阶段, 丛集球虫的成熟卵囊内包含大量的孢子囊, 孢子囊中有子孢子。丛集球虫营异主寄生(Dobell, 1925; Hochberg, 1990), 在其生活史中,无性生殖阶段寄生在中间宿主-甲壳类动物中, 有性生殖阶段寄生在终宿主-头足类动物中(Dobell, 1925;Gestalet al, 2002), 具有感染性的子孢子包含在孢子囊中, 这些孢子囊可通过头足类动物的粪便释放到海洋中进而感染甲壳类中间宿主(Castellanos-Martínezet al, 2019)。
目前, 有关丛集球虫的记录有限, Poynton 等(1992)通过石蜡切片对Aggregata dobelli和A.millerorum的表型特征进行描述。Gestal 等(1999)通过扫描和透射电子显微镜及原子力显微镜技术研究了A. octopiana孢子发育阶段的不同形态和细胞学结构。随着分子生物学的发展, 分子标记技术为头足类寄生虫形态学鉴定与诊断提供了新手段, 成为分类学的重要补充。Kopečná 等(2006)分析了寄生于头足类中的丛集球虫属的系统发育关系, 首次分析了丛集球虫的系统发生地位。随后, 相关研究结合表型特征及18S rRNA 核苷酸序列成功鉴定出丛集球虫属Aggregata eberthi及A. octopiana两新种, 并对发生在欧洲水域的这两种丛集球虫的系统发育状况进行了评估(Castellanos-Martínezet al, 2013; Tedescoet al,2017)。近年来, 在东北太平洋、东北大西洋、西北印度洋、西南大西洋、西地中海等海域均有丛集球虫的报道(Labbé, 1895; Narasimhamurti, 1979; Poyntonet al, 1992; Gestalet al, 2000, 2005, 2010; Sardellaet al,2000), 然而国内对于丛集球虫的研究较少, Ren 等(2019)在大规模死亡的短蛸中发现了丛集球虫, 截至目前, 于长蛸和短蛸中鉴定出一个丛集球虫新种(任静, 2021)。本研究在中华蛸体内鉴定出的丛集球虫为一新种, 是对丛集球虫属生物学资料的补充, 同时也为中华蛸疾病诊断和组织病理学研究提供参考。
1 材料与方法
1.1 样品采集
野生中华蛸采自福建连江(26°16′N, 119°47′E)以及浙江南麂岛(27°29′N, 121°01′E), 经解剖观察, 被丛集球虫感染的中华蛸个体共31 只, 主要感染位置为中华蛸消化系统中的盲囊和肠。被感染中华蛸的胴背长、体重、采集地等信息均被详细记录(表1)。
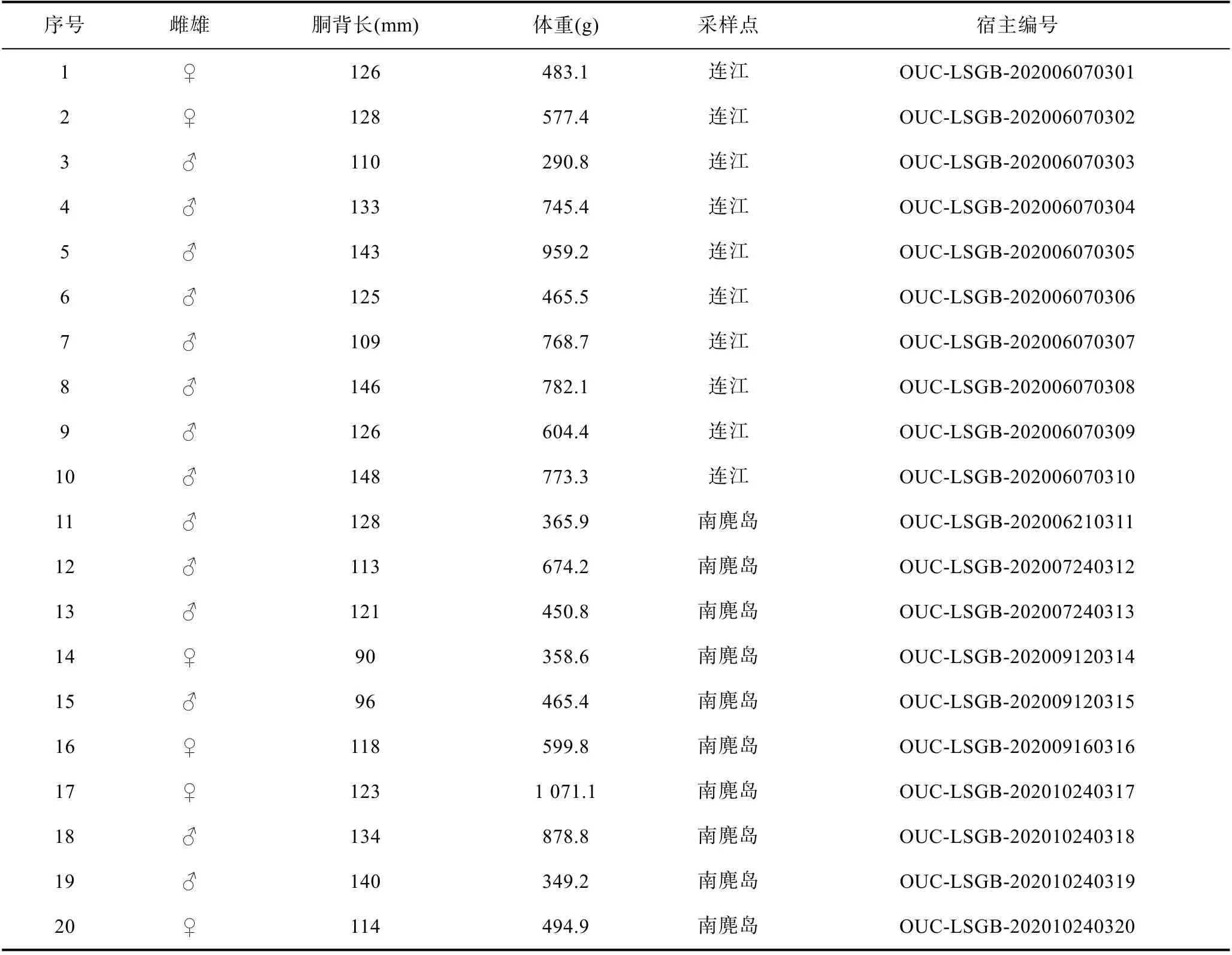
表1 被丛集球虫感染的中华蛸样品信息Tab.1 Sampling information of O. sinensis infected by Aggregata

续表
1.2 形态学鉴定
从鲜活中华蛸盲囊中分离出卵囊, 制成临时玻片标本, 采用光学显微镜(Olympus BX53)下观察其形态特征并拍照, 测定丛集球虫孢子生殖阶段的卵囊、孢子囊和子孢子各项形态特征数据。对卵囊、孢子囊和子孢子进行测量, 用微米(μm)表示, 并计算其平均值和标准偏差。将严重感染的盲囊和肠组织固定于波恩试剂中, 乙醇梯度脱水, 石蜡包埋, 使用切片机(Leica RM2016)切片。切片厚度为5 μm, 用苏木精和伊红染色(Cullinget al, 1985), 制成永久玻片标本,然后观察孢子囊内的子孢子, 拍照并统计数目。
扫描电镜(SEM)样品取自宿主盲囊, 将丛集球虫的白点状卵囊置于2.5%戊二醛固定液中固定4 h, 用匀浆法制备分离的孢子囊。乙醇梯度脱水, 分离的孢子囊用液态CO2进行临界点干燥, 喷金镀膜处理后(Gestalet al, 1999)用扫描电子显微镜(VEGA3)观察并拍照。透射电镜(TEM)样品为分离的丛集球虫卵囊,置于2.5%戊二醛中固定4 h, 清洗后置于锇酸固定液中, 乙醇梯度脱水, 包埋, 通过钻石刀切片并进行染色, 用透射电子显微镜(JEM1200)电镜下观察。
1.3 分子生物学鉴定
丛集球虫卵囊中提取总DNA。取大约50 mg 卵囊悬浮于600 μL 提取缓冲液中, 使用超声波细胞破碎仪破碎, 加入蛋白酶K 消化过夜, 参照苯酚-氯仿法提取DNA (Sambrooket al, 1989), 质量检测合格后的DNA 置于–20 °C 保存备用。
对基因组DNA 中18S rRNA 小亚基进行扩增, 所用引物为Primer1-F: 5′-GGGGGTATTTGTATTTAAC AAGCA-3′, Primer1-R: 5′-CCTACGGAAACCTTGTT ACGA-3′ (Castellanos-Martínezet al, 2013)。目的片段长度约为800 bp, PCR 扩增采用50 μL PCR 体系, 包含5 μL 10×PCR buffer, dNTPs 0.2 mmol/L, MgCl22 mmol/L, Primer1-F 0.25 μmol/L, Primer1-R 0.25 μmol/L, 模板DNA 100 ng,TaqDNA 聚合酶2 U。反应程序为: 94 °C 预变性10 min, 随后循环35 次包括94 °C 变性1 min, 51 °C 退火1 min, 72 °C 延伸1 min, 最后72 °C 延伸10 min。扩增产物在1.5%琼脂糖凝胶电泳下检测, 生工生物有限公司双向测序。18S rRNA 基因序列已上传至 GenBank (Nos:MW577122、MW577123、MW577124、MW577125、MW577126、MW577127、MW577128、MW577129、MW577130 和MW577131)。
用DNASTAR 软件包中的Seqman 软件对测序结果进行排列校对, 将本研究获得的18S rRNA 基因序列在GenBank 数据库中进行Blast 比对, 下载近缘物种的 18S rRNA 基因序列, 选用Eimeria bovis(U77084)和E. arnyi(AY613853)作为外群, 使用MEGA 6.0 中的Clustal W 将全部序列进行多重比对分析(Tamuraet al, 2013), 去掉前后不整齐的较长序列, 保留中间的gap 区域。在构建系统发育树之前,用jModelTest 2.1 软件(Darribaet al, 2012)计算似然值的核苷酸进化模型, 在AIC 标准下采用默认设置, 筛选出最优模型为GTR+G。系统发育分析采用最大似然法(Maximum Likelihood, ML)和贝叶斯法(Bayesian Inference, BI), 分别使用软件MEGA 6.0 和MrBayes 3.2 (Ronquistet al, 2012)构建系统发育树。在最大似然法(ML)分析中, 进化树的节点可靠性通过1 000 次重复抽样分析进行评估。在贝叶斯法(BI)的分析中,在马尔科夫链蒙特卡洛分析(Markov chain Monte Carlo, MCMC)命令指导运行了100 万代, 每1 000 代采样一次, 每1 000 世代保存一次取样树。待分裂频率标准误差小于0.01 后, 去除25%的老化样本。最终获得的系统发育树使用软件 FigTree 1.4.2 编辑(Rambautet al, 2008)。
2 结果
2.1 多刺丛集球虫, 新种, Aggregata octaculeata sp.nov.
终宿主: 中华蛸(Octopus sinensis)
寄生部位: 盲囊和肠组织及内部
发现地点: 福建连江(26°16′N, 119°47′E)以及浙江南麂岛(27°29′N, 121°01′E)
词源, 拉丁语, oct=八, 亦为蛸属的前三个字母,aculeata=多刺的, 是以终宿主蛸属的前三个字母加该种丛集球虫孢子囊有刺的结构特征命名。
模式标本存放处: 中国海洋大学水产学院标本室, OUC-LSGB-HE0045
2.2 形态描述
被感染的中华蛸样本有31 个(18 个雄性个体和13个雌性个体), 体重(total weight, TW)为130.8—2140.0 g,胴背长(mantle length, ML)为70—199 mm, 丛集球虫主要分布于盲囊和肠组织内部(图1)。

图1 丛集球虫分布Fig.1 Distribution of Aggregata
新鲜丛集球虫压片, 结果显示, 成孢子化的卵囊(n=10)白色, 呈近球形或椭球形, 长径为653.6—806.5 μm [(717.3±55.9) μm], 宽 径 为 588.1—787.1 μm[(663.3±58.2) μm] (图2a)。孢子囊(n=30)为卵球形或椭球形, 孢子囊长径为22.4—26.1 μm [(24.3±0.8) μm], 宽径为20.5—24.6 μm [(22.4±1.0) μm] (图2b, 2c)。
扫描电镜结果同样显示孢子囊(n=30)为卵球形或椭球形, 孢子囊(图3d, 3e, 3f)长径为16.5—20.8 μm[(17.9±1.0) μm], 宽径为 14.9—19.6 μm [(16.8±0.9)μm]。孢子囊壁(图3e, 3h)为双层, 外层膜状且光滑, 内层较厚且有刺, 它们紧密地连接在一起, 并有明显的裂缝线(ds) (图3f)。我们从新鲜压片中分离出子孢子(n=10), 呈卷曲状, 其长度为22.2—28.6 μm [(25.6±1.9)μm], 宽度为3.0—5.0 μm [(4.0±0.7) μm] (图2d)。
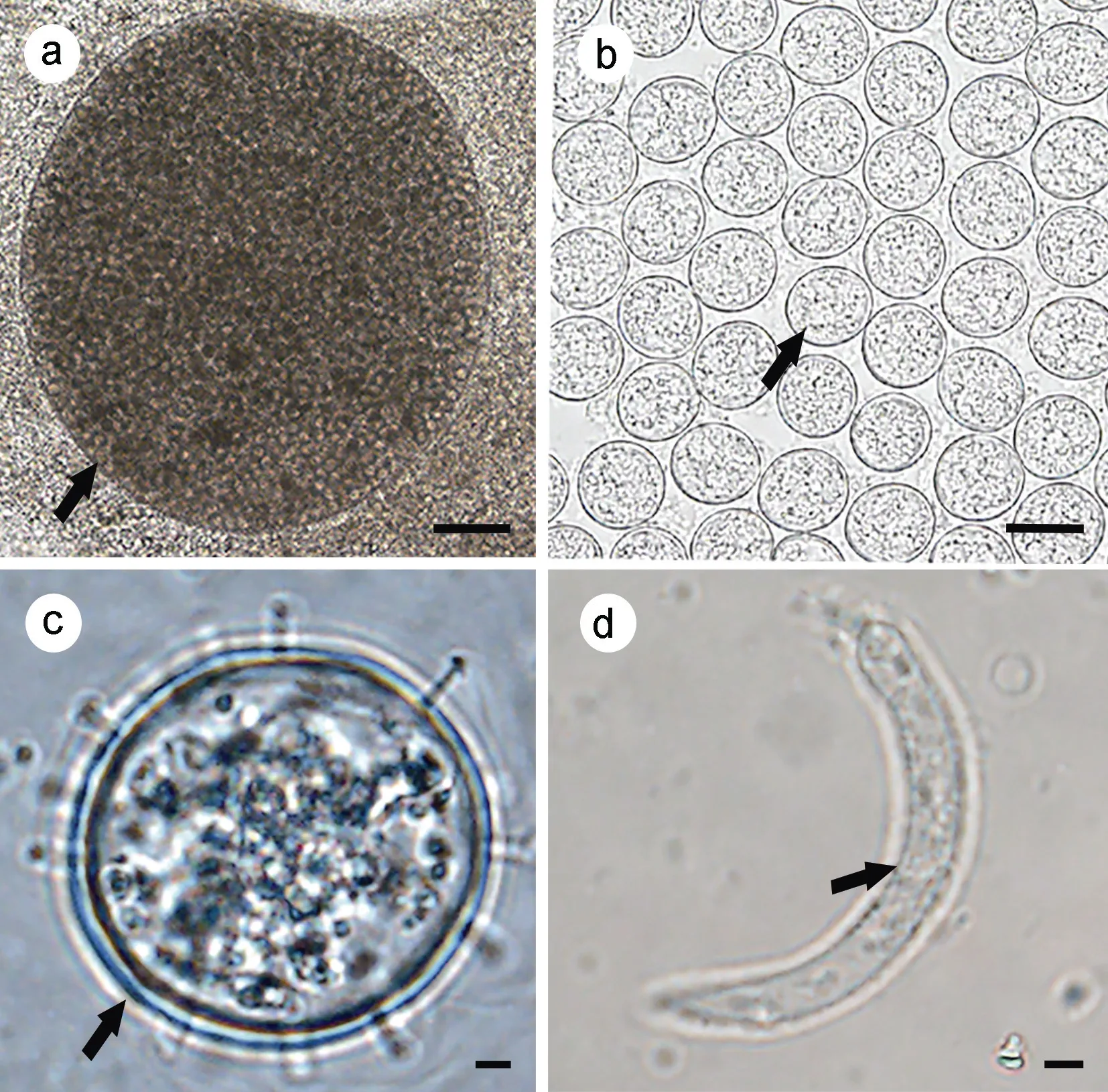
图2 丛集球虫形态Fig.2 Morphology of Aggregata
经组织学观察, 严重感染的中华蛸盲囊组织会被大量的丛集球虫卵囊替代(图3a), 在被感染的中华蛸盲囊中可以观察到丛集球虫的孢子生殖阶段(图3b,3d—3j)和配子生殖阶段(图3c)。在丛集球虫的生活史中, 配子生殖阶段的一个小配子和一个大配子(图3c)结合能够产生合子, 从而进入孢子生殖阶段, 合子会长成一个具有众多细胞核的孢向虫(图3b), 其特征是细胞质表面有众多细胞核排列。单个核及细胞质出芽,形成单核球形孢子母细胞。孢子母细胞会进一步发育,成为孢子囊(图3d—3j), 孢子囊内部的细胞核和细胞质分裂形成子孢子。组织学切片结果显示孢子囊内子孢子的数目在8—13 个之间(图3i, 3j)。

图3 组织学切片下的丛集球虫形态和电镜下的孢子囊形态Fig.3 Histological section of Aggregata and morphology of sporocysts under SEM and TEM
2.3 基于18S rRNA 基因序列的丛集球虫系统发育分析
两种方法构建的系统发育树均具有很高的支持度, 拓扑结果强烈支持了丛集球虫科Aggregatidae 为单系发生, 中华丛集球虫A. sinensis和A. octopiana的亲缘关系最近, 与A. eberthi形成姐妹群, 最后与本研究中的多刺丛集球虫A. octaculeata聚在一起。此外, 研究结果强烈支持了[(Aggregatidae+Cryptosporidiidae) + Haemogregarinidae] + Adeleidae的系统发生关系(图4)。

图4 最大似然法和贝叶斯法构建的类锥体纲18S 的系统进化树Fig.4 Phylogenetic relationships of Conoidasida by maximum likelihood and Bayesian methods
3 讨论
传统上丛集球虫的形态学鉴定依赖于孢子生殖阶段的形态特征, 依据光学显微镜下观察到成熟孢子囊的大小、孢子囊壁的结构、每个孢子囊内子孢子的数目以及子孢子大小等形态学特征(Gestalet al,2002, 2005, 2010)。本研究通过在光学显微镜下观察新鲜丛集球虫压片, 发现丛集球虫的孢子囊大小为24.3×22.4 μm, 与其他丛集球虫相比, 孢子囊仅小于A. bathytherma的孢子囊(28.7×27.9 μm) (Gestalet al,2010) (表2)。扫描电镜结果显示,A. octaculeata孢子囊大小为17.9×16.8 μm, 这与真蛸体内A. octopiana的孢子囊(11—15 μm)大小存在较大差异(Gestalet al,1999)。丛集球虫具有宿主特异性,A. octaculeata和A. octopiana分别寄生于不同宿主, 支持了中华蛸作为不同谱系从真蛸中分开的研究结果(Guerraet al,2010; Amoret al, 2014; Gleadall, 2016)。而本研究中孢子囊在扫描电镜和新鲜压片中的测量结果差异较大,推测因扫描电镜前期经过固定、脱水等处理方式所致。中华蛸中的A. octaculeata孢子囊壁有刺(图3d,3f), 除此之外,A. octopiana的孢子囊壁也有凸起(Gestalet al, 1999; Castellanos-Martínezet al, 2013),其他丛集球虫孢子囊壁均光滑(Poyntonet al, 1992;Gestalet al, 2000, 2005, 2010; Sardellaet al, 2000) (表2)。多刺丛集球虫A. octaculeata子孢子包含在孢子囊内, 长度为25.6 μm, 仅小于A. bathytherma的子孢子长度(49 μm) (Gestalet al, 2010)。

表2 丛集球虫属内各物种孢子生殖阶段主要特征的比较Tab.2 Comparison in morphology of the sporogonic stages for species of Aggregata from cephalopod hosts
在头足类体内, 丛集球虫能够引发宿主感染,导致盲囊上皮细胞脱落和结缔组织破裂, 造成黏膜萎缩和溃疡(Castellanos-Martínezet al, 2019)。目前已在真蛸体内发现A. octopiana分布于鳃、腕等组织处, 导致血细胞浸润, 甚至造成组织坏死(Mladineoet al, 2007), 丛集球虫迁移到消化道外被称为肠外球虫病(Mladineoet al, 2007; Castellanos-Martínezet al, 2019), 但在本研究中未发现中华蛸的肠外球虫病。多刺丛集球虫主要感染中华蛸的盲囊和肠组织,在其他组织部位中并未发现。而严重感染的中华蛸盲囊及肠组织会被大量的丛集球虫卵囊替代(图3a),从而造成组织损伤。有关研究表明丛集球虫感染不是章鱼的致死因素(Hochberg, 1990), 可能是高密度的丛集球虫感染使章鱼更容易受到其他问题的影响, 如运输和温度的剧烈变化造成的应激(Poyntonet al, 1992)。
研究表明, 寄生虫之间与宿主之间的系统发育关系不一致。虽然真蛸与中华蛸的亲缘关系非常近(Gleadall, 2016), 但本研究中的系统发育结果显示,寄生于中华蛸中的A. octaculeata与寄生于真蛸中的A. octopiana并没有聚在一起, 与其他丛集球虫相比,亲缘关系相对较远。
4 结论
在本研究中, 我们从中华蛸体内发现了一种丛集球虫新种, 命名为多刺丛集球虫Aggregata octaculeatasp. nov., 形态学结果显示, 该物种孢子生殖阶段包括成熟孢子囊和子孢子, 孢子囊为卵球形或椭球形, 孢子囊壁为双层, 外层膜状且光滑, 内层较厚且有刺。基于18S rRNA 分子序列的系统发生结果进一步证实物种隶属于丛集球虫属, 并高度支持了属内[(中华丛集球虫A. sinensis+A. octopiana) +A.eberthi] + 多刺丛集球虫A. octaculeata的系统发生关系。本研究的形态学和分子学数据为进一步研究头足类寄生虫分类学及系统发育进化提供基础资料, 对蛸类分类提供辅助依据, 同时也为中华蛸疾病诊断和组织病理学研究提供理论依据。
致谢 澳大利亚维多利亚博物馆卢重成教授对文章撰写提供了宝贵意见; 南麂列岛国家海洋自然保护区管理局陈万东和倪孝品提供样品, 中国海洋大学贝类遗传育种研究室硕士研究生李嘉华协助实验,谨致谢忱。

