贵州番茄黄化曲叶病毒的检测及其DNA-A序列分析
李 淳, 刘学辉, 卜昶栋, 姚胜军, 王莉爽*
(1.贵州省农业科学院 植物保护研究所, 贵州 贵阳 550006; 2.贵州医科大学 生物与工程学院, 贵州 贵阳 550025)
0 引言
【研究意义】番茄在贵州常年种植,而番茄黄化曲叶病毒(Tomatoyellowleafcurlvirus,TYLCV)引起的番茄黄化曲叶病(Tomato yellow leaf curl disease,TYLCD)是危害番茄生产的主要病害之一,严重影响番茄的优质丰产。因此,明确贵州番茄TYLCV的株系变异与分化对了解该病害的发生、传播以及防治措施的制定具有重要意义。【前人研究进展】番茄黄化曲叶病毒是双生植物真菌病毒目(Geplafuvirales)双生病毒科(Geminiviridea)菜豆金色黄花叶病毒属(Begomovirus)成员[1]。TYLCV为单链环状DNA(single stranded DNA,ssDNA),具有孪生颗粒形态,基因组由大小为2 500~2 800 bp的DNA-A和DNA-B组成。目前国内发现的番茄黄化曲叶病毒大多为DNA-A,基因组大小为2 700~2 800 bp[2]。TYLCV主要通过带毒的烟粉虱进行传播,并可通过嫁接和种苗调运传播,并不通过种子和机械摩擦接种传播[3]。我国于2006年在上海首次发现TYLCV[4],之后在20余省先后报道该病毒的发生[5]。国际病毒委员会根据地区和序列的不同将TYLCV分为Tomato yellow leaf curl virus-Israel(TYLCV-IL)、Tomato yellow leaf curl virus-Iran(TYLCV-IR)、Tomato yellow leaf curl virus-Mild(TYLCV-MLD)、Tomato yellow leaf curl virus-Oman(TYLCV-OM)、Tomato yellow leaf curl virus-Gezira(TVLCV-Gez)[6]等株系。TYLCV侵染番茄的典型症状为上部新叶叶片黄化变小,叶缘卷曲[7]。【研究切入点】目前贵州针对番茄病毒的研究主要集中在RNA病毒上,针对番茄DNA病毒的研究尚属空白。【拟解决的关键问题】对贵州省关岭县采集的番茄疑似TYLCV样品进行分子鉴定,扩增并克隆出TYLCV贵州分离物DNA-A全长序列,分析贵州番茄TYLCV分离物与其他地区的系统进化关系,以期为贵州番茄黄化曲叶病毒病的科学防控提供依据。
1 材料与方法
1.1 材料
1.1.1 感病样品采集 疑似番茄病毒病样品于2019年秋季采自贵州省关岭县,保存在-80℃冰箱。以TYLCV侵染发病的番茄植株叶片作为阳性对照,以未发病的健康番茄植株叶片作为阴性对照。
1.1.2 试剂 TransStart®FastPfu DNA Polymerase、pEASY®-Blunt Simple Cloning Kit、EasyPure®Quick Gel Extraction Kit及Trans2K®Plus DNA Marker,购自北京全式金生物有限公司;其他生化试剂及普通化学试剂,均为进口或国产分析纯。
1.2 方法
1.2.1 总DNA提取 番茄叶片样本总DNA提取采用CTAB法[3]。
1.2.2 PCR扩增与测序 采用刘勇等[8]报道的双生病毒通用引物BegoAFor1 (5′-TGYGARGGICCITGYAARGTYCARTC-3′)和BegoARev1(5′-ATHCCMDCH ATCKTBCTITGCAATCC-3′)进行番茄疑似病毒病样品扩增,PCR反应体系:Template 2 μL,Forward Primer(10 μM) 1 μL,Reverse Primer(10 μM) 1 μL,TransStart®FastPfu DNA Polymerase 1 μL,5×TransStart®FastPfu Buffer 10 μL,无核酸酶水35 μL,总体积50 μL。反应程序:95℃ 3 min;95℃ 15 s,50℃ 15 s,72℃ 1 min 12 s,35个循环72℃ 5 min。
采用刘文浩等[9]报道的DNA-A全长引物TY3(5′-CAHTGGCTCGCAGAGGGT-3′)和TY5(5′-TTCGCAAGTATCAATCAAGGT-3′)扩增DNA-A全长。PCR反应程序:95℃ 3 min;95℃ 15 s,56℃ 15 s,72℃ 3 min,35个循环;72℃ 5 min。以番茄黄化曲叶病毒源样品的DNA为阳性对照,以健康植株为对照。
PCR扩增产物经回收纯化后克隆至pEASY®-Blunt Simple Cloning Kit载体,转化到大肠杆菌DH5α感受态细胞中,在含卡那霉素的LB固体培养基上37℃倒置培养12~16 h,经过菌落PCR鉴定后,选取3个阳性克隆进行测序,引物合成及测序由重庆擎科兴业生物科技有限公司完成。
采用NCBI的Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序的序列进行比对,确认其种类,并用Danman 6.0进行全基因组序列分析,然后利用MEGA7.0选择近邻算法NJ(Neighbor-Joining)对该分离物序列和GenBank中不同地区的TYLCV病毒分离物序列(表1)进行序列同源性比较和系统进化树分析,重复次数是1 000。
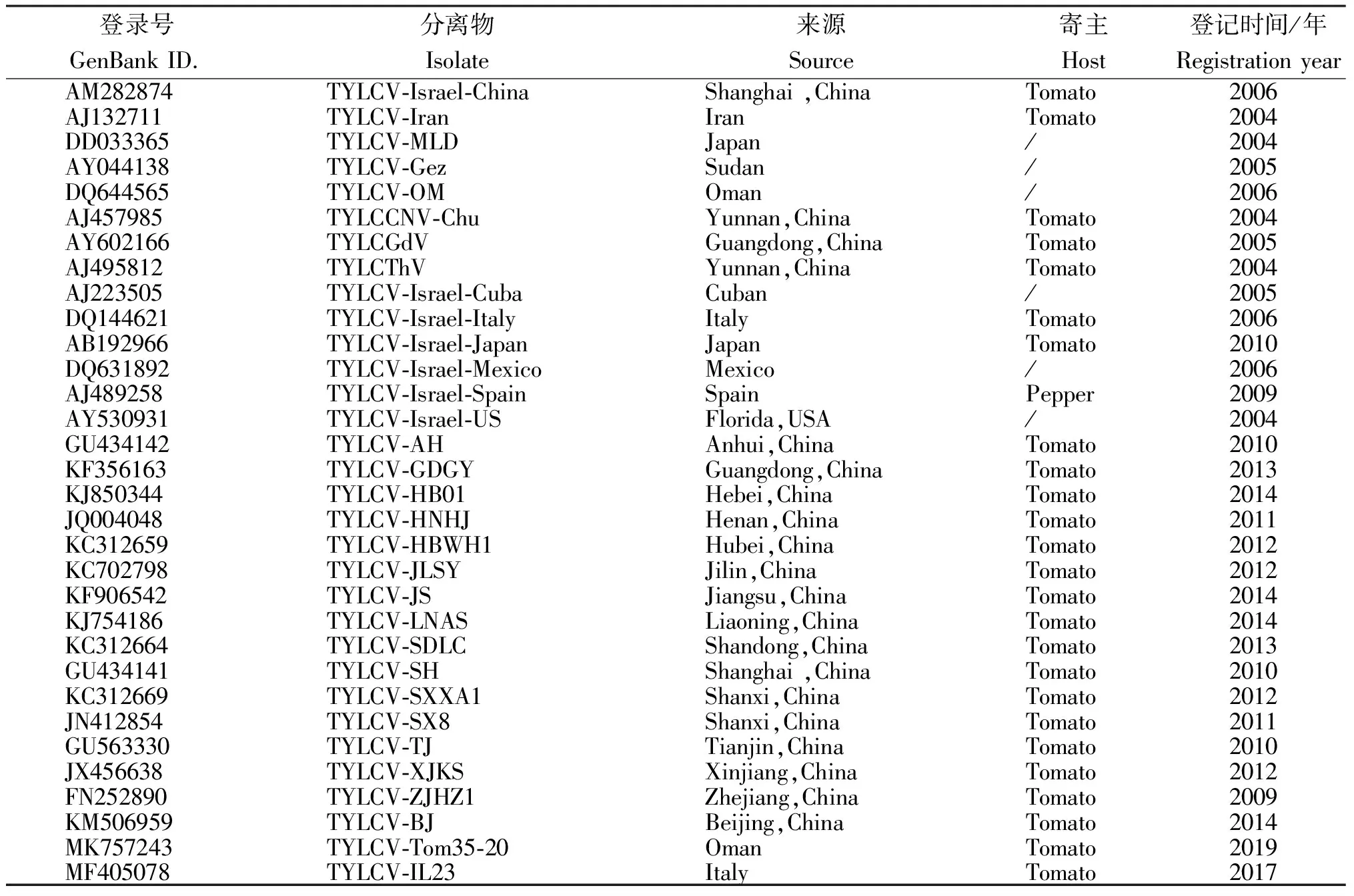
表1 不同地区TYLCV分离物及其在国际基因库的收录信息
2 结果与分析
2.1 番茄疑似 TYLCV样品检测
用双生病毒通用引物BegoAFor1/BegoARev进行PCR扩增,以提取的感病番茄总DNA为模板,得到1 200 bp大小条带(图1)。产物回收后连接到T载体,经克隆测序后在NCBI上进行Blast比对,与TYLCV序列相似性达99%,确认其为TYLCV序列。
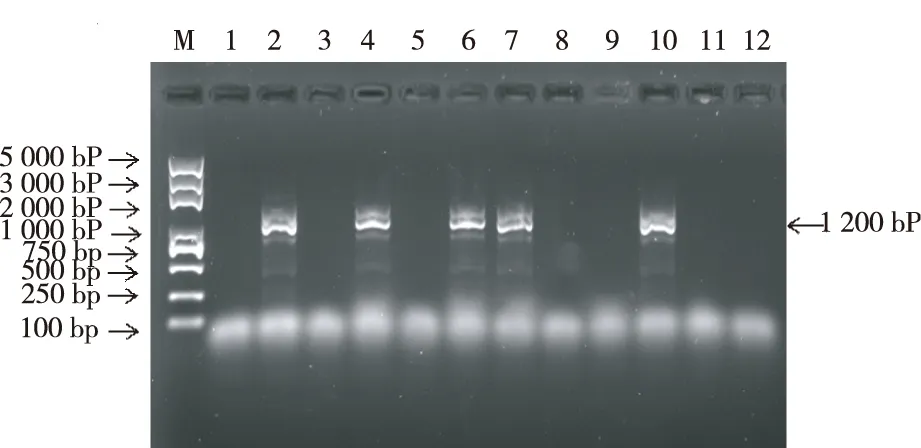
注:M为2k plus marker,1为阴性对照,2为阳性对照,3~12为样品。
2.2 TYLCV-GZ全长基因组扩增与克隆
用TYLCV DNA-A全长引物TY3/TY5扩增感染TYLCV的番茄样品的DNA,获得2 781 bp大小的特异性条带,且目的条带单一,扩增产物经回收、连接、克隆后测序,将TYLCV-GZ的DNA-A全长序列提交到GenBank,登录号为MW286511。

图2 TYLCV-GZ全长基因组扩增
2.3 TYLCV贵州分离物全长序列的比较
从表2可知,TYLCV-GZ的DNA-A与国内外不同株系的TYLCV的相似性为89.8%~99.2%,与TYLCV-Mexico和TYLCV-XJKS的相似性最高,核苷酸一致性达99%以上,而与TYLCV-OM相似性最低,只有89.8%。从图3看出,以TYLCCNV、TYLCThV和TYLCGdV为外组,TYLCV-GZ与国内其他地区TYLCV分离物归属一致,属于TYLCV-IL株系。其中,TYLCV-GZ、TYLCV-XJKS和TYLCV-SDLC聚在1个小分支上,说明,TYLCV贵州分离物与新疆、山东分离物的亲缘关系最近。
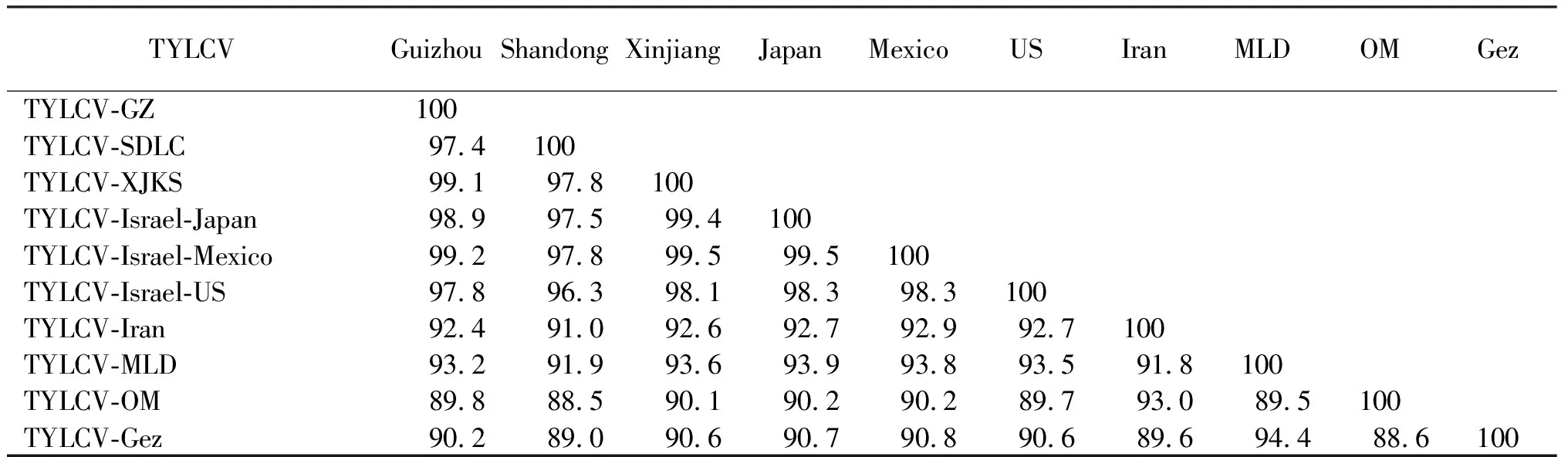
表2 番茄黄化曲叶病贵州分离物和已报道的 TYLCV分离物基因组序列相似性

图3 基于TYLCV相似性构建的系统发育进化树
3 讨论
目前,国内外对TYLCV的研究较多,但由于TYLCV普遍存在基因重组,该病毒在烟草、番茄和辣椒等寄主上存在外,中国在黄瓜和藿香上均有新发现[10-11]。TYLCV变异频率较高,STEFANO等[12]从携带Ty-1抗性基因的番茄植株中分离到1个在西西里岛常见的重组番茄黄卷叶病毒株系的核苷酸序列。TYLCV复合侵染现象明显,复合种类多变,如在土耳其番茄上发现番茄黄曲叶病毒和番茄褪绿病毒(Tomato chlorosis virus,ToCV)复合侵染[13]。在中国藿香上发现,病毒病是由TYLCV和CMV侵染所致[11]。鉴于TYLCV的发生变异及复合侵染种类等复杂多变,该病毒的防控变得十分困难。目前,TYLCV防控主要从传播昆虫烟粉虱和寄主抗性品种等方面开展,一是减缓烟粉虱的传播速率,如乙酰化甘油酯(BemidetachTMEC)对温室番茄植株上烟粉虱传播的TYLCV有抑制作用[14]。二是培育番茄抗性品种。基因组编辑技术特别是CRISPR-Cas9技术的研究成果,为培育抗病作物提供了一种可行的解决方案。病毒诱导的CRISPR-Cas9系统提高了对番茄黄曲叶病毒的抗性[15]。三是寻找抗性相关基因或病原菌抑制TYLCV的传播,如番茄的SlPDI基因可以通过增强ER蛋白的折叠功能和促进抗氧化相关蛋白的合成和构象来调节植物对TYLCV的抗性[16]。在温室条件下接种番茄大芽植原体(TBBP、16SrII-D)与TYLCV后,植物原体和病毒浓度显著降低,表明TYLCV和TBBP在侵染番茄植株时存在拮抗作用[17]。上述研究成果有望为TYLCV的防控提供新思路新策略,但是对TYLCV的检测及其分离物的鉴定是开展防控的前提。
据田间调查发现,烟粉虱在贵州番茄地普遍存在,但TYLCV对贵州番茄的危害未见报道。因此,该研究对贵州番茄的疑似TYLCV样品进行PCR检测和DNA-A全基因组序列的克隆和分析表明,经PCR扩增出TYLCV的目的片段,且贵州TYLCV分离物的DNA-A全基因组序列与新疆分离物的核苷酸一致性达99.1%。这是TYLCV侵染贵州番茄的首次报道。
在双生病毒科病毒同源性比较中,同源性大于89%被认为是同一病毒的不同株系,在此基础上,基因组序列同源性大于94%,则被认为是同一株系的不同分离物[18]。该研究选取来自不同国家和地区的9个毒株样品序列进行同源性分析发现,TYLCV-GZ序列与用来比对的其他株系相似度均在89%以上,与TYLCV-Mexico同源性最高,达99.2%,可以认为,该分离物属于TYLCV。系统发育分析表明,TYLCV-GZ序列与TYLCV-SDLC和TYLCV-XJKS亲缘关系最近,同属TYLCV-IL株系。根据周莹等[19]的报道,TYLCV入侵我国内陆有2条路线,分别为江苏路线(由江苏一带入境,逐步传入内陆安徽、河南、河北、山东、北京、辽宁、新疆等地)和广东路线(经过上海、浙江,逐步传入内陆湖北、河南、山东、河北、山西、北京及天津等地),从亲缘关系看,TYLCV-GZ极有可能来自江苏路线;但从地理位置看,贵州离山东和新疆都很远,因此,病毒具体的传播路线和传播方式有待进一步研究。郝浩永等[20]研究发现,TYLCV与烟草曲茎病毒(Tobacco curly shoot virus,TbCSV)分离物TbCSV-India的进化关系在AC4氨基酸序列水平很接近,由此推测,自然界中TYLCV与TbCSV在AC4序列处可能已经发生广泛的重组,带来更强的致病性。该研究仅对番茄样品进行鉴定,并未研究遗传重组现象,下一步需在多种作物上研究贵州双生病毒是否有遗传变异现象发生。
4 结论
将采自贵州省关岭县的番茄疑似TYLCV样品提取DNA,经菜豆金色黄花叶病毒属(Begomovirus)通用引物BegoAFor1/BegoARev1进行PCR检测,用TY3/TY5引物扩增并克隆其DNA-A全长序列,且对其全长序列进行同源性分析及系统进化情况发现,从病样中分离得到的致使贵州番茄叶片表现黄化、皱缩等症状的病原为TYLCV,其DNA-A全长序列与TYLCV-Mexico和TYLCV-XJKS的相似性最高,核苷酸一致性达99%以上,且与国内其他地区TYLCV分离物归属一致,属于TYLCV-IL株系;其与TYLCV-SDLC(山东)和TYLCV-XJKS(新疆)聚在一个分支上,说明其亲缘关系最近。引起贵州关岭县番茄叶片黄化、皱缩的病原为番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)。

