阿托伐他汀抑制代谢综合征诱导的小鼠心脏重构
蔡嘉莉 汪 霞 尹安雯 沈烨娇 肖青青 沈玲红 何 奔
(上海交通大学附属胸科医院心血管内科 上海 200030)
心血管代谢综合征(cardiometabolic syndrome,CMS)是指一系列代谢性疾病和心血管疾病,包括肥胖、葡萄糖耐量降低和高血压等疾病。随着人口老龄化以及不良生活方式流行,CMS 患者数量占全世界人口的25%[1],且持续上升,这增加了心力衰竭的发病风险[2]。代谢综合征会引起机体代谢紊乱,继而引起系统性炎症和心脏重构,最终发展为心力衰竭[3]。目前,对于合并代谢综合征的心力衰竭患者缺乏有效的治疗手段。
阿托伐他汀(Atorvastatin,ATO)是羟甲基戊二酰辅酶A 还原酶抑制剂,是降低血清胆固醇水平和临床预防心血管疾病的最常用处方药物之一,主要作用是通过降脂、抗炎、抗氧化应激和改善内皮功能等发挥心血管保护作用[4]。他汀对心力衰竭的作用存在悖论:能够预防心力衰竭的进展,但是不能降低心力衰竭的发病率和死亡率[5]。这可能与他汀在合并代谢综合征的心力衰竭和慢性心力衰竭中作用效果不一致有关。临床数据显示,他汀能够降低合并代谢综合征的心力衰竭患者的死亡率[6-7],合并代谢综合征的心力衰竭通常是射血分数保留的心力衰竭。两项大型随机对照临床试验CORONA和GISSI-HF 结果显示他汀对慢性心力衰竭的作用效果不佳,使我们忽略了它可能在特定亚型心力衰竭中的作用。
目前对于ATO 的研究主要集中在单因素发病的疾病模型中,如糖尿病[8]、高脂[9]和自发性高血压[10]等引起的心脏重构。本研究采用双打击模型[11],该模型更符合临床代谢综合征诱导心脏重构的动物模型,从而探究ATO 是否能够延缓代谢综合征诱导心脏重构的进展。
资料和方法
实验动物及分组本研究使用8~10 周龄雄性C57BL/6J 小鼠,购自北京维通利华公司,生产许可号:SCX(沪)2017-0011。小鼠饮食供应充足,饲养环境室温和相对湿度恒定。24 只小鼠使用随机数字法分为4 组,每组6 只。每组之间的小鼠初始体质量差异无统计学意义。动物实验符合上海交通大学医学院实验动物福利伦理委员会的要求。通过给予高脂饮食(high fat diet,HFD)(60 kcal%脂肪+20 kcal% 碳水化合物+20 kcal% 蛋白质,Research Diet D12492)和含 0.5 g/L N-硝基-L-精氨酸甲酯(N-nitro-L-arginine methyl ester,L-NAME,美国Sigma 公司)的饮用水造模(图1)。对照组(Chow)给予正常饮食和饮水,每日给予等体积溶剂灌胃;模型组给予HFD 和L-NAME 饮水,每日给予等体积溶剂(Vehicle)灌胃;低剂量组(ATO10)给予HFD 和 L-NAME 饮 水 ,每 日 给 予 10 mg·kg‒1·d‒1ATO(MCE 目录号:HY-17379)灌胃;高剂量组(ATO20)给予 HFD 和 L-NAME 饮水,每日给予20 mg·kg‒1·d‒1ATO 灌胃。动物造模时间和给药时间均为12 周,小鼠无死亡。

图1 代谢综合征诱导下小鼠心脏重构模型建立Fig 1 The establishment of cardiac remodeling model induced by metabolic syndrome in mice
血压测量造模结束前1 周开始进行血压监测,让小鼠适应测血压的过程,减少后续应激反应对实验的影响。采用尾静脉压测量法测量小鼠血压。
葡萄糖耐量实验禁食12 h 后,通过鼠尾静脉血测量空腹血糖水平,腹腔注射2 g/kg葡萄糖溶液后15、30、60 和120 min,分别测量血糖水平(mg/L)。
血脂四项测定眼球取血法留取全血,静置离心,分离血清,测定血清中胆固醇(cholesterol,CHO)、三酰甘油(triglycerides,TG)、高密度脂蛋白(high density lipoprotein,HDL)和低密度脂蛋白(low density lipoprotein,LDL)的含量(mmol/L)。
小鼠心脏超声将频率为5.0~11.0 MHz 的超声心动图探头置于胸骨旁短轴。记录左室乳头肌水平M 型超声心动图,测量左室射血分数(left ventricular ejection fractions,LVEF)、左心窒的短轴缩 短 率(fractional shortening,FS)、心 输 出 量(cardiac output,CO)和每搏输出量(stroke volume,SV)等指标。
动物取材、心脏病理造模12 周后,称量小鼠终末体质量。小鼠麻醉后进行心脏灌注,用滤纸吸干多余水分,称量心脏重量(heart weight,HW)后多聚甲醛固定。取小鼠左侧胫骨(tibia length,TL),用游标卡尺测量胫骨长度。固定好的心脏组织进行石蜡包埋,从冠状面进行切片,厚度为6 μm。切片进行HE 染色、马松化学染色和WGA 免疫荧光染色。
Western blot 检测提取心脏组织蛋白,使用BCA 法测定蛋白浓度。蛋白样品上样后电泳分离,电转至PVDF 膜上,5%脱脂奶粉封闭后,与一抗Collagen Ⅰ(Ab270993 1∶1 000)、α-SMA(Ab124964 1∶1 000)、α-Tubulin(Beyotime AF0001 1∶1 000)4 ℃孵育过夜。TBST 洗去一抗后,室温下二抗孵育60 min。TBST 洗去二抗后进行显影。
统计学方法用SPSS19.0 软件进行统计分析,定量数据用表示。各组间差异采用One-way ANOVA 方法分析,P<0.05 为差异有统计学意义。
结 果
ATO 抑制HFD+L-NAME 诱导的小鼠糖代谢异常和肥胖造模12 周后,模型组小鼠空腹血糖较对照 组 升 高[Chowvs.Vehicle:(4.98±0.91)mmol/Lvs.(5.57±0.26)mmol/L,P=0.005]。 ATO10 组 和ATO20 组的空腹血糖均较模型组降低[ATO10vs.Vehicle:(4.77±0.60)mmol/Lvs.(5.57±0.26)mmol/L,P=0.002;ATO20vs. Vehicle:(5.07±0.43)mmol/Lvs. (5.57±0.26)mmol/L,P=0.003;F=5.56]( 图2A)。IGTT 结果显示,模型组引起的血糖波动大于 ATO10 组和 ATO20 组,ATO10 组在注射葡萄糖15 min 后,血糖升高程度较模型组降低(P=0.006),ATO20 组在注射葡萄糖 15 min(P=0.002)及 30 min(P=0.010)后均能降低血糖波动幅度(图2B、2C)。ATO 降低高脂引起的体质量增加程度[Chowvs.Vehicle:(28.78±1.99)gvs. (40.03±3.76) g,P<0.05; ATO10vs. Vehicle:(34.10±4.06) gvs.(40.03±3.76) g,P=0.025;ATO20vs. Vehicle:(34.32±2.92)gvs.(40.03±3.76)g,P=0.015;F=11.75](图2D),且与摄食量无关。

图2 ATO 抑制HFD+L-NAME 诱导的小鼠糖代谢异常和肥胖Fig 2 ATO inhibited abnormal glucose metabolism and obesity induced by HFD+L-NAME in mice
ATO 抑制HFD+L-NAME 诱导的小鼠脂质代谢异常造模12 周后,测定各组小鼠4 项血脂水平(表1):与 模 型 组 相 比 ,ATO10 组 和 ATO20 组 抑 制HFD+L-NAME 诱 导 的 循环 CHO、TG 和 HDL 含量升高(P<0.05,图 3A~3C)。4 组小鼠的血清LDL 含量未见差异(图3D)。
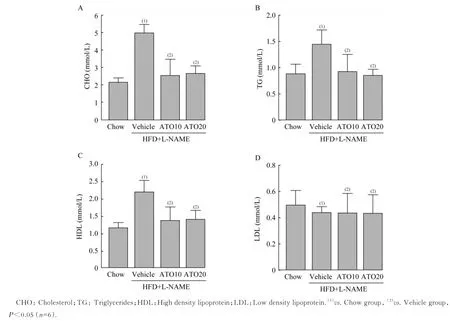
图3 ATO 改善HFD+L-NAME 诱导的小鼠血脂紊乱Fig 3 ATO inhibited abnormal lipid metabolism induced by HFD-L-NAME in mice
表1 ATO 改善HFD+L-NAME 诱导的小鼠血脂紊乱Tab 1 ATO inhibited abnormal lipid metabolism induced by HFD-L-NAME in mice ()

表1 ATO 改善HFD+L-NAME 诱导的小鼠血脂紊乱Tab 1 ATO inhibited abnormal lipid metabolism induced by HFD-L-NAME in mice ()
CHO:Cholesterol;TG:Triglycerides;HDL:High density lipoprotein;LDL:Low density lipoprotein.(1)vs. Chow group,(2)vs. Vehicle group,P<0.05(n=6).
F value 28.04 8.46 13.15 0.41 Lipid CHO(mmol/L)TG(mmol/L)HDL(mmol/L)LDL(mmol/L)Chow group 2.13±0.17 0.88±0.18 1.16±0.14 0.49±0.11 Vehicle group 4.98±0.49(1)1.45±0.27(1)2.18±0.35(1)1.43±0.05 ATO10 group 2.53±0.95(2)0.92±0.32(2)1.36±0.39(2)0.43±0.15 ATO20 group 2.63±0.47(2)0.85±0.12(2)1.39±0.28(2)0.43±0.15
ATO 降低HFD+L-NAME 诱导的小鼠血压升高造模12 周后,模型组收缩压明显升高,ATO20组能够降低HFD+L-NAME 引起的收缩压升高[ATO20vs. Vehicle:(128.46±6.79) mmHgvs.(141.52±4.42)mmHg,P=0.003](图 4A)。模型组的平均动脉压较对照组升高,ATO10 组和ATO20 组的平均动脉压均有下降[ATO10vs. Vehicl:(109.18±4.88)mmHgvs.(117.53±3.48)mmHg,P=0.007;ATO20vs.Vehicle:(97.17±7.51)mmHgvs.(117.53±3.48)mmHg,P<0.001;F=59.76](图 4B)。与模型组比较,ATO10 组和ATO20 组均能降低HFD+L-NAME 引起的舒张压升高[ATO10vs.Vehicle:(94.89±6.85)mmHgvs.(104.29±5.18)mmHg,P=0.023;ATO20vs. Vehicle:(83.53±7.66)mmHgvs.(104.29±5.18)mmHg,P<0.001;F=32.16](图 4C)。

图4 ATO 抑制HFD+L-NAME 诱导的小鼠血压升高Fig 4 ATO inhibited HFD+L-NAME induced hypertension in mice
ATO 改善HFD+L-NAME 诱导的小鼠心输出量下降各组小鼠之间的LVEF 和FS 均未见明显差异(图5A、5B)。模型组的CO 和SV 较对照组下降(P<0.05)。ATO10 组 和 ATO20 组 CO[ATO10vs.Vehicle:(0.50±0.06)mg·kg‒1·d‒1vs.(0.43±0.06)mg·kg‒1·d‒1,P=0.003;ATO20vs. Vehicle:(0.50±0.09) mg·kg‒1·d‒1vs.(0.43±0.06) mg·kg‒1·d‒1,P=0.017;F=23.56](图 5C)和 SV(ATO10vs. Vehicle:(1.01±0.10)μL/gvs.(0.89±0.11)μL/g,P=0.002;ATO20vs. Vehicle:(1.05±0.20) μL/gvs.(0.89±0.11)μL/g,P=0.012;F=16.42]水平均提高(图5D)。

图5 ATO 改善HFD+L-NAME 诱导的小鼠心输出量下降Fig 5 ATO alleviated heart output reduction induced by HFD-L-NAME in mice
ATO 抑制HFD+L-NAME 诱导的小鼠心脏重构形态学改变通过HE 和Masson 染色观察心脏组织病理学改变:与对照组比较,模型组出现明显的室壁增厚和心脏纤维化;与模型组比较,ATO10 组和 ATO20 组的心脏室壁厚度(P<0.001,F=27.06)(图6A)和Masson 染色阳性区域均减少(P=0.002,F=10.95)(图 6B)。造模 12 周后,WGA 染色结果显示,模型组的心肌横截面积较对照组增大。ATO10组和ATO20 组的心肌横截面积均较模型组缩小[ATO10vs. Vehicle:(543.65±43.24) μm2vs.(698.41±79.34)μm2,P=0.002;ATO20vs. Vehicle:(469.24±31.94)μm2vs. (698.41±79.34)μm2,P<0.05;F=40.08](图6C)。

图6 ATO 抑制HFD+L-NAME 诱导的小鼠心脏重构的形态学改变Fig 6 ATO inhibited morphological changes of cardiac remodeling in mice induced by HFD+L-NAME
ATO 抑制HFD+L-NAME 诱导的小鼠心脏重构相关蛋白改变Collagen Ⅰ和α-SMA 是心脏重构的重要标记物。模型组Collagen Ⅰ和α-SMA 蛋白表达水平均升高(图 7A),使用 ATO 后,ATO10 组和ATO20 组Collagen Ⅰ蛋白表达水平较模型组下降 (ATO10vs. Vehicle:P=0.013;ATO20vs.Vehicle:P=0.022;F=4.49)(图 7B),ATO10 组 和ATO20 组的α-SMA 蛋白表达水平均较模型组下降(ATO10vs.Vehicle:P=0.010;ATO20vs.Vehicle:P=0.018;F=6.28)(图 7C)。ATO10 组和 ATO20 组的HW/TL 均较模型组降低[ATO10vs.Vehicle:(8.18±0.54)mg/mmvs.(8.98±0.57) mg/mm,P=0.030;ATO20vs.Vehicle:(8.09±0.45)mg/mmvs.(8.98±0.57)mg/mm,P=0.013;F=11.41](图 7D)。

图7 ATO 抑制HFD+L-NAME 诱导的小鼠心脏重构的相关蛋白改变Fig 7 ATO inhibited the proteins changes of cardiac remodeling in mice induced by HFD+L-NAME
讨 论
本研究的结果显示ATO 对HFD+L-NAME 诱导的代谢紊乱有调节作用,可抑制心脏重构进展。本研究采用的是双打击模型[11-12],L-NAME 可引起小鼠高血压,高脂饮食可引起肥胖以及糖耐量受损,多种高危因素同时存在,更符合合并代谢紊乱的心力衰竭患者的临床表现。
本研究结果表明ATO 可改善小鼠葡萄糖耐量受损和降低高脂引起的体重增加。目前关于ATO对于血糖的调节还存在争议。不同研究中使用的不同类型的他汀类药物、给药时间长短不同以及对应人群和动物模型不同对胰岛素抵抗程度的影响也随之改变。本研究的结果显示:在血糖调节方面,ATO 能够降低小鼠空腹血糖,维持血糖稳态,降低血糖升高的峰值,但是血糖下降无明显差异。由于未检测胰岛素分泌水平且未行胰岛素抵抗试验,调节血糖的具体机制不明。本研究采用双打击模型,L-NAME 和高脂饮食均会引起iNOS 表达增高,从而引起胰岛素抵抗[11]。iNOS 是重要的代谢调节酶,与胰岛素抵抗密切相关[3]。该模型不仅模拟了代谢综合征诱导的心脏重构,同时合并有非酒精性脂肪肝[12]。他汀影响血糖代谢的两个主要机制可能:增加胰岛素抵抗和影响胰岛素分泌。有研究表明,ATO 可能通过抑制脂肪组织的增加和脂肪细胞肥大及其炎症因子的释放,从而改善糖耐量受损[13-14]。同时,ATO 可能抑制 iNOS 表达升高[15],从而改善胰岛素抵抗。文献报道,ATO 影响小鼠胰腺β 细胞的数量和合成分泌功能,最终引起血糖升高,增加新发糖尿病的风险[16]。结合本研究的结果:ATO 抑制HFD+L-NAME 诱导的小鼠血糖升高和糖代谢紊乱,说明ATO 对抑制iNOS 从而改善胰岛素抵抗的作用大于阿托伐他汀对胰腺β 细胞数量和合成分泌功能的抑制作用。
在血脂调节方面,本研究结果显示:ATO 抑制HFD+L-NAME 会 引 起 小鼠 血 清 中 CHO、TG 和HDL 水平升高,但并不改变LDL 水平。本模型对血脂的改变主要由HFD 引起的。脂质代谢异常引起的心脏脂毒性也是重要的致病因素之一[18]。文献报道[9,13],ATO 抑制 HFD 诱导的小鼠血浆 CHO、LDL 和TG 水平,HDL 水平未出现明显改变。本模型的LDL 水平未发生明显改变,模型组HDL 水平升高,主要是由于模型组总CHO 水平升高。
另外,ATO 能够降低高脂饮食诱发的小鼠体质量增加,与文献报道ATO 降低小鼠体质量和内脏脂肪是一致的[9],其引起的体质量减少与摄食量无关。本模型的高血压机制不同于Ang Ⅱ诱发的RAS 系统激活的高血压,更倾向于是一种内皮和血管功能受损和容量性高血压[11]。ATO 通过上调小鼠内皮细胞eNOS 的表达,改善内皮功能,维持内皮的NO 稳态,从而起到降压的作用。也可通过抑制血管平滑肌细胞的增殖从而抑制血管重构。临床研究显示,将他汀类药物加入降压治疗可进一步改善心血管健康[17]。
心脏的舒张功能异常通常早于收缩功能异常。不同于缺血性心力衰竭引起的射血分数(ejection fraction,EF)下降,本文主要研究EF 值正常情况下心脏出现舒张功能异常,是心力衰竭的一种亚型,或者说是心力衰竭的早期阶段。本模型的小鼠EF和FS 正常,但心脏的僵硬度升高,心脏的顺应性变差,使舒张末期心室直径下降,小鼠的心脏博出量和每博输出量均下降。由于ATO 对小鼠体质量有影响,通过体质量来较正 CO 和 SV[9],发现 ATO 对HFD+L-NAME 引起的小鼠CO 和SV 下降均有改善作用。
本研究中,高剂量组ATO 对代谢综合征的调节作用及对心脏重构的抑制作用优于低剂量组,但两组间的差异无统计学意义。在小鼠体内低剂量组和高剂量组均达到有效的血药浓度,且趋于饱和浓度。而且无论是哪种他汀,药物剂量加倍只能使LCL-D 降低幅度增加6%,但不良反应却大幅增加。所以,对于降脂效果不达标的患者,考虑合用非他汀类降脂药物(如依折麦布、PCSK9 抑制剂等)联合降脂。
近年代谢诱导心脏重构和心力衰竭呈上升趋势,而ATO 是临床常用的抗动脉粥样硬化的药物。从循证医学角度考虑,我们仍需要大型的临床试验证明ATO 在CMS 患者中的获益情况,以期为早期和可持续的循证治疗提供证据,以促进心脏代谢健康并减轻心血管疾病的发生和发展。
本文不足之处:(1)可设置更低的ATO 药物浓度;(2)ATO 对心脏代谢综合征的具体调控机制仍有待进一步研究;(3)本研究缺乏相关临床资料支持。
综上所述,代谢紊乱会诱导心脏重构,ATO 通过调节代谢紊乱、抑制心肌肥大和心脏间质纤维化,对心脏重构有延缓作用。
作者贡献声明蔡嘉莉 文献调研和整理,研究构思和设计,数据整理和分析,论文撰写。汪霞,尹安雯 研究构思和设计。沈烨娇,肖青青 论文修订。沈玲红,何奔 课题构思,论文修订。
利益冲突声明所有作者均声明不存在利益冲突。

