基于双重数字PCR检测副溶血弧菌和鼠伤寒沙门氏菌
◎ 王一萍,段林洁,曾杰生,刘华敏,王 哲
(广东顺德工业设计研究院(广东顺德创新设计研究院),广东 佛山 528000)
食品安全关系民生大计,食源性致病菌是引发食品安全问题的主要因素[1-2],其中副溶血弧菌和鼠伤寒沙门氏菌最为常见[3-4]。副溶血性弧菌是一种嗜盐性革兰氏阴性菌,常存在于海虾、鱼、牡蛎等海产品中[5-6],食用携带该菌的食物常会引起急性肠胃炎等食物中毒现象。沙门氏菌是一种革兰氏阴性菌,在全球食物中毒病例中的分离率最高,常存在于蛋类、肉类中[7-8]。感染沙门氏菌后会引起肠道炎,在极端情况下可能引发系统感染[9]。目前,常规的检测技术主要有显色培养基技术[10]、荧光定量PCR检测技术、胶体金技术[11]、免疫层析试纸条[12]和Southem Blot杂交技术等[13-15],这些方法各有优缺点[16],但均不能有效实现绝对定量。数字PCR技术[17]作为新一代的PCR技术,可实现单分子绝对定量[18-19],其通过对样本的有限稀释,将待测样本均匀分配到微反应单元中,扩增后读取每个微反应单元的终末荧光信号,结合泊松分布统计原理,能够对起始模板分子绝对定量,目前广泛应用于病毒检测[20-21]、癌症诊断和治疗、食品成分分析[22-23]和食源性致病菌的检测[24-27]等方面。一种有效可靠的检测方法对保障食品安全和人们健康起着至关重要的作用,本文首次采用非特异性核酸染料Eva Green建立双重ddPCR(数字PCR)体系,以实现同时检测食品中的副溶血弧菌和鼠伤寒沙门氏菌,提高检测方法的灵敏度。
1 材料与方法
1.1 材料与试剂
牡蛎,市购;副溶血弧菌,ATCC 17802;鼠伤寒沙门氏菌,ATCC 14028;大肠埃希氏菌,ATCC 25922;阪崎肠杆菌,ATCC 29544;福氏志贺氏菌,ATCC 12022;金黄色葡萄球菌,ATCC 25923;单核增生李斯特氏菌,ATCC 19115;蜡样芽孢杆菌,CMCC(B)63303;粪肠球菌,ATCC 29212;DNA提取试剂盒,南京诺唯赞生物科技公司;Eva Green荧光染料,美国Biotium;数字PCR扩增试剂盒,佛山丁智生物科技。
1.2 仪器与设备
QX200微滴式数字PCR检测仪,美国伯乐公司;数字PCR微滴生成仪,广州永诺生物科技;A300快速梯度PCR扩增仪,杭州朗基科学仪器有限公司;1-16K高速冷冻离心机,德国西格玛实验室离心机公司;Nano Drop 2000微量分光光度计,美国赛默飞科技。
1.3 研究方法
1.3.1 引物设计
本研究以副溶血弧菌不耐热溶血毒素基因(tlh)和鼠伤寒沙门氏菌侵袭蛋白A基因(invA)作为靶标基因,从GeneBank数据库已知基因序列中选取特异性片段设计引物,并由上海赛默飞科技公司合成,引物序列见表1。

表1 引物序列表
1.3.2 DNA提取
将副溶血弧菌和鼠伤寒沙门氏菌接种于LB培养基中,37 ℃、150 r·min-1摇床培养8 h,副溶血弧菌、鼠伤寒沙门氏菌各取500 μL菌液(108CFU·mL-1),根据DNA提取试剂盒说明书提取DNA,提取后的DNA以超微量分光光度计NanoDrop 2000测定其浓度及纯度,并于-20 ℃下保存。使用前将副溶血弧菌、鼠伤寒沙门氏菌基因组DNA进行10倍梯度稀释。
1.3.3 引物和染料浓度优化
对染料添加量、tlh和invA引物浓度进行优化,使各荧光条带达到最佳区分度,减少不确定微滴数。双重数字PCR扩增条件为:95 ℃预变性10 min,95 ℃变性30 s,56 ℃退火延伸1 min,50个循环,98 ℃固化荧光10 min,最后用检测仪进行微滴分析。
1.3.4 特异性试验
按1.3.2中所述提取材料,对1.1中9种菌株的DNA提取稀释,取稀释倍数为104的DNA浓度为模板,按照优化后的体系进行数字PCR,检测该双重数字PCR体系的特异性。
1.3.5 灵敏度试验
取10倍梯度稀释的副溶血弧菌和鼠伤寒沙门氏菌进行双重数字PCR检测,确定该双重数字PCR的检测范围;将副溶血弧菌和鼠伤寒沙门氏菌DNA混合后进行双重数字PCR检测,每个浓度重复3次。确定双重数字PCR检测方法的灵敏度,并对结果进行线性分析,文中所有线形图均通过Excel分析制作。
1.3.6 重复性试验
用建立好的双重数字PCR方法进行重复性试验,以稀释倍数为103、104、105、106的副溶血弧菌和鼠伤寒沙门氏菌DNA作为模板,每个浓度做3次重复检测。对检测结果进行统计学分析,判断该方法的重复性。
1.3.7 人工污染样品检测
将新鲜的牡蛎肉在流动的水下冲洗10 min,无菌条件下称取25 g牡蛎肉,加入225 mL的无菌水混合研磨制成匀浆液,取9 mL匀浆液分别加入1 mL不同浓度的副溶血弧菌菌液和鼠伤寒沙门氏菌菌液,混合后各取500 μL,分别提取基因组DNA作为模板,进行双重数字PCR试验,确定其最低检测限。
2 结果与分析
2.1 引物和染料浓度优化
为探究适宜的tlh和invA引物浓度及Eva Green添加量,设置8组不同浓度组合,见表2。考虑成本和最佳区分度,最终选择tlh引物浓度为80 nmol·L-1,invA引物浓度为40 nmol·L-1,引物添加量为2.7 μL,在此浓度下各荧光条带的区分度达到最佳,见图1。由图1可知,invA的单阳性微滴荧光强度约为28 000,tlh单阳性微滴的荧光强度约为34 000,同时包含tlh和invA的微滴荧光强度约为41 000,手动设置阈值可对每个分区的微滴数进行分析,从而得到两种不同模板的拷贝数。
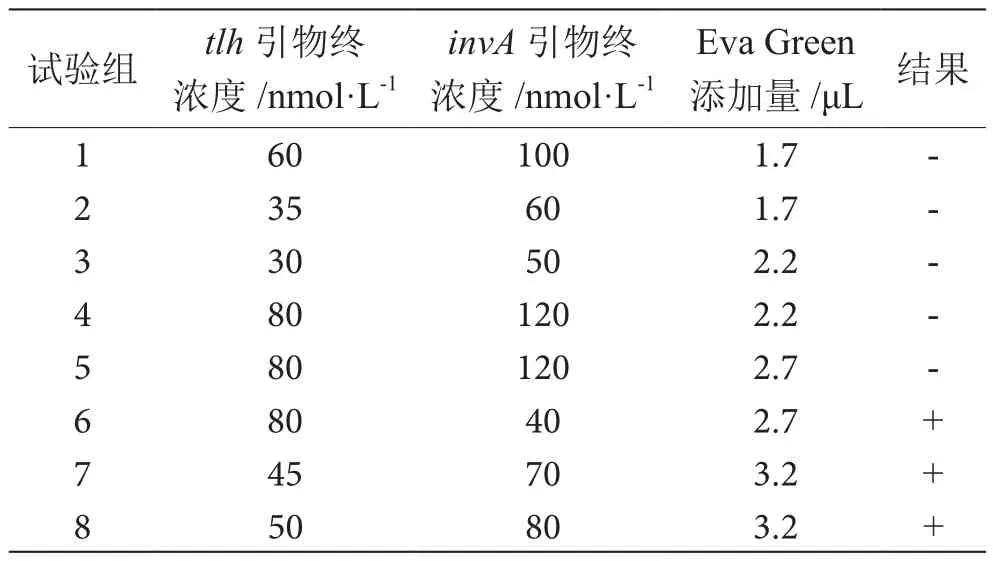
表2 tlh和invA不同引物浓度组合表
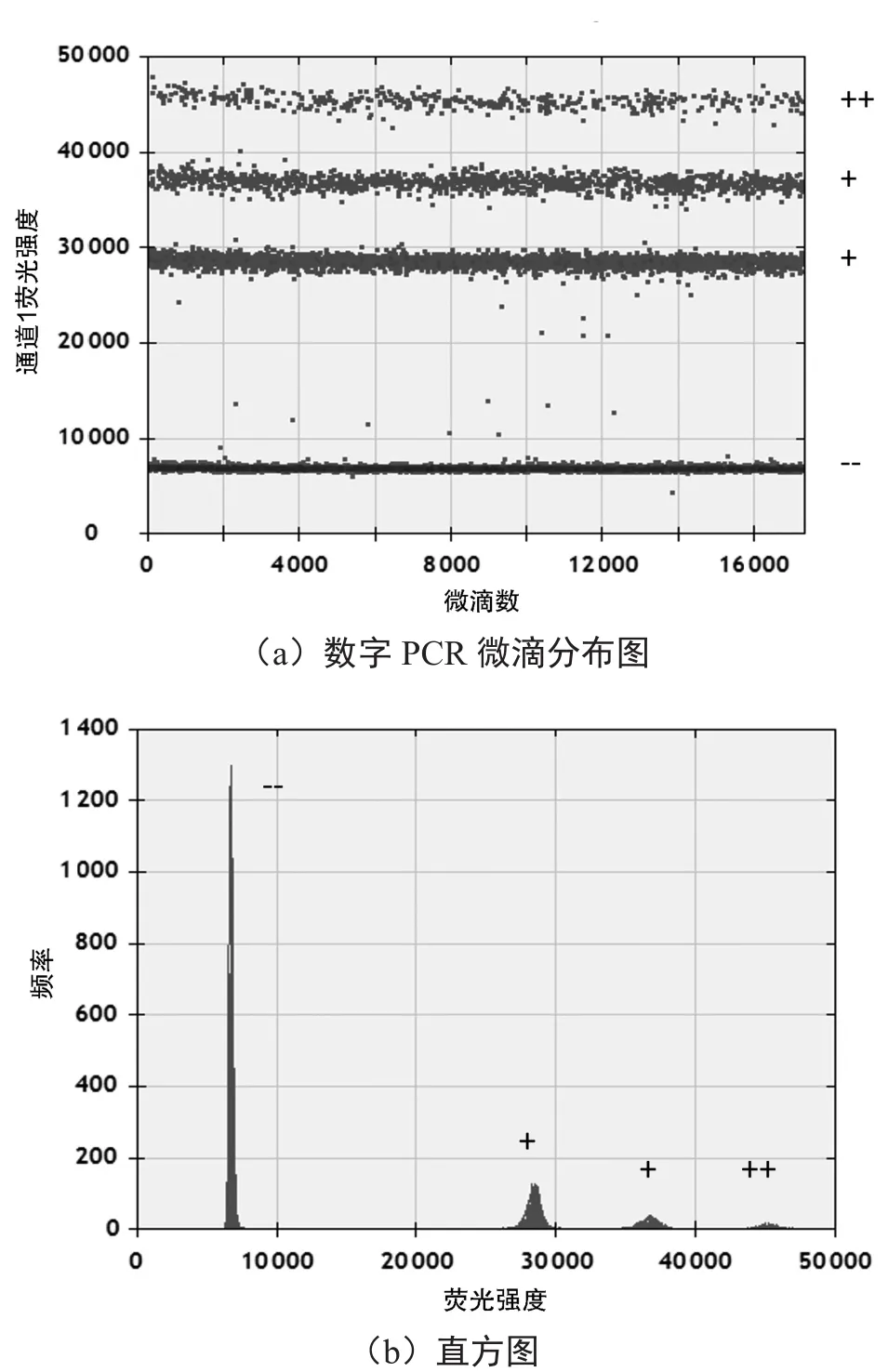
图1 最优引物浓度、染料添加量下数字PCR微滴分布及其直方图
2.2 特异性试验
数字PCR体系仅扩增含有副溶血性弧菌和沙门氏菌的模板,对其他7种菌株均无阳性微滴,表明建立的双重数字PCR体系特异性强,可专用于检测副溶血弧菌和鼠伤寒沙门氏菌,特异性检测结果见图2。
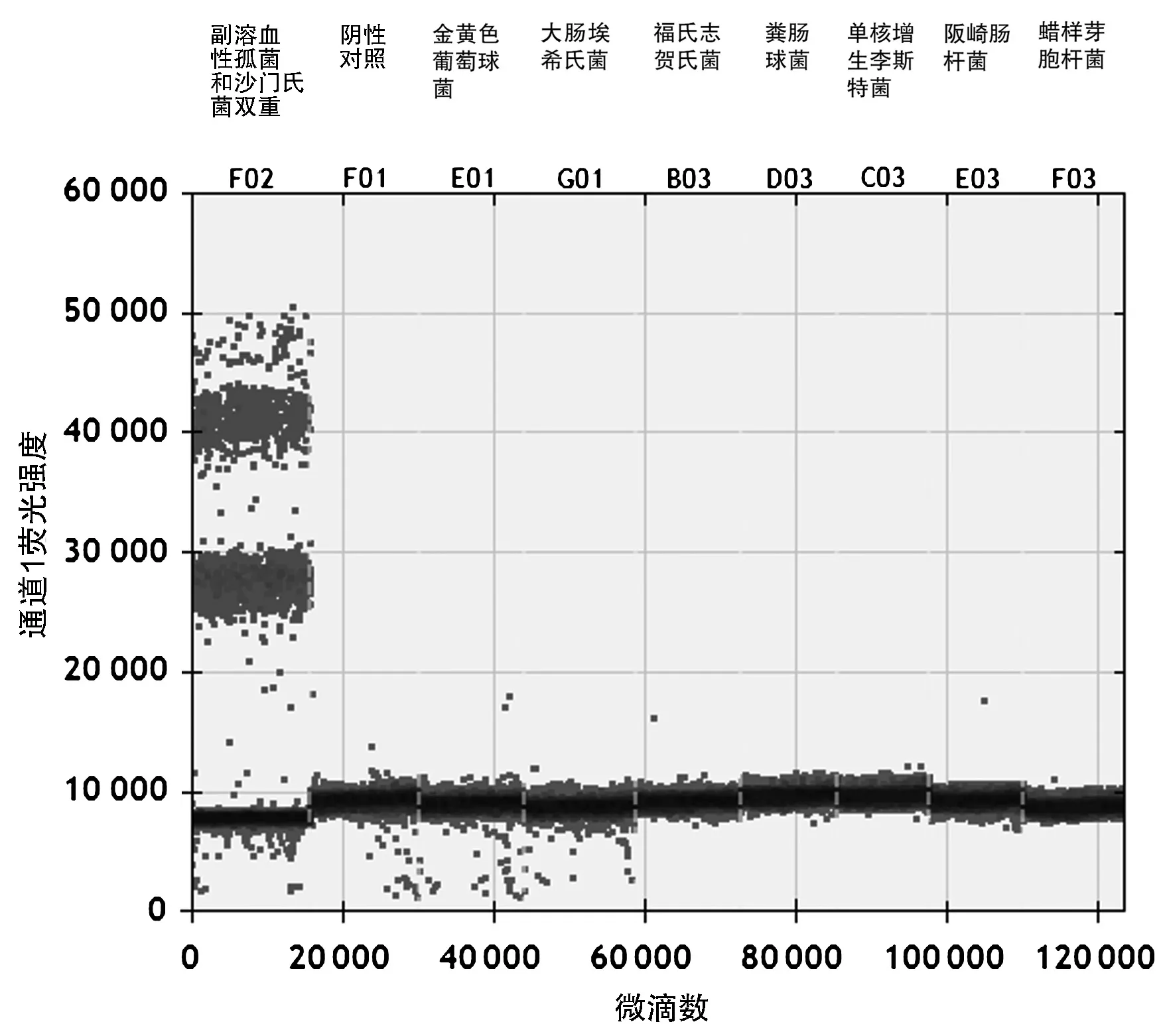
图2 特异性检测结果图
2.3 灵敏度试验
为检测该体系灵敏度,将模板梯度稀释进行双重数字PCR试验,结果如图3所示。每个孔生成的微滴数量>13 000个,表明该结果具有可靠性。tlh和invA的拷贝数通过Quantasoft软件设置阈值分析得到。当DNA稀释倍数为102,即DNA浓度为1 ng·μL-1时,所有微滴均为双阳性微滴。该方法可检测出DNA稀释倍数为107的模板,对副溶血弧菌tlh的最低检测线为16.8 copies/20 μL,见表3,invA的最低检测限为8.6 copies/20 μL,说明该方法对于检测副溶血弧菌和沙门氏菌具有较高的灵敏度。在DNA浓度为1.0×105~ 10.0 fg·μL-1时,数字 PCR 拷贝数与 DNA稀释倍数之间具有较好的线性关系,如图4所示,tlh和invA的R2均>0.99。
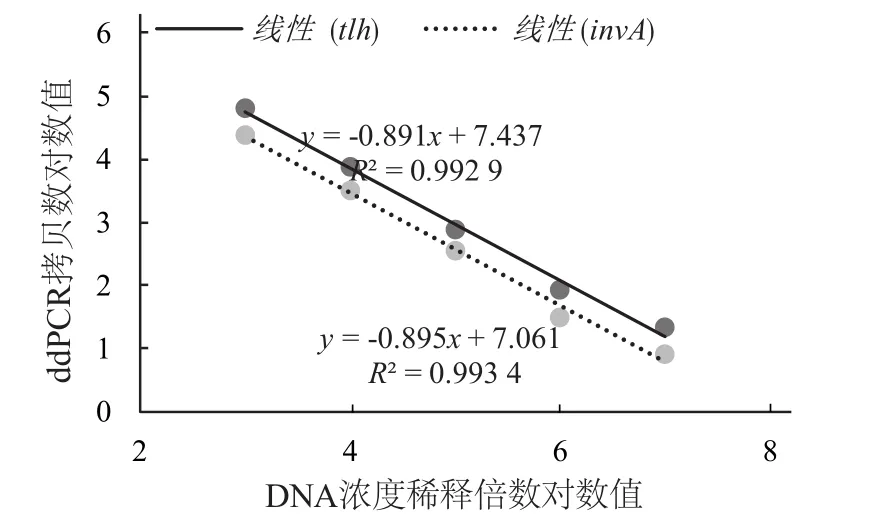
图4 数字PCR拷贝数与DNA稀释倍数的线性关系图

表3 数字PCR灵敏度分析表

图3 不同浓度梯度下数字PCR微滴分布图

2.4 重复性试验
以106、105、104、103稀释倍数的副溶血弧菌和沙门氏菌DNA作为模板,每个浓度做3次重复检测。对检测结果进行统计学分析,分析该方法的重复性。副溶血弧菌tlh在不同模板浓度下的变异系数分别为4.69%、3.35%、2.67%、3.69%,见表4。鼠伤寒沙门氏菌invA的变异系数分别为3.06%、2.34%、4.87%、3.53%,见表5,所有变异系数均小于5%,说明该方法检测副溶血弧菌和鼠伤寒沙门氏菌重复性较好。

表4 不同浓度tlh数字PCR重复性试验表

表5 不同浓度invA数字PCR重复性试验表
2.5 人工污染样本检测
通过本文建立的数字PCR方法,检测不同菌量人工污染的新鲜牡蛎样本中的副溶血性弧菌和鼠伤寒沙门氏菌,结果如图5所示,当菌浓度为106CFU·mL-1时,只有1个阴性微滴,超出检测范围。对人工染菌样本,最低可检测出的菌浓度为10 CFU·mL-1,tlh最低检出限为18.6 copies/20 μL,invA的最低检出限是9.8 copies/20 μL。在人工污染样本的检测中,菌浓度和数字PCR拷贝数呈现较好线性关系(R2均>0.98),如图6所示。

图5 用不同浓度菌人工污染牡蛎样本的微滴荧光分布图
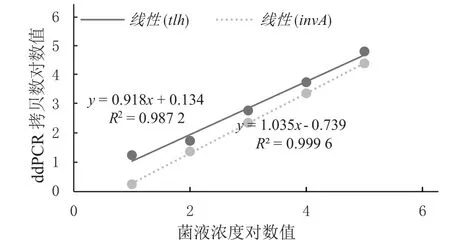
图6 数字PCR拷贝数与菌浓度线性关系图
3 结论与讨论
近年来,随着生物技术的发展和人们对食品检测的日益重视,对食源性致病菌检测方法的建立和研究变得越来越重要。目前用于食源性致病菌检测的方法主要是传统培养技术和PCR技术,传统培养技术耗时长、分辨率低、容易出现假阳性[28],荧光定量PCR依赖标准曲线,抑制剂对其扩增影响明显[29]。和荧光定量PCR相比,数字PCR不依赖标准曲线,抑制剂对其影响小,检测灵敏度高[30-31]。数字PCR技术检测限低,稳定性高在食品安全应用中具有巨大的潜力[32-33],且数字PCR技术具有独特的优势,可实现绝对定量。
近年来,随着数字PCR的发展,其应用越来越广泛,尤其在食品安全方面,常用于食源性致病菌的检测,如周巍等人[34]利用数字PCR技术检测乳制品中的金黄色葡萄球菌,检测特异性良好,检测灵敏度为3.3×101CFU·g-1;赵丽青等人[35]通过数字PCR检测食品中的单增李斯特菌,检出限为(3.6±0.1)copies/20 μL;WANG等人[36]利用数字PCR检测牛奶中的鼠伤寒沙门氏菌,结果表明,与荧光定量PCR相比,数字PCR灵敏度高且抑制剂影响小。
目前,用单一染料同时检测两种食源性致病菌的研究较少。本文建立的数字PCR方法可实现使用一种染料同时检测副溶血性弧菌和鼠伤寒沙门氏菌两种菌,其特异性强、灵敏度高,可检测出107稀释倍数的DNA模板,在检测副溶血弧菌和鼠伤寒沙门氏菌时变异系数均小于5%,对于两种菌的检测菌具有很好的重复性。在人工污染样本中可检测出10 CFU·mL-1的样本。本文提供的数字PCR方法可快速准确的检测出副溶血弧菌和鼠伤寒沙门氏菌,对食品安全具有重要意义。

