楸树叶片年龄与位置效应的生理指标变化研究
冯雪瑾,刘 勇*,李晓丽,邢立霞,贺国鑫,薛敦孟
(1.北京林业大学 林学院,省部共建森林培育与保护教育部重点实验室,北京 100083;2.北京市大东流苗圃,北京 100000)
楸树(Catalpabungei)是我国较为古老的乡土树种之一,有2 000多a的栽培历史,调查发现我国最古老的楸树树龄约为2 500 a,位于山西晋中太谷县青基沟村[1]。楸树因树形优美和花大色艳常被应用于园林绿化[2]。此外,楸树具有木材通直和结构紧密的特性,作为我国珍贵的用材树种而被广泛栽培。通常,年龄超过100 a的大树被称为古树,树龄>300 a或特别稀少珍贵的古树称为一级古树[3]。因为楸树资源需求逐年增加从而引起楸树野生资源和古树资源逐年减少[4]。目前,扦插等无性繁殖成为楸树繁殖的普遍方式。然而,无性繁殖材料生理年龄与采样母树的树龄和部位有关[5],繁殖材料本身较高的生理年龄会导致无性繁殖的楸树幼苗存在苗木质量较差和老化问题。
洪汉辉等[6]对不同年龄的白杨插穗进行扦插发现,扦插苗插穗年龄增加加剧了新生苗的老化状态。王军辉等[7]研究发现年龄效应和位置效应对青海云杉(Piceacrassifolia)硬枝扦插的生根效果有显著影响。在生产上,通常采用以苗繁苗的方式,年龄的累积严重影响后代苗木品质及遗传潜力的发挥。因此,探究包括古树在内的不同树龄的楸树繁殖材料的生理特征差异对今后无性繁殖材料的选取具有重要意义。
存在老化现象的植物膜脂过氧化加剧,体内保护酶系统的活性和数量也会发生改变[8]。林植芳等[9]提出POD活性因植物器官发育和衰老程度不同而表现不同,与植物种类有关。植物在衰老进程中会破坏叶绿体基质,类囊体膨胀并裂解,导致叶绿素含量逐渐降低[10]。李栋栋等[11]也提出植物叶片中叶绿素含量的高低和降解的速率可作为衡量植物衰老与否和衰老快慢的重要标志。有研究表明植物衰老过程中叶绿素和可溶性蛋白的含量均随年龄的增加呈现下降的趋势[12-13],而可溶性糖含量呈现升高趋势[14-15]。同时,有研究对比不同部位叶片的叶绿素含量发现,冠部的叶片叶绿素含量相对根萌条叶片较高[16-17]。郭长花[18]对不同年龄不同部位三倍体毛白杨(Populustomentosa)形态、生长和生理生化指标研究发现,苗木形态差异主要存在于根部与冠部之间。根部枝条相比冠部枝条被认为有更低的生理年龄,而对于楸树来说它们之间的生理特征差异仍然是未知的。
本研究对树龄3、15 a和300 a楸树的根萌条和冠部叶片超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、可溶性糖含量、可溶性蛋白含量和叶绿素含量进行测定,探究年龄效应和位置效应对楸树叶片生理特征的影响,为了解楸树的衰老机制和楸树无性繁殖所需材料选取提供理论基础。
1 材料与方法
1.1 材料采集
2019年5月在北京市大东流苗圃选择树龄为3 a和15 a生长较良好的楸树林,每个年龄各选取长势较平均的3株。同月在北京市慕田峪村、清真寺、大悲寺分别选取了年龄约300 a的3株古楸树。测量每株楸树样本的基本信息,如树高、胸径、冠幅、土壤紧实度、pH值及土壤电导率(表1),并选取树冠上部、根部萌条东、南、西、北4个方向的健壮、无病变损伤的完整叶片作为试验材料,每个方向采集5片以上用锡纸保存至液氮罐中带回实验室。

表1 样本基本信息Table 1 Basic information of the sample trees with different ages
1.2 生理指标测定方法
参照李合生[20]的方法,样品中超氧化物歧化酶(SOD)采用氮蓝四唑光还原法,过氧化物酶(POD)采用愈创木酚法,可溶性蛋白采用考马斯亮蓝法测定,可溶性糖采用蒽酮乙酸乙酯法测定,叶绿素含量采用分光光度计法测定。
1.3 数据处理
数据用Excel 2016进行预处理,用Sigmaplot 14.0作图,通过SPSS 20.0软件采用one-way ANOVA进行方差分析,对方差分析结果有显著差异的数据采用LSD、Duncan方法进行多重比较,分析SOD活性、POD活性、叶绿素含量、可溶性蛋白含量及可溶性糖含量在不同年龄和位置条件下存在的差异情况,以P<0.05为显著水平。
2 结果与分析
2.1 不同年龄楸树根、冠部叶片叶绿素含量比较
3年生和15年生楸树冠部叶片中叶绿素含量无显著差异,但二者均显著高于300年生,其中300年生较3年生冠部叶绿素含量减少了23.89% ;在楸树根萌条叶片中,叶绿素含量呈现随年龄增加逐渐减少的趋势,其中,3年生与300年生相差最大,减少了143.4% ;同一年龄中,除3年生根冠部叶片叶绿素含量差异不显著外,其余年龄冠部叶绿素含量均>根萌条,其中300年生冠部与根萌条叶片相差最大,冠部是根部的1.994倍(图1)。
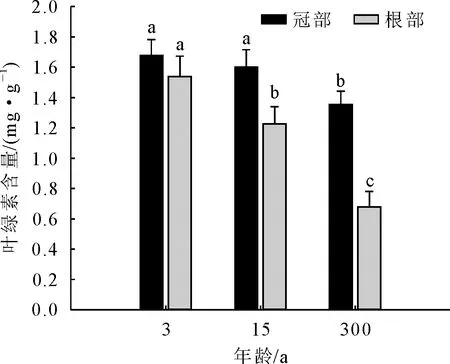
注:不同小写字母表示在P<0.05下差异显著。下同。图1 不同年龄楸树根、冠部叶绿素含量比较Fig.1 Comparison of chlorophyll content in lower and upper crown of C.bungei with different ages
2.2 不同年龄楸树根、冠部叶片可溶性蛋白含量比较
通过比较3、15、300年生冠部叶片可溶性蛋白含量可知(图2),随着年龄增加,可溶性蛋白含量逐渐下降,其中,3年生冠部叶片可溶性蛋白含量最高,较300年生冠部叶片增加了72.81%,与15年生和300年生叶片均呈现显著差异;根萌条叶片可溶性蛋白含量随年龄的增加逐渐下降,且三者之间均有显著差异,其中3年生叶片较300年生高0.638 mg·g-1;同一年龄楸树,除300年生外,根萌条叶片可溶性蛋白含量均显著>冠部,其中3年生根、冠部差异最大,根萌条较冠部增加了12.11%。
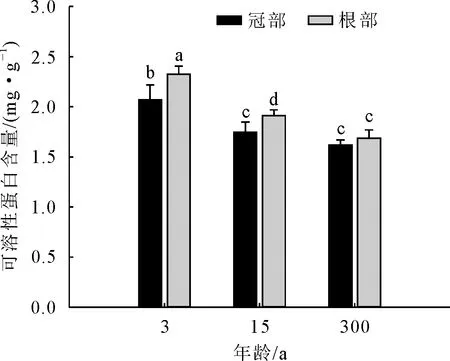
图2 不同年龄楸树根、冠部可溶性蛋白含量比较Fig.2 Comparison of soluble protein content in lower and upper crown of C.bungei with different ages
2.3 不同年龄楸树根、冠部叶片可溶性糖含量比较
从楸树不同年龄的冠部叶片可溶性糖含量可知,随着年龄增加可溶性糖含量呈现下降趋势,且3、15年生和300年生叶片可溶性糖含量呈现显著差异(图3),其中3年生比300年生冠部叶片高出58.71% ;根萌条叶片可溶性糖含量也呈现下降趋势,其中,3年生和15年生根萌条叶片分别与300年生之间差异显著,3年生根萌条叶片可溶性糖含量较300年生高出49.45% ;同一年龄条件下,3年生和300年生中,均表现为冠部叶片可溶性糖含量显著>根萌条叶片,其中,3年生根冠部差异较大,冠部是根萌条可溶性糖含量的1.21倍。
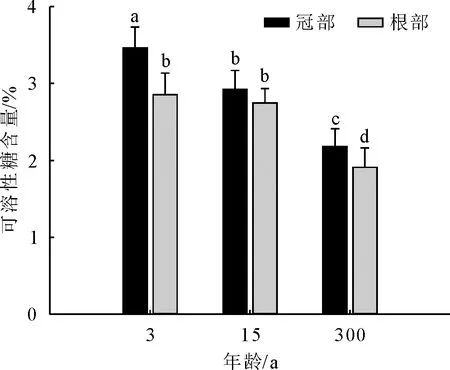
图3 不同年龄楸树根、冠部可溶性糖含量比较Fig.3 Comparison of soluble sugar content in lower and upper crown of C.bungei with different ages
2.4 不同年龄楸树根、冠部叶片POD活性比较
通过比较3、15年生、300年生冠部叶片POD活性可知,整体呈现随年龄增加逐渐上升的趋势(图4),且每2个年龄的活性之间均有显著差异,300年生处取得最大值,为74.59 μ·(g·min)-1,较3年生处的最小值高出139.7% ;根萌条也表现出和冠部相同的趋势,且两两年龄之间差异显著,最大值与最小值之间相差50.11 μ·(g·min)-1;比较各个年龄根萌条与冠部POD活性可知,3、15、300年生楸树冠部POD活性均显著高于根部,差值分别为14.73、23.75、8.09 μ·(g·min)-1。

图4 不同年龄楸树根、冠部POD活性比较Fig.4 Comparison of POD activity in lower and upper crown of C.bungei with different ages
2.5 不同年龄楸树根、冠部叶片SOD活性比较
3、15、300年生冠部叶片SOD活性随年龄增加呈现上升的趋势,其中,3年生叶片SOD活性显著低于其余2个年龄,较300年生叶片SOD活性减少了26.82%(图5) 。比较同一年龄下楸树根、冠部SOD活性,可知3年生根萌条叶片SOD活性显著>冠部,是冠部的1.285倍,其余年龄差异不显著。

图5 不同年龄楸树根、冠部SOD活性比较Fig.5 Comparison of SOD activity in lower and upper crowns of C.bungei with different ages
3 结论与讨论
SOD活性及POD活性随楸树年龄增加呈现不断上升的趋势,可溶性蛋白、可溶性糖及叶绿素含量随年龄增加不断减少。位置效应方面,根萌条叶片SOD活性和可溶性蛋白含量>冠部叶片,而POD活性、可溶性糖含量及叶绿素含量<冠部。300年生楸树叶片抗性较高,且具有明晰的遗传背景,是培育优良楸树较佳的无性繁殖材料。根部枝条相对于冠部枝条生理年龄较少,且300年生根部和冠部叶片可溶性蛋白和POD含量没有显著差异,根部枝条是无性繁殖材料选择的较佳位置。
随着树体年龄增加,细胞膜系统会受到影响,引起抗氧化酶、糖和蛋白等物质外渗,导致代谢变弱,抗衰退能力变弱等[20]。叶绿素是光合作用中捕获光能的主要成分,直接参与了光能吸收和能量转换过程,其降解会引起光合作用的下降[3,21-22]。可溶性糖与调节细胞渗透势有关,其含量升高可提高细胞渗透势,从而提高细胞抵抗外界侵扰的能力[23]。可溶性蛋白含量是氮代谢中一个重要的生理指标,包括大量参与生理代谢的酶类,其含量与植物的生长密切相关[22]。研究结果表明不同年龄条件下叶绿素含量、可溶性糖及可溶性蛋白在根萌条和冠部均呈现随年龄增加逐渐降低的趋势,表明树龄的增加会引起叶片细胞光合能力和新陈代谢效率降低,这与国槐(Sophorajaponica)、巨尾桉(Eucalyptusurophylla×E.grandis)、油松(Pinustabulaeformis)、栾树(Koelreuteriapaniculata)等树种的研究相似[3,25-28]。邬飞波等[29]研究结果表明,SOD活性的增强可以延长细胞生理功能,延缓植株衰老。本研究针对不同年龄楸树的抗氧化酶活性进行比较,结果表明,无论根萌条还是冠部叶片,SOD及POD活性随年龄增加呈现逐渐增加的趋势,表明较高树龄的叶片具有更高的抗性。这与程程[3]对国槐古树生理特性研究中所得出的抗氧化酶活性会随树龄增加逐渐上升的结论相似。之前有研究认为树木衰老严重时,抗氧化酶活性急速下降[3],而楸树本身具有很高的寿命,因此,本研究中300年生楸树可能仍处于其整个生长发育阶段的壮年期。
位置效应方面,根部枝条生理年龄被认为低于冠部枝条生理年龄[30]。苏培玺等[30]对胡杨基部和冠部当年生枝条叶片进行光合生理指标测定发现,冠部蒸腾速率、净光合速率均高于基部,这与本研究中冠部叶片叶绿素含量高于根部叶片研究结果一致,造成这种结果很可能是光环境差异导致的。可溶性蛋白含量在3个年龄中均呈现出根萌条高于冠部枝条的趋势。有学者对北美红杉(Sequoiasempervirens)基部萌条与冠部枝条蛋白含量进行比较[31],结果表明,22-58 ku蛋白在基部枝条大量合成,而冠部枝条蛋白含量相对较低。L.C.Huangetal[32]研究发现,34、36 ku等蛋白在幼年和复壮组织中含量较高。分析可能的原因是,根萌条相对冠部枝条组织较幼嫩,枝条中养分更充实[2],蛋白在幼年和复壮的植物组织中含量高,因此呈现出根部高于冠部的趋势[32-33]。可溶性糖含量在3年生、15年生及300年生楸树叶片中均呈现出冠部大于根萌条的趋势,这与张义等[23]对毛桃(Prunuspersica)幼苗不同部位叶片可溶性糖含量比较试验中,中部活性高于下部的结论相似。SOD作为细胞中重要的保护酶,可以清除自由基和活性氧,防止膜的损伤和破坏。同一年龄不同部位的楸树叶片各生理指标整体表现为,冠部组织相对于根部组织成熟,冠部自由基含量较高。张才喜等[33]研究发现,植株幼年组织较成熟组织自由基存在较少,随开花能力的获得,自由基逐渐增多,因此多年生实生树随叶位的上升,SOD活性逐渐降低,与本研究结果相似,即3年生、15年生及300年生楸树SOD活性均呈现出冠部<根萌条。有研究发现,同一株树不同生长部位POD活性也有差异,其中冠部生长迅速,对POD的需求与合成量相对较高[34],本研究结果也证实了这一点。卡德·艾山等[35]发现POD一般在老化组织中活性较高,幼嫩组织中活性较弱,与本研究根部叶片具有较低POD的结果相同。
——致秋天的花楸树

