纳米金核酸适配体HCR放大比色法检测动物源食品中氨苄青霉素残留
张万方,何金娇,康瑞丽,朱艳平,马 瑞,张同雨,王 蕊,朱子任,郭晋汝,张晨雨,王选年
(新乡学院生命科学与基础医学学院,新乡 453003)
氨苄青霉素(AMP)作为一种广谱抗生素,广泛应用于人类生活的方方面面,在给人类带来极大经济效益的同时,抗生素的滥用也导致了动植物体内抗生素残留,并进一步通过富集效应给大自然和人类带来了威胁[1]。氨苄青霉素残留会对人类产生很多不良影响,如过敏反应、呼吸不畅及癫痫病等[2-3]。随着实现全面小康社会建设的脚步加快和人们生活水平的提高,食品安全越来越受到人们的重视,抗生素残留问题也越来越受到人们的关注。目前常用的青霉素检测方法有:微生物法、高效液相色谱法、免疫荧光法、生物传感器法[4]等,但这些方法都有一些共同缺点:操作复杂,需要专业的仪器和技术人员。近年来有报道利用罗丹明B荧光法对氨苄青霉素残留进行检测[5],此方法利用纳米金使罗丹明B荧光信号淬灭进行检测,但荧光信号本身很不稳定,易发生促灭。因此还需要开发新的更稳定、操作更简便且更易推广的检测方法。
纳米金比色法是利用纳米金的光学特性制备的一种生物反应器。纳米金也称胶体金,是一种粒径1~100 nm的球形纳米材料。纳米金具有独特的光学特性,小粒径金纳米粒子(10 ~ 20 nm)水溶液一般呈酒红色,吸收峰在520 nm附近,当纳米金由于外在的作用发生聚集时,其吸收峰将红移到620 nm附近区域,其颜色也由酒红色变为蓝紫色[6]。核酸适配体是一种寡核苷酸生物识别分子,它可以根据空间互补与所检测靶标高特异性结合[7]。本研究通过设计开发一种发夹DNA探针,以核酸适配体为引发链,通过适配体与氨苄青霉素的结合引发适配体与发夹DNA探针的互补效应,进一步引发级联交叉互补放大效应,最终实现可视化、高效检测氨苄青霉素的目的。
1 材料与方法
1.1 材料
氨苄青霉素,购于美国Sigma公司。 氯化钠、檬酸三钠和氯金酸( HAuCl4 )均为分析纯,购于上海化学试剂公司。
1.2 氨苄青霉素核酸适配体及配套发夹DNA探针的合成
通过文献得知氨苄青霉素的适配体序列为5'-GCGGGCGGTTGTATAGCG-3'[8],发夹型核酸探针的序列为:H1:5'-CATCTCGGTTTGGCTTTCTT GTTACCCCCATAACAAGAAAGCCAAACC-3';H2:5'-TA ACAAGAAAGCCAAACCGAGATGGG TTTGGCTTTCTTGTTATGGGGG-3'[9]。根据HCR放大技术的需要,在此基础上重新设计氨苄青霉素适配体序列,命名为:AMP-1:5'-CCGCC CGCTA ACAAGAAAGCCAAACCCAGATGTCTTGTTATG CGGGCGGTTGTATAGCG-3',所有的核酸序列均由上海生工生物工程有限公司合成。
1.3 杂交链式反应(HCR)溶液的配制
合成的核酸序列,使用ddH2O稀释成1 μmol·L-1的核酸工作液备用。分别取100 μL H1、H2和AMP-1工作液于PCR管,95 ℃ 变性10 min,之后在1 h内缓慢降温至25 ℃。之后将三者1:1:1混匀,即为HCR溶液,–20 ℃保存备用。
1.4 纳米金溶液的制备
取氯金酸配制成0.01%氯金酸溶液200 mL。打开磁力搅拌器,加热并不断搅动。当观察到烧杯中的液体沸腾时,加入5 mL 1%的柠檬酸三钠溶液;继续煮沸搅拌,烧杯中溶液由浅灰色变蓝、变紫最终为酒红色,即为纳米金溶液。停止加热,保持搅拌至溶液降至室温,分装,置于4 ℃中存放[10-11]。
1.5 纳米金溶液的表征
使用透射电子显微镜对纳米金溶液的聚集状态进行表征。实验分为2组:(a)取4 mL制备好的纳米金溶液;(b)取3 mL纳米金 + 1 mL NaCl溶液(4 mol·L-1),按照要求将两种溶液分别滴加到铜网表面,室温下晾晒自然干燥。利用JEM-1200EX透射电子显微镜拍摄样品,使用Nano Measurer软件分析纳米金的粒径大小。
1.6 实验原理
纳米金粒子表面带有负电荷,颗粒之间由于相互排斥力的存在使得纳米金粒子分散在溶液中并保持稳定的状态。当加入发夹探针时,探针的单链粘性末端通过静电作用而吸附在纳米金粒子周围,此时加入高浓度盐,由于发夹探针的保护使得纳米金依旧分散存在而不聚集[12]。而当体系中有目标物氨苄青霉素(AMP)存在时,AMP与其适配体AMP-1相互作用使得AMP-1的发夹打开,AMP-1序列末端与发夹探针H1的单链粘性末端互补,导致H1发夹打开,而H1的序列末端又与H2的单链粘性末端互补,因此又导致H2的发夹双链打开,H2序列末端同样设计了与H1粘性单链末端相互补的序列,故而H2反过来又会使得新的H1链的打开。由此导致H1,H2两条链不断地循环杂交形成无限延伸的杂交双链DNA,实现信号的放大[9]。双链DNA因磷酸骨架的暴漏而表现出负电性,与纳米金表面的负电会产生相互排斥作用,使得纳米金粒子失去保护,在高盐浓度下发生聚集(图1)。纳米金粒子聚集后,颜色由酒红色变为蓝紫色,吸收光谱发生红移。

图1 纳米金核酸适配体HCR放大比色法原理图Figure 1 The schematic diagram of nanometer gold nucleic acid aptor HCR amplification colorimetric method
1.7 实验条件的优化
1.7.1 NaCl浓度优化 分别向100 μL纳米金溶液中加入不同浓度的NaCl溶液,室温条件下孵育10 min后用多功能酶标仪测定各个样品的吸光值,寻找最佳NaCl浓度。
1.7.2 反应时间的优化 将纳米金溶液与HCR溶液混合后孵育不同时间,以样品组与空白组差值最大的时间作为最优反应时间。
1.7.3 HCR溶液使用量的优化 取100 μL纳米金溶液,分别加入不同体积的HCR溶液,随后加入100 μL 1 mol·L-1的NaCl溶液,室温孵育后酶标仪检测分析。
1.8 基于HCR的纳米金检测的氨苄青霉素比色传感方法
取100 μL纳米金溶液加入优化的HCR溶液后,加入不同浓度的氨苄青霉素,室温下孵育10 min,然后加入100 μL NaCl,室温孵育后酶标仪检测分析。
2 结果与分析
2.1 纳米金的表征
将新制备的纳米金溶液添加到比色皿中,设置双蒸水为空白对照,检测纳米金溶液的吸收光谱,扫描波长为400~800 nm,扫描步长为5 nm。结果显示,新制备的纳米金溶液呈酒红色,在520 nm处出现最高吸收峰(图2A)。将3 mL纳米金 + 1 mL NaCl(1、2和4 mol·L-1)溶液混匀,观察颜色变化,发现随着盐浓度的升高,溶液逐渐由酒红色变成蓝色(图2C)。取加入4 mol·L-1NaCl的纳米金溶液检测吸光值,发现最高吸收峰转移到620 nm处,并且只有一个吸收峰(图2B),因此推测此时纳米金溶液已经全部发生聚集。使用电子显微镜对新制备的纳米金溶液和加入4 mol·L-1NaCl溶液后的溶液进行检测,结果显示新制备的纳米金溶液成分散状态,粒径大小约为13 nm(图2D),加入4 mol·L-1NaCl溶液后,纳米金粒子聚集到一起,成团状存在(图2E),与文献报道一致[13]。
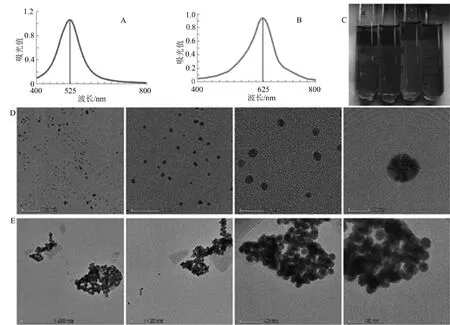
图2 纳米金溶液的表征Figure 2 Characterization of nanometer gold solution
2.2 实验条件的优化
2.2.1 反应条件的优化 向纳米金溶液中加入浓度梯度的NaCl溶液后,结果显示随着NaCl浓度的升高,吸光值A620/520的比值逐渐升高,当NaCl溶液的浓度为1 mol·L-1时达到峰值,说明此时纳米金粒子已经完全聚集,因此确定NaCl溶液的最佳浓度为1 mol·L-1(图3(a))。经过一系列温度梯度和不同反应时间的优化实验,发现HCR溶液与纳米金在37 ℃孵育30 min时盐离子聚集纳米金溶液效果最好,因此该选用条件为最佳反应条件。
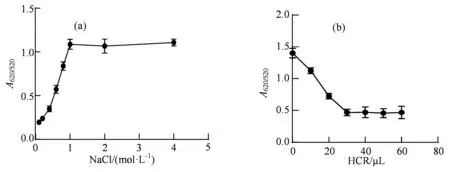
图3 实验条件的优化Figure 3 Optimization of the experimental conditions
2.2.2 HCR溶液使用量的优化 取100 μL纳米金溶液分别加入不同体积的HCR溶液,37 ℃孵育30 min,然后向管中加入1 mol·L-1的NaCl溶液,使用酶标仪检测520 nm和620 nm处的吸光值。结果显示当加入30 μL HCR溶液时反应达到平衡状态(图3(b)),说明此时HCR溶液中的核酸分子能够完全保护在纳米金粒子表面而使之不被盐离子聚集,故HCR溶液的最佳体积为30 μL,即终浓度11.5% (V/V)为最佳浓度。
2.3 氨苄青霉素检测体系的性能评价
2.3.1 体系灵敏度评价 为了确定HCR放大法的灵敏度范围,将氨苄青霉素标准品配置成0~2 μmol·L-1的浓度梯度,按照1.7的方法进行检测。结果显示,随着氨苄青霉素浓度的升高,吸光度比值逐渐升高,拟合方程为y=–0.008 7x2+ 0.261x–0.130 7,R2= 0.992 4(图4(a))。其中,当氨苄青霉素浓度在0~1.2 μmol·L-1时呈现线性关系,线性方程为y= 0.163 6x+ 0.025,R2= 0.995 3(图4(b)),最低检测限可达到10 nmol·L-1。以上结果表明,该方法有较高的灵敏度。
2.3.2 体系特异性评价 为了验证该检测体系的特异性,选取了庆大霉素、四环素、卡那霉素、新链霉素等抗生素与氨苄青霉素进行特异性分析,各种抗生素添加的终浓度均为1 μmol·L-1。结果显示,当更换为其他抗生素时,A620/520的比值非常低,氨苄青霉素的吸光值比值显著高于其他抗生素(图4(c)),表明该检测体系只对氨苄青霉素具有特异性反应。
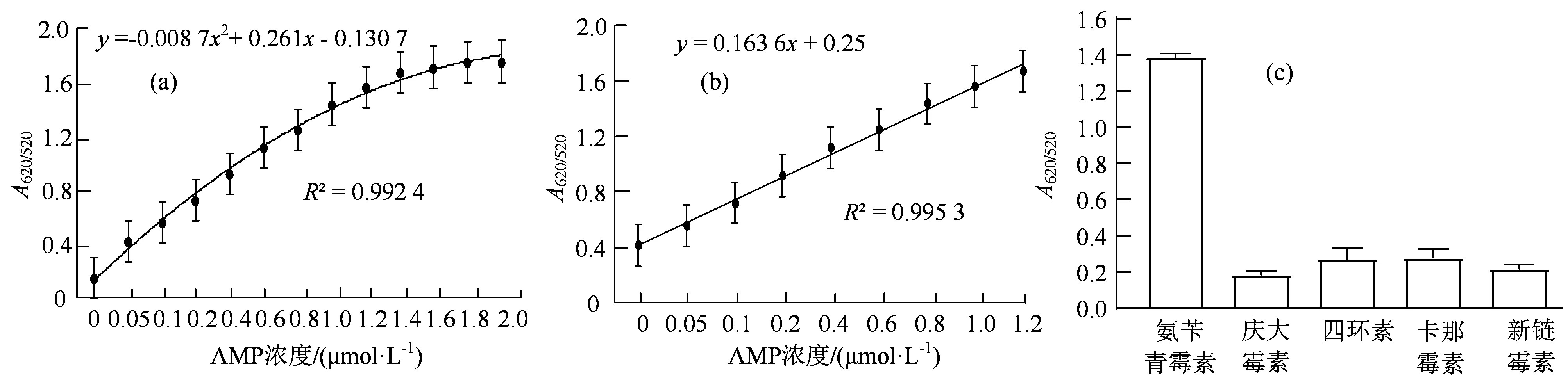
图4 氨苄青霉素检测体系的性能评价Figure 4 Performance evaluation of ampicillin detection system
2.4 实际样品的检测
为了对检测方法的实际应用能力进行检验,选取鱼肉和猪肉两种样品,采用加标回收法进行验证。使用乙腈提取,经C18柱萃取[12]后加入不同浓度的氨苄青霉素标准品,然后按照1.7的方法进行检测。结果显示,氨苄青霉素的回收率在92.30%~103.27%之间(表1),该实验结果表明纳米金核酸适配体HCR放大比色法具有良好的检测性能。

表1 动物性食品中氨苄青霉素检测结果Table 1 The detection results of ampicillin in animal food
3 讨论与结论
氨苄青霉素(AMP),是一种β-内酰胺类广谱抗生素,除抗感染以外,还具有促进动物生长的作用[14],因此在农业领域如畜、禽以及水产养殖中被广泛应用[15-16]。随着生活水平的提高,抗生素的残留问题逐渐成为人们关注的新焦点。目前常用的氨苄青霉素检测方法因操作复杂、成本高、反应体系要求严苛等缺点很难投入大规模的使用。核酸适配体生物反应器是近年来出现的一种新的检测方法,该方法具有性能稳定、操作简单、靶分子范围广等优点[17]。本文采用纳米金核酸适配体杂交链式反应比色法进行氨苄青霉素的检测具有操作简单、反应快速、成本低等优点,有利于进行大规模的推广。
本研究设计合成了一条氨苄青霉素特异性核酸适配体DNA发夹和两条DNA 发夹探针,利用发夹之间序列互补杂交的方法实现信号的级联放大。研究表明该方法的灵敏度范围为0~1.2 μmol·L-1,最低检测限可达到10 nmol·L-1,并且特异性好,对其他类型的抗生素没有非特异性反应,对鱼肉和猪肉的回收率为92.30% ~ 103.27%。综上所述,该方法操作便捷、特异性好且灵敏度高,是检测氨苄青霉素残留的新方法。

