鱼源宿主防御肽生物学活性及其潜在应用
吴 迪 王连生
(中国水产科学研究院黑龙江水产研究所,黑龙江省水生动物病害与免疫重点实验室,哈尔滨 150070)
抗生素的广泛使用导致其在水生生物中大量积累,并严重威胁到动物甚至人类的健康。避免在水产养殖中使用抗生素已成为人类健康和兽医领域面临的主要挑战之一[1]。宿主防御肽(host defense peptides,HDPs),也称为抗微生物肽或抗菌肽(antimicrobial peptides,AMPs),是机体先天免疫系统的重要组成部分,具有抵抗细菌、真菌、病毒和寄生虫等多种微生物病原体的能力[2]。在大多数情况下,HDPs对病原体的特异性较低,不易产生耐药性[3]。此外,部分HDPs还具有中和内毒素、促进血管生成、促进伤口愈合等调节作用[4]。鱼类是HDPs的重要来源,目前已经在鱼类中发现了150余种HDPs。已经被分离出来的鱼源HDPs除了对其小部分进行抗菌活性研究外,其余鱼源HDPs的潜在应用还未被深入研究[5]。因此,阐明鱼源HDPs的分类、生物学活性、作用机制及其潜在的应用前景,不仅能为鱼源HDPs的产业化应用提供理论参考,也对畜牧及水产养殖业的饲料开发与资源利用具有重要意义。
1 鱼源HDPs的分类
1.1 具有α-螺旋结构的鱼源HDPs
具有α-螺旋结构的鱼源HDPs一般含有13~50个氨基酸残基,主要包含piscidins、pardaxins和其他α-螺旋鱼源HDPs。α-螺旋鱼源HDPs的物种来源、氨基酸序列和活性特征等信息见表1。

表1 具有α-螺旋结构的鱼源HDPsTable 1 HDPs isolated from fish with α-helical structure
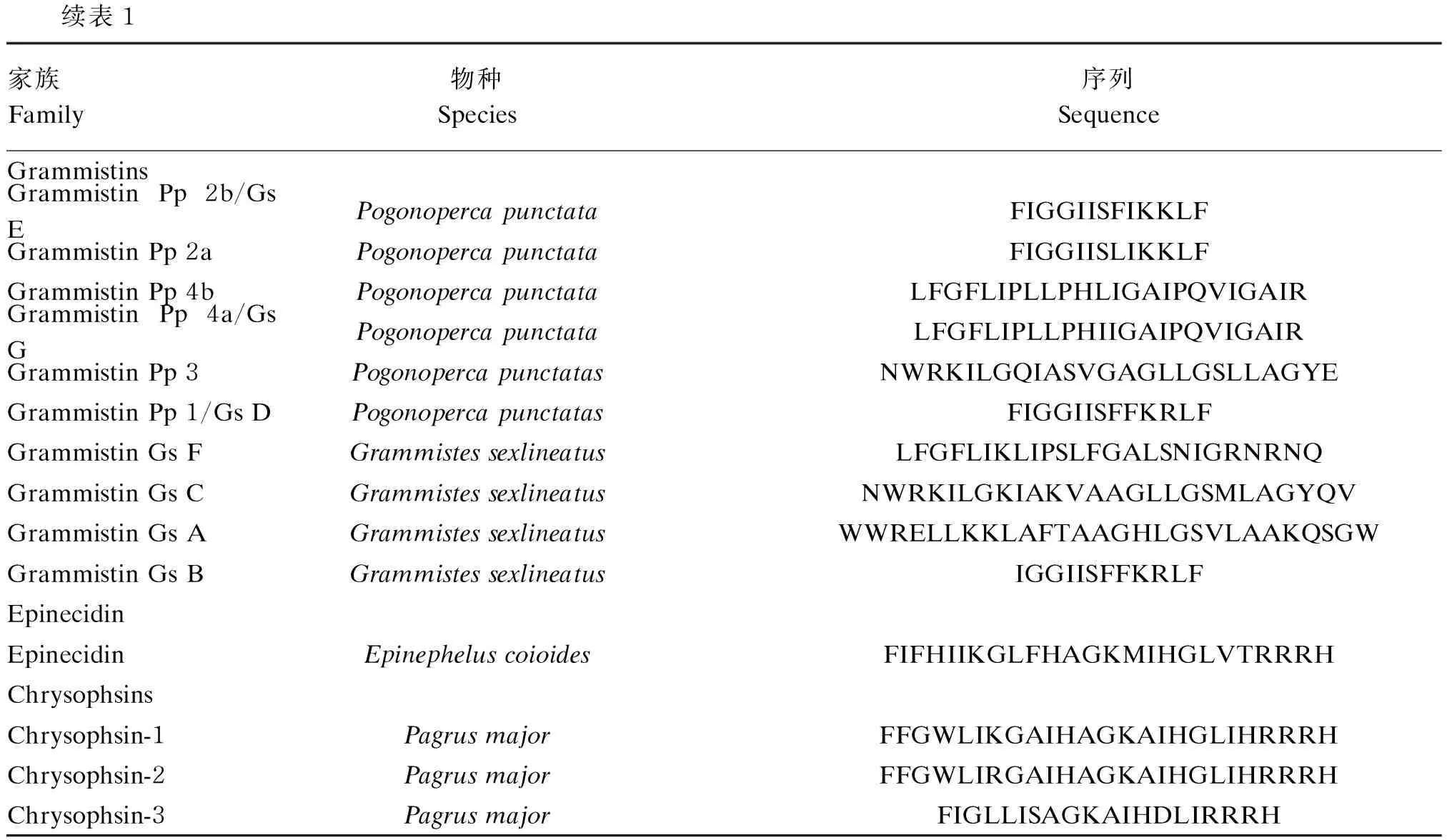
续表1家族Family物种Species序列Sequence活性Activity参考文献ReferenceGrammistinsGrammistin Pp 2b/Gs EPogonoperca punctataFIGGIISFIKKLF 抗细菌(G+/G-)[31]Grammistin Pp 2aPogonoperca punctataFIGGIISLIKKLF抗细菌(G+/G-)[32]Grammistin Pp 4bPogonoperca punctataLFGFLIPLLPHLIGAIPQVIGAIR抗细菌(G+/G-)[32]Grammistin Pp 4a/Gs GPogonoperca punctataLFGFLIPLLPHIIGAIPQVIGAIR抗细菌(G+/G-)[32]Grammistin Pp 3 Pogonoperca punctatasNWRKILGQIASVGAGLLGSLLAGYE 抗细菌(G+/G-)[31]Grammistin Pp 1/Gs DPogonoperca punctatasFIGGIISFFKRLF抗细菌(G+/G-)[31]Grammistin Gs FGrammistes sexlineatusLFGFLIKLIPSLFGALSNIGRNRNQ抗细菌(G+/G-)[31]Grammistin Gs CGrammistes sexlineatusNWRKILGKIAKVAAGLLGSMLAGYQV抗细菌(G+/G-)[31]Grammistin Gs AGrammistes sexlineatusWWRELLKKLAFTAAGHLGSVLAAKQSGW抗细菌(G+/G-)[31]Grammistin Gs BGrammistes sexlineatusIGGIISFFKRLF抗细菌(G+/G-)[31]EpinecidinEpinecidinEpinephelus coioidesFIFHIIKGLFHAGKMIHGLVTRRRH抗细菌(G+/G-)[18]ChrysophsinsChrysophsin-1Pagrus majorFFGWLIKGAIHAGKAIHGLIHRRRH抗细菌(G+/G-)[20]Chrysophsin-2Pagrus majorFFGWLIRGAIHAGKAIHGLIHRRRH抗细菌(G+/G-)[33]Chrysophsin-3Pagrus majorFIGLLISAGKAIHDLIRRRH抗细菌(G+/G-)[33]
1.1.1 piscidins
piscidins是一类具有典型α-螺旋结构的阳离子HDPs,一般由22~46个氨基酸残基组成,且序列中含有大量的苯丙氨酸(Phe,F)、组氨酸(His,H)和异亮氨酸(Ile,I)[6]。piscidins在软骨细胞、肝脏、皮肤和鳃等多种器官中均有表达,但不同亚型的piscidins表达量往往也不尽相同[7]。目前发现的piscidins主要有3类:Ⅰ类piscidins具有22个氨基酸残基,即piscidin-1、piscidin-2和piscidin-3,对细菌和纤毛原生动物具有广泛的活性,仅在肥大细胞中被分离;Ⅱ类piscidins通常含有44~46个氨基酸残基,对细菌和原生动物具有活性,但其活性水平处于Ⅰ和Ⅲ类之间;Ⅲ类piscidins含有55个氨基酸残基,对原生动物具有较高的活性[8]。piscidins的抗菌活性主要依赖于氨基酸序列中含有的His[9]。此外,部分piscidins还具有抗真菌及抗肿瘤的能力[6]。
moronecidins、pleurocidins和piscidins之间具有相似的基因结构,同属于一类HDPs[10]。moronecidins和piscidins几乎是同时在条纹鲈(Moronesaxatilis)中被发现。相比于C-末端区域的氨基酸残基,pleurocidins处于N-末端区域的氨基酸残基往往对其抗菌活性具有更为重要的作用;其中,位于N-端区域第2号位上的色氨酸(Trp,W)和第5、6号位上的Phe残基在HDPs插入细胞膜中起着主要作用[11]。
1.1.2 pardaxins
pardaxins最初是从豹鳎(Pardachirusmarmoratus)背鳍及臀鳍腺体中分离的一类离子型神经毒素,其序列中含有33个氨基酸残基[12]。目前发现的pardaxins主要有5种,各种类之间具有高度的序列同源性,其氨基酸残基仅在第5、14或31号位上存在不同[10]。除抗细菌活性外,pardaxins还可抑制各种癌细胞,包括人纤维肉瘤[13]、乳腺癌[14]和犬肛周腺瘤[15]等。此外,pardaxins对绵羊红细胞表现出一定的溶血活性,且不同种类的pardaxins的溶血活性也不尽相同,如pardaxin-1的细胞毒性可达pardaxin-2的5~10倍[5]。
1.1.3 其他α-螺旋鱼源HDPs
目前还发现了几种与piscidins和pardaxins序列同源性较远的HDPs,分别是gaduscidins、grammistins、epinecidin和chrysophsins。
gaduscidins是一类富含His的HDPs,最早在大西洋鳕鱼(Gadusmorhua)中被分离,在头肾、血液、脑、鳃、肠道和脾脏中均可表达[16]。目前分离出的gaduscidins主要有2种:gaduscidin-1和gaduscidin-2。gaduscidin-1对细菌具有广泛的活性,而gaduscidin-2对细菌则无活性,但gaduscidin-2表现出更高的抗寄生虫活性[17]。gaduscidins与moronecidins的同源关系较远,这可能是其序列中缺少谷氨酰胺(Gln,Q)组成的基序导致的[16]。
3.用法用量[33]:推荐PEI患者餐中服用胰酶制剂,效果优于餐前或餐后服用[39]。胰酶制剂用量主要取决于其所含的脂肪酶量,成人推荐初始剂量为25 000~40 000 IU脂肪酶/餐,如疗效不佳,可依个体增加剂量,最大剂量可用至75 000~80 000 IU脂肪酶/餐(40 000 IU/正餐,2 000 IU/小食)。儿童可给予500~4 000 IU脂肪酶/g膳食脂肪。婴幼儿推荐500~1 000 IU脂肪酶/g膳食脂肪。婴幼儿也可予2 000~4 000 IU脂肪酶/母乳喂养或120 ml婴幼儿配方奶粉。婴幼儿和儿童的推荐最大剂量为10 000 IU脂肪酶/(kg·d)。
grammistins具有高度的两亲性,对革兰氏阳性菌和革兰氏阴性菌均具有良好的抗菌活性。根据序列同源性,grammistins可分为3个亚类:Ⅰ类grammistins通常含有24~25个氨基酸残基,即Gs 1、Pp 4a(Gs 2)和Pp 4b;Ⅱ类grammistins含有12~13个氨基酸残基,即Gs B、Pp 1(Gs D)、Pp 2a、Pp 2b(Gs E);Ⅲ类grammistins含有25~28个氨基酸残基,即Gs A、Gs C和Pp 3。除Gs A、Gs B和Gs C外,其余grammistins均具有不同程度的溶血活性[10]。
epinecidin是从斜带石斑鱼(Epinepheluscoioides)的鳃和肠道中分离到的一类能够保护鱼类免受病原菌感染的HDPs,通常含有21个氨基酸残基[18]。epinecidin除对大多数水产病原菌具有很强的抑菌活性外,还能够促进伤口愈合、血管新生,抑制血液中细菌数量,降低免疫相关炎症因子的基因表达水平[19]。
chrysophins最初是从真鲷(Pagrusmajor)鳃中分离纯化得到的,肽链长度一般为19~25个氨基酸残基[20]。目前已知的chrysophins主要有3种:chrysophsin-1、chrysophsin-2和chrysophsin-3。chrysophins C-末端区域由精氨酸(Arg,R)和His组成的RRRH氨基酸基序可以干扰细胞膜的磷脂双分子层,在HDPs插入脂质膜的过程中起着关键作用[21]。
1.2 含有二硫键的鱼源HDPs
鱼源HDPs按照含有二硫键的数量不同可分为cathelicidins、防御素(defensins)和hepcidins。含有二硫键的鱼源HDPs的物种来源、氨基酸序列和活性特征等信息见表2。
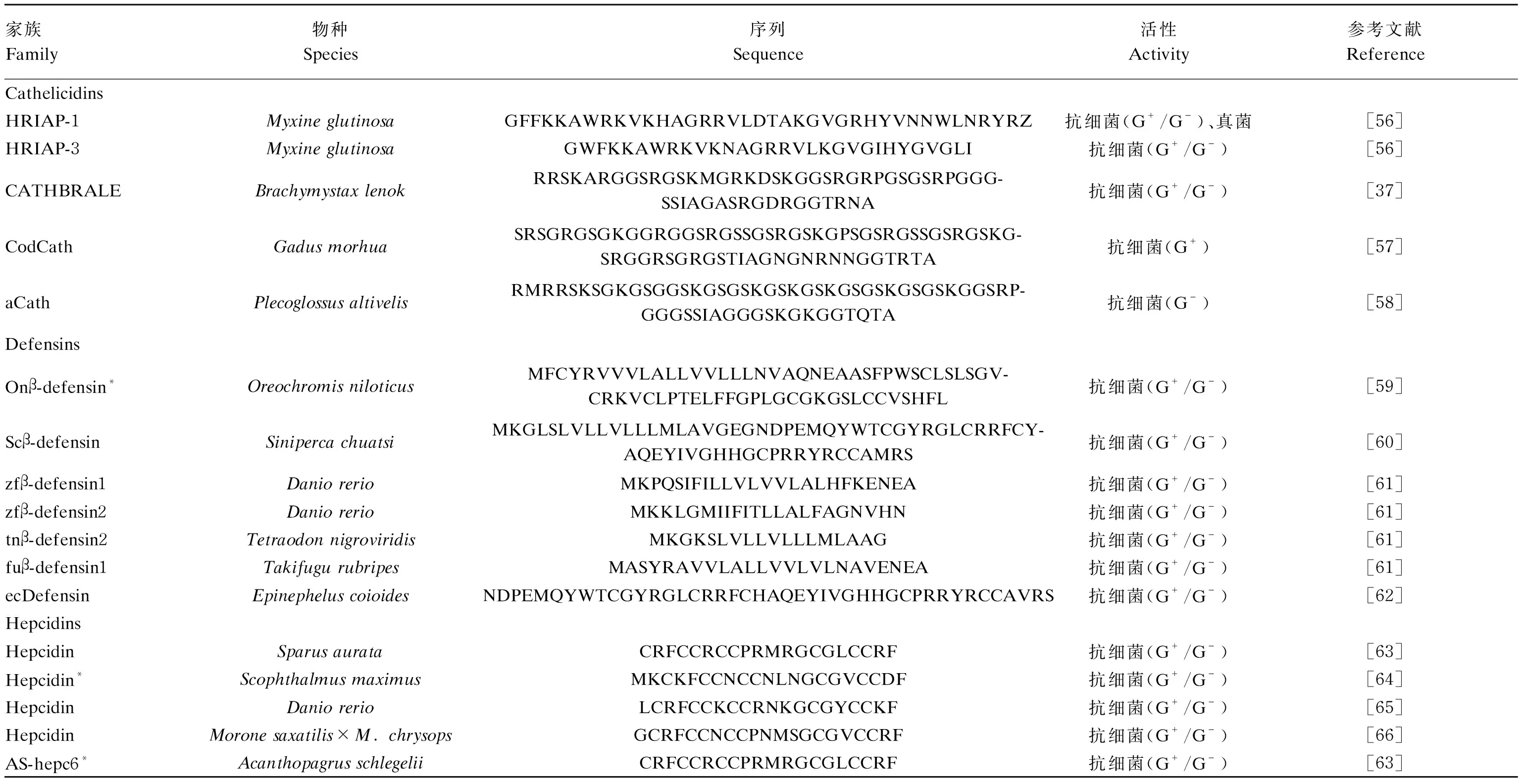
表2 含有二硫键结构的鱼源HDPsTable 2 HDPs isolated from fish with disulfide bond structures
1.2.1 cathelicidins
cathelicidins是一类具有cathelin结构域的高度保守的N-末端前肽,分子质量通常在12 ku且含有单个二硫键[34]。大多数cathelicidins家族的HDPs都含有4个半胱氨酸(Cys,C)残基,主要在中性粒细胞和黏膜等部位表达。成鱼体内cathelicidins的表达存在高度变异,并随cathelicidin基因和鱼体组织的变化而变化[35]。盲鳗科cathelicidins对革兰氏阴性菌和革兰氏阳性菌具有很强的抑菌活性,但对白色念珠菌(Moniliaalbican)无抑菌活性[36]。而鳕科cathelicidins对革兰氏阴性菌及白色念珠菌具有一定的抑菌活性,对革兰氏阳性菌则无抑菌活性。另外,鲑科cathelicidins普遍存在1个包含6个氨基酸(RPGGGS)的重复基元,在遗传上具有不稳定性,呈现出与哺乳动物cathelicidins一定的相似性[37]。
1.2.2 防御素
防御素一般含有6~8个Cys,可以形成β-折叠结构,分子质量为3~6 ku[38]。防御素按照Cys的位置及配对情况,可以分为3个不同的构型:α-防御素、β-防御素和θ-防御素。截至目前,仅在鱼类中发现一种构型的HDPs,即β-防御素[39]。鱼源β-防御素是一类长度为60~77个氨基酸残基的防御肽[40]。除对细菌有抑菌活性外,鱼源β-防御素对鱼类特异性病毒,如病毒性出血性败血症病毒(VHSV)、病毒性神经坏死病毒(VNNV)和新加坡石斑鱼虹彩病毒(SGIV)等也具有抗病毒活性[41]。β-防御素的基因表达由β-葡聚糖、脂多糖(LPS)和肽聚糖诱导,主要在皮肤中表达,也可在肾脏、鳃、脾脏等多种组织中高水平表达[42]。β-防御素在鱼类组织中的广泛分布证明了β-防御素在先天免疫中的作用及其在抗感染中的重要性[43]。目前,β-防御素除被用作抗菌剂外,也作为免疫应答因子在细胞信号活动、未成熟树突状细胞激活以及免疫调节等方面发挥作用[44]。
1.2.3 hepcidins
hepcidins是目前已知的含有最多Cys的阳离子HDPs[45]。hepcidins通常由20~26个氨基酸组成,结构特点为4个二硫键形成的稳定β-折叠发夹结构[46]。hepcidins主要在肝脏中表达,少部分在皮肤、鳃、肾脏、性腺、心脏和血液中表达[47]。目前,已经在鲑科、鲈科、鲽科及其他科中鉴定并分离出30多种hepcidins。不同强度的病原体攻击、氧合水平和铁离子(Fe3+)浓度是引起hepcidins表达变化的重要因素[48]。除了与运铁蛋白相互作用外,二硫键在维持hepcidins的稳定构象中起着至关重要的作用[40]。hepcidins具有很强的DNA结合能力,利用亮氨酸(Leu,L)取代Cys后可导致DNA结合能力和抗菌活性完全丧失[49]。hepcidins除了对原生动物寄生虫具有较强的活性外,还对革兰氏阴性菌和革兰氏阳性菌具有一定的抗菌活性[50]。此外,hepcidins还能够促进肠内铁吸收,促进巨噬细胞铁再循环。因此,hepcidins也被称为铁调素[51-52]。
1.3 组蛋白衍生肽
组蛋白是核小体结构的主要组成部分,它通过形成组蛋白衍生肽在生物体的防御系统中起着至关重要的作用[53]。组蛋白衍生肽已经在多种鱼类中被鉴定,并证明具有广谱抗微生物活性。除少部分组蛋白衍生肽在鳃、肠道和脾脏等组织中发现外,其余均在皮肤中表达。最近,一种来自于沃尔窄尾魟(Himanturawalga)的组蛋白H2A衍生肽——hipposin被鉴定并分离出来。同源性分析表明,hipposin属于组蛋白H2A超家族,与鱼类中其他组蛋白来源的HDPs具有序列同源性。作为一种DNA结合蛋白,组蛋白是染色质的重要蛋白质组成部分,也是细菌和病毒蛋白的受体,主要与DNA稳定和基因表达调控有关[54]。因此,组蛋白衍生肽除具有抗菌、抗癌和抗生物膜等生物学活性外,还参与细胞的转录调控和凋亡,在机体先天免疫中起着关键作用[55]。
2 鱼源HDPs的生物学活性
2.1 抗细菌
HDPs的抗细菌活性研究的最为深入,几乎所有的鱼源HDPs对革兰氏阴性菌和革兰氏阳性菌都具有抑制作用。对于革兰氏阴性菌,鲶鱼(Silurusasotus)皮肤黏液提取出的CF-14在最小抑菌浓度(MIC)为31.3 μg/mL时,表现出对大肠杆菌(Escherichiacoli)的抑制作用[67]。伯氏肩孔南极鱼(Trematomusbernacchii)转录组获得的trematocine除对大肠杆菌具有抑制作用外,还对短小芽孢杆菌(Bacilluspumilus)和枯草芽孢杆菌(Bacillussubtilis)具有极强的抑制作用[68]。翘嘴鲌(Erythroculterilishaeformis)肝脏中分离得到的leap-2在浓度为5×MIC条件时,1 h内即可杀死嗜水气单胞菌(Aeromonashydrophila)[69]。组蛋白衍生肽NK-lysin截短得到的NKL-24通过膜活性细胞杀伤机制对副溶血弧菌(Vibrioparahaemolyticus)具有良好的抑制作用[70];同样的结果在大黄鱼(Larimichthyscrocea)血红蛋白LCH4中被证实,在25 μg/mL的MIC浓度条件下LCH4即可抑制副溶血性弧菌的生长[71]。对于革兰氏阳性菌,从鲈鱼(Laterscalcarifer)中分离得到的moronecidins在1×MIC浓度下作用4~6 h后表现出对鲍曼不动杆菌(Acinetobacterbaumannii)的杀菌作用[72]。盲鳗(Myxineglutinosa)肠道中提取的HF-18体外试验表明,在MIC浓度为4 μg/mL时即可产生对耐药金黄色葡萄球菌(Staphylococcusaureus)的抑制作用,且在作用1 h内即可杀死细菌[73]。
通常情况下,鱼源HDPs对细菌的抑制能力主要归功于其对细菌膜的破坏作用及形成孔洞的能力。带正电荷的HDPs与带有负电荷的细菌膜,通过调节线粒体的柔韧性,导致孔隙形成和线粒体解聚,最终导致细菌的死亡[2]。部分HDPs通过与DNA结合和竞争性抑制,穿透细菌膜并引起膜的扰动[67]。此外,组蛋白可以通过细胞膜穿透到细菌内,然后与其遗传物质结合或包裹病原体,形成中性粒细胞外网状陷阱(NETs),从而展现出广泛的抗菌功能[74]。然而,尽管组蛋白干预NETs的机制尚不清楚,但当组蛋白被特异性抗体阻断时,其抗细菌活性也受到了抑制,这也证明了组蛋白在中性粒细胞外网状陷阱的形成中发挥了重要作用[75]。
2.2 抗病毒
与抗细菌活性相比,鱼源HDPs抗病毒活性的研究似乎还不够深入,但目前已经证明了鱼源HDPs的抗病毒活性。最近发现,从眼斑拟石首鱼(Sciaenopsocellatus)TFPI-1 C-末端截取的TO17具有抗病毒活性,将TO17与传染性脾肾坏死病毒(ISKNV)共孵育后注射到眼斑拟石首鱼体内分别感染3、5和7 d后,眼斑拟石首鱼脾脏内的病毒数量均有明显下降[76]。Guo等[62]从斜带石斑鱼的肝脏中分离出β-防御素,研究发现该β-防御素能够减少新加坡石斑鱼虹彩病毒(SGIV)和神经坏死病毒(NNV)的感染和复制,就像EC-hepcidin-1和EC-hepcidin-2能够减少SGIV的发生一样[77]。此外,就hepcidins而言,在利用抗沙门氏菌弹状病毒(SCRV)和沙门氏菌呼肠孤病毒(MsReV)对鲤鱼(Cyprinuscarpio)上皮瘤细胞(EPC)和草鱼(Ctenopharyngodonidella)鳍细胞(GCF)进行感染时发现,SA-hepcidin-2具有抗病毒活性,而SA-hepcidin-1则不具有抗病毒活性。
尽管已经证明了鱼源HDPs的抗病毒活性,但其机制仍不清楚,但最可能的原因是HDPs通过与病毒粒子直接结合、促使病毒颗粒凝集成团以及抑制病毒增殖等途径实现其抗病毒活性[78]。
2.3 抗肿瘤
近年来,已经证实了某些来源于鱼类的HDPs能够诱导肿瘤细胞的凋亡。piscidins对肿瘤细胞具有良好的抑制作用。利用来自于尼罗罗非鱼(Oreochromisniloticus)的piscidin-3对人骨肉瘤细胞MG-63进行处理后发现,浓度为1 μmol/L的piscidin-3可显著抑制细胞活力,诱导DNA片段化并通过上调线粒体裂变蛋白表达和下调融合蛋白表达来有效地增加线粒体网络的断裂,导致MG-63细胞的线粒体功能障碍与内源性凋亡[79]。piscidin-4可以通过激活外源性Fas/FasL受体途径介导MG-63细胞凋亡[80]。作为α-微管蛋白的主要相互作用伴侣,HDPs还可以通过影响微管蛋白-微管平衡达到杀死肿瘤细胞的目的。例如,piscidin-4可以与微管蛋白结合,破坏A549细胞中的微管网络,引起癌细胞中微管细胞骨架的缺陷[81]。最近,人们还发现斜带石斑鱼中鉴定出的epinecidin-1能够诱导线粒体超极化并产生活性氧(ROS),触发半胱天冬酶(Caspase)依赖途径,造成恶性胶质母细胞瘤细胞U87MG的死亡和DNA损伤[19]。同样地,来源自杂交条纹鲈(Moronesaxatilis×M.chrysops)的piscidin-1在对正常细胞不产生副作用的同时,对骨肉瘤OSA细胞表现出较强的细胞毒性作用[82]。
2.4 其他活性
尽管研究的较少,但鱼源HDPs对真菌和寄生虫也具有一定的抑制作用。piscidin-2对白色念珠菌(Moniliaalbican)和马拉色菌(Pityrosporum)具有有效的抗真菌活性,而合成的ecPi-2S、ecPi-3S和ecPi-4S则具有较强的抗毕赤酵母菌(Pichiapastoris)活性[5]。关于抗寄生虫活性,Umasuthan等[83]证明了从条石鲷(Oplegnathusfasciatus)分离出的Of-Pis1β具有抗寄生虫活性。同样,piscidin-1和piscidin-2及其衍生肽piscidin-2β在最低寄生浓度下显示出对梨形四膜虫(T.pyriformis)的抗寄生虫活性[84]。
鱼源HDPs对寄生虫的抑制机理与其抑菌机理相似,主要是通过破坏寄生虫细胞膜,破坏膜电势平衡和干扰细胞正常代谢,进而达到抗寄生虫的目的[85]。
3 鱼源HDPs的潜在功能及应用
目前,已有小部分新型鱼源HDPs被研发成功并应用于动物生产与实践之中。将鱼源HDPs作为饲料添加剂使用,不仅可以提升动物的生长性能,还可以抑制动物肠道内病原菌的产生,调节动物机体微生态平衡[3]。此外,充分了解并应用鱼源HDPs的其他潜在功能,将更好地促进我国水产及畜牧行业的健康发展。
3.1 免疫原性药物的开发
全世界对鱼卵和幼虫的运输需求日益增加,这不仅使得养殖业疾病的传播速度难以控制,也导致药物化合物的使用增加,从而导致了细菌对抗生素耐药性的产生[86]。目前,水产养殖业使用的疫苗并没有达到预期效果,这严重阻碍了渔场的经济发展和动物福利。鱼源HDPs因其广泛的生物学活性和独特的作用机制,被认为是理想的水产养殖或临床开发抗病原微生物的工具。目前,已有相关研究关注鱼源HDPs作为免疫活性化合物的可能性。Pan等[87]以杂交罗非鱼(Oreochromisspp.)为研究对象,研究了tilapia piscidin-3 (TP3)和tilapia piscidin-4 (TP4)对创伤弧菌(Vibriovulnificus)感染的保护作用,当病原菌与TP3和TP4共处理后,罗非鱼的存活率分别提高到95.3%和88.9%。此外,有研究也证实了尼罗罗非鱼鱼腥蛋白样肽能够通过1型免疫应答(Th1)分子途径增强哺乳动物和鱼类的免疫应答[88]。
鱼源HDPs还可作为改进疫苗的潜在佐剂。目前,福尔马林灭活疫苗导致了严重过敏反应、皮疹、呼吸困难及肿胀等问题,亟需寻找降低疫苗灭活剂毒性的替代品。鱼源HDPs可以通过中和毒性因子或诱导细菌改变结构与形状降低其毒性,这可能为灭活细菌病原体提供了一种绿色安全的新方法。在注射Epi-1灭活的日本脑炎病毒(JEV)后,小鼠的存活率提高到100%。将pleurocidin(PLE)、哈维氏弧菌(Vibrioharveyi)抗原和重组甘油三磷酸脱氢酶(rGAPDH)蛋白包裹于聚丙交酯-乙交酯共聚物(PLG)中生产出的微粒(PLG-PLE/rGAPDH MP)能够稳定地释放PLE和rGAPDH,并且在疫苗接种2次后,对哈维氏弧菌产生了长期的保护性免疫[89]。目前,基于鱼源HDPs的灭活疫苗在水产养殖中的应用报道还十分有限,但在未来,鱼源HDPs有望成为一种较好的福尔马林替代品。
3.2 抗氧化剂的开发
抗氧化化合物存在于每一种生物体内,可保护机体免受ROS对DNA、脂质膜和膜蛋白的损害。具有抗氧化性能的HDPs通常含有3~20个氨基酸残基,此类鱼源HDPs N-端区域通常含有疏水性氨基酸残基或酸性残基。通常条件下,HDPs不具有抗氧化特性,一旦其在胃肠道消化或发酵后,便释放出其抗氧化功能[5]。鱼源HDPs的功能往往取决于其结构、组成和具体序列。研究表明,富含Cys残基、硫化物键、疏水残基甚至His残基的阳离子短肽,往往被认为是具有超强抗氧化功能的候选物质。因此,某些来自鱼类的HDPs可能比其他来源的肽具有更强的抗氧化效果[90]。此外,尽管ROS造成的损害与许多影响公共健康的疾病有关,但适量的ROS能够影响DNA甚至脂质膜,增强鱼源HDPs的抗菌功能[5]。虽然鱼源HDPs具有成为抗氧化剂的潜力,但HDPs作为抗氧化剂的潜在能力在鱼类中还未被深入探索。未来可在水产养殖、人类医学等领域将鱼源HDPs作为抗氧化剂进行应用。
4 小结与展望
基于其自身广泛的生物学活性,鱼源HDPs在畜牧、食品,甚至是医药领域均展现出巨大的潜在用途,但鱼源HDPs的相关研究仍存在一些问题,这些问题限制了它们在生产应用中的进一步发展。鱼源HDPs的局限性包含以下几点:一是生产成本高。目前,绝大部分鱼源HDPs的获取仍是通过分离提取,发酵工程技术的广泛应用或许是解决该问题的有效途径。二是大部分天然鱼源HDPs细胞选择性差。现阶段常用的鱼源HDPs分子改造手段主要有氨基酸残基替换、肽链截取及活性中心杂合与结构优化;此外,也可利用脂肪酸修饰合成脂肽、运用纳米技术自组装或亲水性聚合形成纳米自组装肽或水凝胶肽,提高HDPs的细胞选择性。三是鱼源HDPs在体内易失活且对蛋白酶消化极具敏感性。目前,许多学者也在开发新策略以延长鱼源HDPs的半衰期,包括引入非天然氨基酸、肽链环化和N-末端酰胺化等,以防止其在体内酶解。随着研究的不断深入,新发现的天然鱼源HDPs及人工合成的HDPs种类会越来越多,经济、高效、广谱的HDPs无疑具有巨大的应用潜力和广阔的发展前景。

