CAMK4⁃EGR3 信号轴对先天性甲状腺功能减退症大鼠海马神经元树突的影响
唐青英,赵 捷,李海英,申飞飞,吴尤佳
南通大学附属医院儿内科,江苏 南通 226001
先天性甲状腺功能减退症(congenital hypothy⁃roidism,CH)是新生儿常见的内分泌疾病,其发病率为1∶4 000~1∶2 000[1]。如果短期内未及时治疗,往往导致大脑发育缺陷,形成永久性的智力障碍[2]。甲状腺激素(thyroid hormones,TH)调控众多基因,分别与神经始祖细胞迁移、神经元分化、髓鞘形成、突触传递、细胞黏附和细胞凋亡等生物学过程相关[3]。近年来研究表明,环境中有害成分可通过母婴传播途径干扰胎儿的TH 水平,导致胎儿发育迟缓和智能发育障碍[4]。
Ca2+/钙调蛋白依赖性蛋白激酶Ⅳ(Ca2+/calmodu⁃lin⁃dependent protein kinase Ⅳ,CAMK4)是一种多功能的丝氨酸⁃苏氨酸蛋白激酶,对细胞内Ca2+的变化敏感,在细胞内钙(Ca2+)增加时被激活。CAMK4 上游启动子的5′端-750 到-700 的区域为TH 反应元件,与甲状腺激素受体(thyroid hormone receptor,TR)作用,并受TH 调节。在大鼠脑发育过程中,CAMK4 受三碘甲状腺原氨酸(triiodothyronine,T3)以时间和浓度依赖性的方式调控,在神经元特异性基因调控中发挥重要作用[5]。TR 为核受体超家族的成员,其分子中含有A~F 6 个区,组成3 个功能域。TR有若干异形体,其中TRα1、TRβ1和TRβ2可结合T3,为功能性受体。这3种功能性受体与T3的结合能够解除CAMK4 启动子TH 反应元件的抑制状态,从而介导CAMK4基因的表达。
在神经元中,CAMK4 是Ca2+诱导基因表达的有效中介。研究表明Ca2+及其信号控制树突的发育[6],细胞内Ca2+浓度升高可导致树突形态的改变,而树突是神经元接收其他神经元信息输出和整合输入信号的主要地方,在学习和记忆形成过程中,突触连接的动态建立是其中的关键因素,因此树突形态的建立对神经回路的发育至关重要[7]。且海马作为重要的学习和记忆脑功能区,含有确定的主要细胞类群以及输入和输出神经环路,是CH 最先累及的重要器官结构之一[8],而CH影响海马发育的分子机制尚不明确。故本课题研究CAMK4 在CH 大鼠中表达的变化及对神经元树突发育的影响,以初步探讨CH大鼠海马神经发育异常的可能机制。
1 材料和方法
1.1 材料
成年孕鼠(体重220~250 g)由南通大学实验动物中心提供,动物实验符合3R原则并通过南通大学动物伦理委员会批准(审批号:S20190316⁃201)。2⁃巯基⁃1⁃甲基咪唑(2⁃mercapto⁃1⁃methylimidazole,MMI)(Sigma公司,德国),mirVana miRNA 分离试剂盒(Ambion公司,美国),RNA纯化珠(Illumina公司,美国),TruSeq RNA 文库制备试剂盒v2(Illumina 公司,美国),TRIzol(Gibco公司,美国),逆转录试剂盒(Roche 公司,瑞士),抗CAMK4 抗体(Proteintech 公司,美国);抗早期生长反应蛋白3(early growth re⁃sponse protein 3,EGE3)抗体(Santa Cruz 公司,美国);抗GAPDH抗体(CST公司,美国),Neurobasal培养基(Gibco公司,美国),HBSS平衡盐溶液(Gibco公司,美国),B27(Stemcell 公司,加拿大),胎牛血清(Gibco 公司,美国),DMEM 高葡萄糖培养基(Sigma公司,德国),siRNA 转染试剂盒(广州锐博生物公司),抗MAP2 抗体(Abcam 公司,英国);驴抗鼠Al⁃exa488(Proteintech 公司,美国),T3(Sigma 公司,德国)。
1.2 方法
1.2.1 CH大鼠模型的建立
为了诱导SD大鼠的先天性甲状腺功能减退,从孕鼠妊娠第9天起(E9,阴道栓出现的日期为E0)到仔鼠出生后第21 天(P21),在孕鼠的饮用水中持续给予0.02%的MMI。对照组的孕鼠给予清洁饮用水。采用化学发光免疫分析法测定妊娠第17 天的孕鼠及出生后第1、7 和21 天(P1、P7 和P21)仔鼠血清TH水平。
1.2.2 大鼠海马转录组测序及生物信息学分析
根据生产商的操作指南,用mirVana miRNA 分离试剂盒从P1、P7 和P21 仔鼠中提取海马总RNA。然后通过RNA纯化珠筛选,并进行文库构建和转录组测序分析。利用TruSeq RNA 文库制备试剂盒v2构建文库,并由Illumina HiSeq 2000测序50个周期,通过Illumina质量过滤器保存用于序列分析。与对照组相比,差异表达的mRNA 被指定为大于或小于2 倍变化的标准。参照NCBI数据库或AGRIS数据库(https://agris⁃knowledgebase.org/)以E 值阈值为10-5,用Blastx 注释基因的功能。对所有热图,基因都是通过Jensen⁃Shannon 分化聚类的。利用IPA 软件在差异表达基因的基础上构建一个重构的基因网络,以研究它们的调控通路和细胞功能。
1.2.3 定量实时聚合酶链反应(q⁃PCR)
用TRIzol 制备海马或神经元的总RNA,逆转录试剂盒进行逆转录,在20 μL反应体系中,包含2 μg总RNA,0.2 U/μL 逆转录酶,0.5 mmol/L dNTP 混合物,1 μmol/L Oligo⁃dT 引物。在q⁃PCR 检测前,将cDNA以1∶4稀释。上海Generay公司设计和合成了序列特异性引物:CAMK4,正向引物5′⁃TGGAG⁃CAGTTGTTCT⁃3′和反向引物5′⁃CCTCGAATCTCAG⁃GTGC⁃3′;EGE3,正向引物5′⁃CTCAGATGGCTA⁃CAGAGAATGTG⁃3′和反向引物5′⁃ACCAGTTG⁃GAAGGAGAGTCG⁃3′。反应的初始变性周期为94 ℃5 min,然后依次为94 ℃30 s,60 ℃30 s,72 ℃30 s,共45 个循环。在每个退火步骤中记录荧光。每次PCR 运行结束后,系统自动分析数据,得到扩增图。将这些基因的表达量归一化为内源性的GAPDH的cDNA。
1.2.4 蛋白质免疫印迹(Western blot)
用含有1%SDS、100 mmol/L Tris⁃HCl、1 mmol/L PMSF的裂解液从神经元培养物或海马中提取蛋白质。用BCA法测定每个标本的蛋白浓度,以保持相同的总蛋白量。蛋白提取液在95 ℃热变性5 min,在10% SDS⁃PAGE 上电泳分离,转移到PVDF 膜上。膜与1∶1 000 TBST 稀释初级抗体于4 ℃过夜,其次与对应的1∶1 000稀释二抗室温孵育2 h。膜清洗后,使用ECL化学发光液扫膜显色。
1.2.5 原代海马神经元的培养和siRNA转染
取E17的SD胎鼠制备原代海马神经元,海马在HBSS 平衡盐溶液中解离,移至基础高糖培养基,在37 ℃下,0.125%胰蛋白酶消化20 min,然后加入2倍体积的含胎牛血清的高糖培养基停止消化,细胞于1 000 r/min离心4 min。去除上清液后,将细胞重悬于含血清培养基中,对于原代培养、解离的细胞被接种在包被聚D⁃赖氨酸的小圆玻片及6 孔板内,细胞密度为1×104个/cm2,37 ℃细胞培养箱培养4 h 后换含B27 的neurobasal 培养基。通过生产商的操作指南对原代海马神经元进行siRNA 转染,在15 μL的20 μmol/L siRNA 储存液中加入120 μL(1×)ribo⁃FECTTMCP 缓冲液,然后加入12 μL riboFECTTMCP试剂。在室温下轻轻混合并孵育15 min后,将转染复合物加入培养于neurobasal培养基(终体积2 mL)的神经元中,siRNA 的最终浓度为150 nmol/L,并在37 ℃细胞培养箱培养24 h 后测定相应的siRNA 转染效率。
1.2.6 细胞免疫荧光
PBS 将培养原代海马神经元的小圆玻片清洗3 次,后于室温下4%多聚甲醛中固定30 min,后在PBS 中洗涤3 次,5 min/次,于含0.1%TritonX⁃100、5%新生山羊血清和5%马血清的PBS 中37 ℃水浴锅封闭1 h,将一抗在PBS 中稀释后加在玻片上,在4 ℃下孵育16 h后,用PBS洗涤,加入二抗,在4 ℃下孵育16 h,PBS洗涤封片后拍摄。
1.3 统计学方法
统计分析使用GraphPad Prism 8 软件。采用Levene 检验对数据进行正态性检验和方差分析。不同组间比较采用独立样本t检验、单因素方差分析及Bonferroni 检验。所有数据以均数±标准差()表示。P<0.05为差异具有统计学意义。
2 结果
2.1 先天性甲状腺功能减退引起的大鼠海马组织基因表达的变化
为揭示CH 在大鼠海马发育过程中的作用,分别在P1、P7 和P21 对CH 组及对照组仔鼠海马组织进行转录组分析。在3个时间点进一步整合并鉴定与CH 神经活性、配体受体相互作用等重要生物学过程相关的9 个功能基因。与对照组相比,这些基因在海马组织中表现出动态变化,如热图和树状图所示(图1A)。为了阐明CH损伤对海马神经元生长的影响机制,通过IPA 构建了一个基因网络,确定CAMK4是响应甲状腺激素减少的突出调节因子(图1)。数据表明,CAMK4 可能是介导CH 子代海马异常生长的潜在因子。
2.2 CAMK4的表达情况
通过Western blot进行CAMK4蛋白质水平验证(图2)。可以发现CAMK4 的蛋白表达趋势与测序结果一致,对照组大鼠中CAMK4 表达呈时间依赖性升高,P7时即可达到峰值,P7与P21的CAMK4表达无明显差异;而CH大鼠的CAMK4表达普遍低于对照组水平。基于上述蛋白水平验证的结果可以发现,CAMK4 的表达水平在CH 大鼠中均明显低于相应时间点对照组大鼠,提示CAMK4与TH 水平具有相关性,可能受TH调节。

图2 Western blot分析CH大鼠海马Camk4的表达Figure 2 Expression of Camk4 in the hippocampus of CH rats by Western blot
2.3 原代海马神经元siRNA敲降CAMK4的表达对神经元树突的影响
在原代海马神经元中通过转染siRNA的方式敲降CAMK4 的表达,进一步研究CAMK4对神经元树突的影响。首先,通过转染敲降了约50%的CAMK4基因表达水平(图3A),继续培养原代海马神经元5 d后拍摄细胞荧光图观察神经元树突的形态变化(图3C)。可以观察到敲降CAMK4基因表达后的神经元树突平均长度明显减小,显著低于正常海马神经元。

图3 CAMK4缺乏对海马神经元树突的影响Figure 3 The effect of CAMK4 deficiency on hippocampal neuronal dendrites
2.4 T3对原代海马神经元培养的直接影响
在原代培养的CH海马神经元中加入T3能诱导CAMK4 的再表达并对海马神经元的树突产生影响。分别从基因、蛋白质水平验证,在CH原代海马神经元中加入5 nmol/L T3 后,CAMK4 的RNA 及蛋白表达均呈时间依赖性上升(图4A、B)。同时观察加入T3后24 h及48 h神经元树突的变化,结果显示加入T3后神经元树突平均长度均增加,且48 h最明显(图4C、D)。

图4 T3刺激增加Camk4的表达及海马神经元的树突长度Figure 4 T3 increased the expression of Camk4 and the length of dendrites in hippocampal neurons
2.5 EGR3的表达情况
在大鼠海马组织测序结果中,通过IPA 基因网络图发现CAMK4⁃EGR3存在相关性。因此,在原代海马神经元CAMK4 的siRNA 转染实验中,在CAMK4 水平敲降约50%的条件下,PCR 检测EGR3的相应表达情况,可以发现随着CAMK4 的表达下降,EGR3 的基因水平也显著降低(图5A),验证了CAMK4可以调控EGR3的表达。在体内水平,通过Western blot 检测EGR3 的蛋白表达情况,如前CAMK4 的表达趋势,EGR3 呈时间依赖性增加,CH大鼠在P7及P21均明显低于正常大鼠(图5B)。
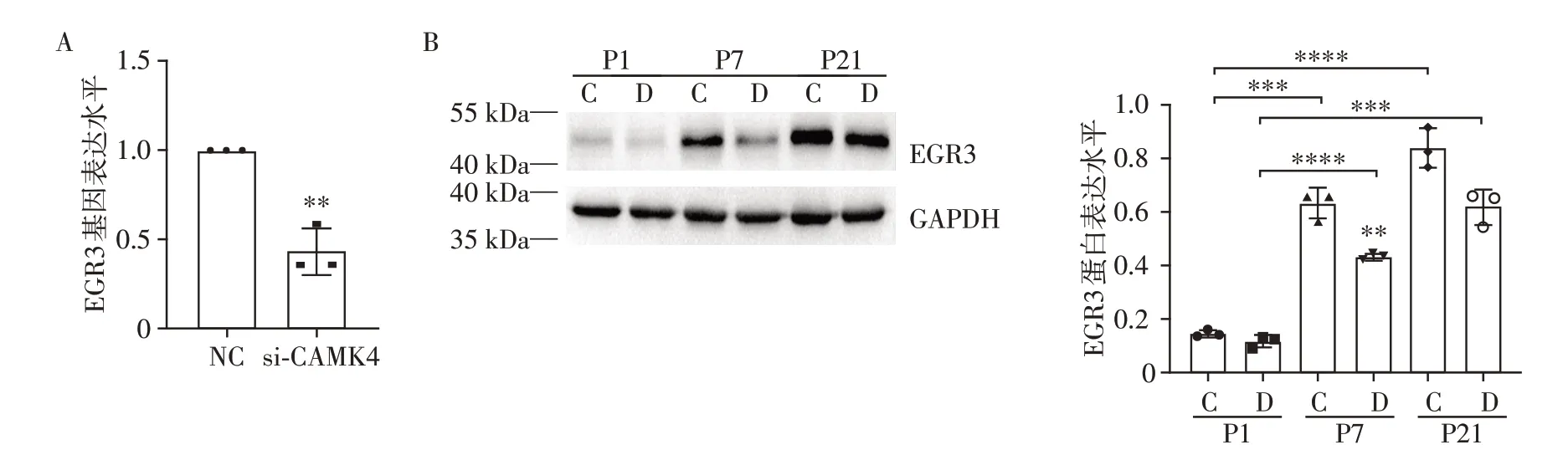
图5 CH大鼠海马EGR3的表达Figure 5 Expression of EGR3 in the hippocampus of CH rats
3 讨论
3.1 甲状腺功能减退对生长发育的影响
在课题组的前期研究中已成功验证了CH大鼠模型的构建[9]。TH 对神经系统的发育及功能调节十分重要,特别在胎儿期和婴儿期,甲状腺激素不足会严重影响脑的发育、分化和成熟,且不可逆转,对胎儿产生不利的妊娠结局[10]。临床上CH患儿的主要特征包括智能落后、生长发育迟缓和生理功能低下[11]。在实验中观察到CH 大鼠的体格发育较正常大鼠明显落后,体重增长缓慢,外观上CH 大鼠毛发光泽差、耳廓贴颅,且运动迟缓,与临床表现相一致。
3.2 甲状腺功能减退时CAMK4的调节
在构建的CH 大鼠模型中,甲减组的T3 水平显著低于正常组,T3与TR的功能性受体(TRα1、TRβ1和TRβ2)结合减少,而这3种功能性受体与T3的结合能够解除CAMK4 启动子TH 反应元件的抑制状态,因此在CH 大鼠中,低T3 水平可导致CAMK4 基因的表达下调。同时,在CH 大鼠原代海马神经元培养基中加入T3 刺激,CAMK4 的表达随时间明显上升,进一步证明了甲状腺激素可调控CAMK4 的表达。在T3 刺激后,CH 大鼠原代海马神经元的树突平均长度亦相应增加,促进了神经元的树突生长,而利用siRNA敲降CAMK4表达后海马神经元的树突平均长度显著降低。综上,在CH 条件下甲状腺激素通过CAMK4 途径调控神经元树突生长发育的相关生理活动。
3.3 EGR3与CAMK4表达的相关性
即时早期因子(immediate early genes,IEGs)是一类对各种环境刺激反应迅速和短暂激活的基因,许多IEGs编码转录因子调控下游靶基因,这些靶基因可能介导了它们在神经生物学过程中的作用,包括突触可塑性和记忆形成[12]。早期生长反应蛋白(early growth response protein,EGR)是IEGs 编码的转录因子家族[13]。EGR 可以将环境影响转化为大脑的长期变化,从而影响神经元的可塑性。作为转录因子,EGR3 可以激活大量下游靶点,通过改变突触来响应环境刺激,以及参与轴突和树突的发育[14]。因此,在学习、记忆和神经可塑性过程中EGR3 可能扮演了重要的角色。本实验初步探讨了CAMK4可能调控EGR3的表达,并影响海马神经元的树突生长发育,为探讨CH大鼠海马发育异常提供可能机制。但尚未在大鼠体内水平观察给予CH大鼠T3替代治疗后CAMK4⁃EGR3信号轴表达的变化,在后续的实验中将继续深入研究。
先天性甲状腺功能减退会导致大鼠海马组织中CAMK4及EGR3的蛋白表达水平均显著下降,神经元树突的长度减小;给予T3 刺激后,海马神经元的CAMK4 的表达升高,树突长度随之增加;其中EGR3 与CAMK4 表达水平明显相关,并受CAMK4调节。以上结果初步表明了CAMK4⁃EGR3 信号轴在CH大鼠海马神经发育异常中发挥重要作用。

