二、三倍体牙鲆肌肉和脑组织实时定量PCR内参基因的筛选及鉴定
杜 娜 , 张 敏, 吴志昊 焦 爽 尤 锋 谭训刚
(1. 中国科学院 海洋研究所 中国科学院海洋大科学研究中心, 中国科学院 实验海洋生物学重点实验室 山东省实验海洋生物学重点实验室, 山东 青岛 266071; 2. 青岛海洋科学与技术试点国家实验室 海洋生物与生物技术实验室, 山东 青岛 266237; 3. 中国科学院大学, 北京 100049; 4. 青岛科技大学, 山东 青岛266061)
细胞决定、生长发育、分化、繁殖、细胞癌变及凋亡等生化途径都与基因的表达模式息息相关。具有灵敏度高、动态变化范围大、高通量且精确定量的实时定量聚合酶链式反应(qPCR)被应用于检测基因表达水平变化的研究中[1], 包括相对定量和绝对定量两种方法, 其中应用最为广泛的是相对定量方法。但是该方法受到多种因素的影响[2-3], 其中一个重要的因素就是相对实时荧光定量方法中的内源参考基因或管家基因的选择。由于相对定量是将目的基因表达水平与标准化内参基因相比较, 这就要求所选取内源参比基因在生物的不同生长过程及不同组织间具有尽可能小的变化。
多倍体诱导是一种产生新基因型的育种方法。当生物被诱导成多倍体时, 其基因组的数量和结构会发生变化, 并导致某些基因的表达水平发生改变[4]、转录水平的调控和翻译后修饰的改变, 这些都可能引起基因过表达或基因沉默, 结果导致生物表型改变[5]。一些研究表明, 在某些三倍体鱼类中, 其基因表达水平降低到二倍体的状态, 这种现象称为剂量补偿效应[6]。除此之外, 在三倍体杂交鱼种中还出现不完全显性的效应[6,7], 即三倍体生物中等位基因的表达模式与其二倍体个体不同, 包括同一基因在二、三倍体个体间的表达差异, 以及同一个基因在不同组织之间的表达差异。在三倍体鲨鱼(Squalius alburnoides)的性腺中,vasa、β-肌动蛋白基因(β-actin)、核糖体蛋白L8基因(rpl8)和3-磷酸甘油醛脱氢酶基因(gapdh)的表达仅来自于一套基因组[8], 而在三倍体鲫鱼(Carassius auratus)中, 由于剂量补偿的影响,管家基因β-肌动蛋白的绝对表达量与二倍体相等[9]。这表明染色体加倍后, 无论是组织特异性基因还是管家基因的表达水平相比二倍体都可能发生变化。因此, 在多倍体的相关研究中需要筛选合适的内源参比基因, 才能准确检测相关基因表达水平的变化。
牙鲆(Paralichthys olivaceus)是中国北方、韩国和日本沿海地区重要的海水养殖经济鱼类。不同的研究对于二、三倍体牙鲆生长性状的优势分析并不相同, 这种现象是否由基因补偿效应等机制引起的并不明确。要探究牙鲆三倍体与二倍体之间的差异表达基因, 就必须筛选合适的参比基因来对相关基因进行标准化校正, 从而使结果更可靠。已知18S核糖体RNA(18S rRNA)被认为是表达相对稳定的基因,而且在二倍体牙鲆胚胎发育过程的不同阶段表达水平相对稳定[10]。因此, 在本实验中, 作者先测定18S rRNA的变化, 再以它为参考对其他广泛使用的7个候选参考基因进行了定量鉴定: β-肌动蛋白基因(β-actin)、β-2-微球蛋白基因(b2m)、3-磷酸甘油醛脱氢酶基因(gapdh)、核糖体蛋白L17基因(rpl17)、α-微管蛋白基因(α-tub)、延伸因子-1-α基因(ef1-α)、泛素结合酶基因(ubc-e)。通过分析这些基因在牙鲆二、三倍体的肌肉和脑组织中表达量及在个体和倍性之间的稳定性, 以获得较合适的内源参比基因, 用于分析组织和器官发育相关基因在牙鲆二倍体和三倍体中表达的差异, 从而探究染色体加倍对组织和器官发育的影响。
1 材料与方法
1.1 样品
样品采集于中国科学院海洋研究所养殖的幼鱼,二倍体和三倍体牙鲆各3条, 其中二倍体牙鲆的体质量分别是95.5、101、91 g, 三倍体牙鲆的体质量分别是63.5、65.5、54 g。麻醉后采集肌肉和脑于200 μL Trizol(Invitrogen, 美国)中, 并在-80 ℃冰箱保存直至使用。
1.2 总RNA提取
按照Trizol试剂使用说明提取样品的总RNA。提取后, 用Thermo NanoDrop 2000超微量分光光度计测定RNA浓度, 使用普通琼脂糖凝胶电泳检测其完整性。
1.3 定量PCR
按照 PrimeScript RT reagent Kit with gDNA Eraser (Takara, 日本)试剂盒的说明书合成cDNA第一链, 作为定量PCR的模板。按照SYBR®Premix Ex Taq™II (Tli RNaseH Plus)试剂盒说明书配置定量PCR反应体系, 使用Applied Biosystems 7300 Fast Real-Time PCR扩增仪(Life Technologies, 美国)进行。PCR反应条件采用两步法, 程序是95 ℃变性 30 s;然后是95 ℃变性 5 s, 60 ℃退火20 s, 35个循环。所有的样品同时重复3次, 取Ct均值。
根据ZHONG等[10]的结果, 作者对18S rRNA采用绝对定量方法进行, 先扩增18S rRNA的基因组片段(引物为18S rRNA-G-F 和 18S rRNA-G-R)(表1)。将PCR所得片段连接到Peasy-T3 载体 (全式金生物技术有限公司), 通过测序验证获得带有正确片段的质粒。利用去内毒素质粒提取试剂盒(康为世纪生物科技有限公司)提取质粒。用Thermo NanoDrop 2000超微量分光光度计测量浓度, 然后按照一定的比例(5×101~5×108)稀释作为模板进行qPCR反应。以质粒拷贝数为横坐标, Ct值为纵坐标, 绘制标准曲线。以获得的各个组织cDNA为模板, 进行qPCR反应, 根据标准曲线以及测得的胚胎样品Ct值, 可计算得到样品的18S rRNA拷贝数, 以二倍体的表达量做为基准折算出倍数。

表1 基因组克隆引物和基因实时定量PCR所用引物Tab. 1 Primers for genomic cloning and real-time quantitative PCR

续表
而对于其他β-肌动蛋白基因(β-actin)、3-磷酸甘油醛脱氢酶基因(gapdh)、核糖体蛋白L17基因(rpl17)、α-微管蛋白基因(α-tub)、延伸因子-1-α基因(ef1-α)、β-2-微球蛋白基因(b2m)和泛素结合酶基因(ubc-e) 等7个基因(引物见表1), 则以18S rRNA为内参基因, 以相对定量PCR方法, 用2-ΔΔCt法计算其相对于18S rRNA表达量的倍数, 再根据标准曲线及各自18S rRNA的Ct值计算得到的18S rRNA拷贝数, 折算出各自的绝对拷贝数, 最后再以二倍体组织的表达量作为基准折算出倍数。
1.4 数据分析
除了绝对定量分析表达倍数的方法, 还参考ZHONG等[10]和LIVAK 等[11]的方法, 利用2-ΔCt方法进行表达倍数的计算, 这两种分析方法的数据采用Graph Pad Prism 6.01进行作图, 并利用t检验 (unpairedt-test)分析不同倍性之间基因表达的差异及单因素方差分析基因表达的稳定性(one way ANOVA);另外, 还通过NormFinder[12]方法分析基因表达稳定性, 以获取最优的内参。
2 结果
2.1 牙鲆二倍体和三倍体肌肉和脑中18S rRNA的表达
作者对牙鲆二倍体和三倍体的肌肉和脑中的18S rRNA进行了绝对定量分析, 根据标准曲线计算了各自的表达量, 以二倍体的为标准进行了表达倍数分析(图1), 结果发现在牙鲆二倍体和三倍体不同的组织中, 18S rRNA的表达在不同倍性之间的差异是不同的。尽管18S rRNA在牙鲆三倍体和二倍体肌肉间的差异在4倍以内, 但其有显著性(P=0.024 7)(图1a); 而其在牙鲆三倍体和二倍体脑间的差异没有显著性(P=0.055 7)。

图1 牙鲆二倍体和三倍体肌肉、脑组织中18S rRNA的表达差异Fig. 1 The fold change of 18S rRNA in the muscle and brain of diploid and triploid olive flounder
2.2 牙鲆二倍体和三倍体肌肉和脑中内参基因Ct值的分析
Ct值是反映基因表达量的一个反应阈值, 其值越大, 说明表达量越低; 不同样品间的数值差异越小, 样品间的基因的表达量差异越小。作者通过对ubc-e、ef1-α、rpl17、α-tub、gapdh、b2m和β-actin的Ct值分析(图2), 发现它们在不同倍性中的差异很小, 但从中也能发现肌肉中ubc-e和b2m的Ct偏高,在26以上; 脑中ubc-e、gapdh的Ct值在26以上。而从不同个体的Ct值还可以发现gapdh和b2m的Ct值在不同倍性的个体之间差异较大。

图2 不同基因在牙鲆二倍体和三倍体肌肉和脑中的Ct值Fig. 2 Ct value of different genes in the muscle and brain of diploid and triploid olive flounder
2.3 肌肉和脑中其他7个基因的表达倍数
作者以18S rRNA作为参比基因, 通过相对定量对其他7个基因的表达量进行了分析, 再通过各自样品18S rRNA的绝对表达量折算出各基因的表达量, 最后分别以二倍体肌肉和脑中的表达量作为基准, 对他们的表达量进行了倍数的折算, 结果发现仅α-tub的表达在牙鲆三倍体肌肉和二倍体肌肉之间有显著差异(图3)(P=0.007 2), 其他6个基因的表达没有显著性差异; 而所有基因的表达在牙鲆三倍体脑和二倍体脑之间并没有显著差异(图4)。

图3 绝对定量方法分析不同基因在牙鲆二倍体和三倍体肌肉中表达倍数的差异

图4 绝对定量方法分析不同基因在牙鲆二倍体和三倍体脑中表达倍数的差异Fig. 4 The fold change of different genes in brain of diploid and triploid olive flounder using absolute quantification method
2.4 以2-ΔCt方法分析表达倍数差异
根据ZHONG等[10]在牙鲆胚胎期内参基因筛选的建议, 作者利用2-ΔCt方法对其他7个基因的表达量进行了分析[10-11], 以二倍体肌肉和脑中的表达量为基准, 对他们的表达量进行了表达倍数的折算, 结果发现α-tub的表达在牙鲆三倍体和二倍体肌肉之间(P=0.032 5)有显著差异, 其他6个基因的表达没有显著性差异(图5); 而所有基因在牙鲆三倍体和二倍体脑中的表达均没有显著差异(图6)。

图5 2-ΔCt方法分析不同基因在牙鲆二倍体和三倍体肌肉中表达倍数的差异Fig. 5 The fold change of different genes in muscle of diploid and triploid olive flounder using 2-ΔCt method

图6 2-ΔCt方法分析不同基因在牙鲆二倍体和三倍体脑中表达倍数的差异Fig. 6 The fold change of different genes in brain of diploid and triploid olive flounder using 2-ΔCt method
2.5 牙鲆三倍体和二倍体肌肉和脑中不同基因表达稳定性的比较
作者对18S rRNA、ubc-e、ef1-α、rpl17、α-tub、gapdh、b2m和β-actin在不同个体及不同倍性的肌肉和脑中的表达进行了稳定性分析(图7、图8)。
利用基因拷贝数计算表达倍数后发现, 在牙鲆肌肉中这些基因表达的稳定性没有显著性差异(图7a),但α-tub表达的变化幅度最小,ubc-e、ef1-α次之,rpl17、β-actin、18S rRNA较次之,gapdh、b2m表达的变化幅度最大。通过2-ΔCt值获取基因表达倍数的分析结果显示(图7b), 肌肉中这些基因表达的稳定性没有显著性差异,α-tub表达的变化幅度最小,ubc-e、ef1-α次之,rpl17、β-actin、18S rRNA较次之,gapdh、b2m的变化幅度最大。

图7 不同基因在牙鲆二倍体和三倍体肌肉中表达的稳定性分析Fig. 7 The stability of expression of different genes in muscle of diploid and triploid olive flounder
计算基因拷贝数进行表达倍数的分析显示(图8a),脑中这些基因表达的稳定性有显著性差异, 但ef1-α、rpl17、β-actin的变化幅度最小,ubc-e、α-tub次之, 再b2m、gapdh较次之, 18S rRNA表达的变化幅度最大。通过2-ΔCt方法获得基因表达倍数的分析表明(图8 b);脑中这些基因表达的稳定性有显著性差异,ef1-α、β-actin、rpl17表达的变化幅度最小,ubc-e、α-tub次之,gapdh、b2m较次之, 18S rRNA表达的变化幅度最大。
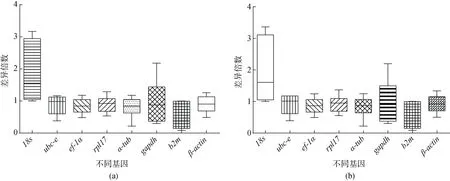
图8 不同基因在牙鲆二倍体和三倍体脑中表达的稳定性分析Fig. 8 The stability of expression of different genes in brain of diploid and triploid olive flounder
利用NormFinder[12]对肌肉和脑中18S rRNA、ubc-e、ef1-α、rpl17、α-tub、gapdh、b2m和β-actin的稳定性进行了分析, 结果显示肌肉中稳定性最好的是rpl17、β-actin(表2),ef1-α次之,ubc-e较次之;脑中稳定性最好的是ef1-α、rpl17,β-actin次之(表3)。

表2 肌肉中基因表达稳定性分析Tab. 2 Gene expression stability analysis in muscle

表3 脑中基因表达稳定性分析Tab. 3 Gene expression stability analysis in brain
3 讨论
本研究针对牙鲆二、三倍体的肌肉和脑组织中的内参基因进行了筛选, 以期筛选到相对实时定量PCR较适宜的内参基因。
作者发现利用绝对定量方法与2-ΔCt方法分析同一内参基因差异表达时所获结果间的差异很小。在筛选内参基因时, 使用绝对定量的优势是真实反映了其实际表达的情况, 只有保证内参基因的表达符合其实际情况, 才能筛选到合适的内参基因, 但其分析过程比较复杂, 需要通过标准曲线等一系列过程才能获得最终结果。尽管2-ΔCt方法来源于相对定量的2-ΔΔCt方法[11], 但获得的结果却与绝对定量接近,且其分析过程较绝对定量简单, 因此在筛选内参基因时, 也许使用2-ΔCt方法代替绝对定量的方法会更简单方便。
在肌肉中通过绝对定量分析发现, 18S rRNA和α-tub的表达在牙鲆二倍体和三倍体中有着显著性差异, 其他基因没有显著性差异, 这与三倍体鲫鱼中β-actin的表达量与二倍体的没有差异是一致的[9],即出现了剂量补偿效应[6]。而在2-ΔCt分析方法中发现, 只有α-tub的表达在牙鲆三倍体和二倍体的肌肉之间有显著性差异。虽然本实验所筛选基因的表达在不同倍性之间的差异很小, 但是稳定性分析的结果表明无论是绝对定量分析还是2-ΔCt分析,α-tub的表达在不同个体之间以及倍性之间的变化差异最小,是比较适合的内参基因,ubc-e和ef1-α次之; 而Normfinder 分析发现rpl17、β-actin是比较适合的内参基因,ef1-α为次合适内参基因。因此, 不同方法获得的内参基因并不相同, 也许使用多个内参基因分析更能反应实际表达的变化[14],ef1-α可以作为牙鲆三倍体和二倍体肌肉中较合适的内参基因之一。
在牙鲆三倍体和二倍体的脑中, 无论是绝对定量分析还是2-ΔCt分析都没有发现表达具有显著性差异的基因, 因此这些基因的表达表现出剂量补偿效应[6]。虽然这些基因的表达在不同倍性之间的差异很小, 但稳定性分析显示ef1-α、rpl17、β-actin的表达在不同个体及倍性之间的稳定性最好, 是比较适合的内参基因, 且NORMFINDER[12]分析发现ef1-α、rpl17是比较适合的内参基因。因此ef1-α、rpl17是不同倍性牙鲆脑组织中比较适合的内参基因。
作者发现内参基因具有组织特异性, 这与其他相关研究结果类似。比如, ZHENG等[15]在感染病原菌的牙鲆及对照个体的内参基因筛选过程中发现内参基因具有组织特异性; 在转基因和非转基因斑马鱼(Danio rerio)[14]研究中也发现斑马鱼内参基因的筛选也具有组织特异性。有的研究发现内参基因亦具有物种特异性的特点, 以及多个内参基因分析更能反应实际表达的变化[14]。ZHENG等[15]在牙鲆中获得的内参基因与相同组织下斑马鱼[14]的内参基因不同, ZHONG等[10]获得适合牙鲆发育时期的内参基因与牛胚胎期[2]的不同, 作者获得的适合牙鲆的内参基因与斑马鱼中同一组织的适宜内参基因也不同[14]。斑马鱼中进行多个组织的定量PCR分析时需要采用多个内参基因[14], ZHONG等[10]在筛选适合牙鲆发育时期的内参基因时也发现同时用多个内参基因才能符合整个发育时期分析的要求, ZHENG等[15]在筛选牙鲆感染病原菌的内参基因时也出现类似的趋势。本研究中也发现不同分析方法获得较适宜内参基因存在差异, 用多个内参进行分析是比较可靠的。因此针对不同物种和组织, 根据目的需求筛选合适的内参基因, 甚至使用多个内参基因进行分析, 才能获得可靠、最优的研究结果。

