白芷乙素对溃疡性结肠炎小鼠的影响
宋少华,李海舰,李莉娟,方晓琳
(广东省第二人民医院检验医学部,广东广州 510317)
溃疡性结肠炎(ulcerative colitis,UC)是一种比较常见的炎症性疾病,临床上UC患者常表现为腹胀、腹痛、腹泻、便血以及炎症等,严重影响UC患者的身体健康[1]。目前,对UC病因的探究尚不完全清楚,其与机体生理、遗传因素、环境和心理变化等均关系密切[2]。目前,临床上常用于治疗UC的药物主要包括柳氮磺吡啶、氨基水杨酸、糖皮质类激素和免疫抑制剂等,虽然其短期对UC患者的症状改善有益,但如长期应用或大剂量应用则可引起多种不良反应的发生[3]。近些年来,越来越多的中药有效成分对UC的治疗展现出良好的效果[4],其对抗UC新药的挖掘具有较好的启发作用。针对目前开发抗UC新药的需要仍迫在眉睫,从中药寻找抗UC新药是一种可行的新方法。
白芷是伞形科植物杭白芷或白芷的干燥根,具有祛风止痛、解表散寒、消肿排脓、燥湿止带以及宣通鼻窍的功效[5]。白芷乙素是白芷植物中一种呋喃香豆素类活性成分,其抗炎、抗氧化、保护心血管和抗凋亡等新的药理作用已逐渐被发现[6]。已有研究报道白芷可通过降低IL-1β水平,升高IL-10水平,以及下调NF-κB蛋白活性,从而改善UC大鼠的症状[7]。此外,临床研究报道茵陈白芷汤治疗慢性结肠炎湿热内蕴型39例取得较好的效果[8]。但是白芷乙素对UC是否有防治作用目前未见研究报道。基于前期本课题组预实验初步筛查发现白芷乙素对UC小鼠具有明显的症状改善作用,本实验通过构建急性UC小鼠模型,探讨白芷乙素对小鼠UC的作用及其机制,以期为日后抗UC新药开发提供实验依据。
1 材料与方法
1.1 主要试剂
白芷乙素(质量分数≥98%,上海晨易生物科技有限公司,批号:20190205);TNF-α、IL-1β、IL-6和IL-10 ELISA检测试剂盒(博士德生物技术有限公司,批号分别为23913119104、42574412547、32565248754、65487547821);SOD和MDA检测试剂盒(南京建成生物有限公司,批号分别为20210412、20210324);TLR4和NF-κBp65单克隆抗体(abcam公司,批号分别为HM2298、CH4257)。
1.2 动物分组与给药
2月龄雄性SPF级C57BL/6小鼠60只,体质量18~22 g,湖南斯莱克景达实验动物有限公司提供,生产许可证号:SCXX(湘)2018-0003。动物适应性喂养7 d后开始本实验。将小鼠按体质量随机分为空白对照组、模型组、柳氮磺胺吡啶组(LD组:0.5 g/kg)、白芷乙素低剂量组(BZ-L:6 mg/kg)、白芷乙素中剂量组(BZ-M:12 mg/kg)和白芷乙素高剂量组(BZ-H:24 mg/kg),每组10只。建模当天灌胃给药,连续7 d,空白对照组和模型组灌胃等量生理盐水。
1.3 溃疡性结肠炎模型构建
参照文献[9]方法构建小鼠UC模型,具体方法如下:小鼠连续自由饮用3%DSS水溶液7 d,其中每隔1天更换新配的DSS溶液。空白对照组饮用正常水。
1.4 疾病活动指数(DAI)评分
实验过程中每日观察各组小鼠的行为学,观察大便的性状、便血等,主要参照文献[10]方法对各组小鼠进行DAI评分,详见表1。

表1 DAI评分标准Table 1 Scoring criteria of DAI
1.5 结肠组织形态损伤评分
本实验第7天结束后,采用颈椎脱臼方式处死小鼠,剖开动物腹腔,小心取出小鼠结肠部,并纵向剪开结肠,观察结肠组织大体的形态学变化,并按表2的评分标准对动物进行评分[11]。

表2 结肠组织形态损伤评分标准Table 2 Scoring criteria of morphological injury of colon tissue
1.6 结肠组织病理学观察
实验结束后,小心切取各组小鼠统一部位的结肠组织,10%(φ)中性甲醛浸泡72 h后,按以下步骤进行石蜡包埋切片以及HE染色,石蜡包埋步骤:流水冲洗结肠组织过夜,70%(φ)酒精浸泡24 h,80%酒精浸泡24 h,95%酒精浸泡6 h,100%酒精浸泡3 h,二甲苯浸泡5 min,石蜡浸泡3 h后,进行石蜡包埋及切片(厚度为5 μm)。HE染色步骤:二甲苯浸泡2次,5 min/次,100%酒精浸泡5 min,95%酒精浸泡5 min,70%酒精浸泡5 min,蒸馏水浸泡5 min,苏木素染液浸泡5 min,伊红染液浸泡15 s,晾干后,封片,镜检。
1.7 结肠组织炎症因子指标检测
按质量(结肠组织)∶体积(生理盐水)比=1∶9制备结肠组织匀浆,准确称取结肠组织,加入9倍体积生理盐水,使用玻璃匀浆器于4℃冰上研磨,4℃,4 000 r/min离心15 min,分离上清,置于−80℃冰箱保存备用。采用ELISA试剂盒检测结肠组织TNF-α、IL-1β、IL-6和IL-10的水平。
1.8 结肠组织氧化应激指标检测
结肠组织匀浆制备同“1.7”,按检测试剂盒说明书步骤检测结肠组织SOD活性以及MDA水平。
1.9 结肠组织TLR4和NF-κB p65蛋白表达水平检测
结肠组织匀浆制备同“1.7”,随后100℃水浴加热变性蛋白,测定蛋白浓度。每孔上样40 μg蛋白,常规电泳分离和转PVDF膜,5%BSA封闭液封闭2 h,分别使用的TLR4(1∶2 000)、NF-κB p65(1∶2 000)、β-actin抗体(1∶2 000)4℃孵育过夜和山羊抗兔IgG抗体(1∶3 000)室温孵育2 h,PBST清洗5次,5 min/次,滴加200 μL显影剂后,使用凝胶成像系统成像。
1.10 统计学方法
使用SPSS 19.0软件对数据进行统计学分析。多组间均数比较采用单因素方差分析和LSD检验,计量资料用表示,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠一般情况观察
实验前各组小鼠均无异常表现。模型组小鼠造模后第2天粪便开始出现异常,并逐渐变软和稀,第5天出现肉眼可见的血便现象和肛门出血。经给药治疗后,小鼠以上症状有比较明显的改善,其中BZ-H组和LD组改善作用最优。
2.2 各组小鼠DAI评分
与空白对照组比较,模型组的DAI评分明显升高(P<0.01)。与模型组比较,各给药组的DAI评分明显降低(P<0.05),其中BZ-H组和LD组DAI评分改善效果最优,见表3。

表3 各组小鼠DAI评分结果Table 3 DAI score of mice in each group(xˉ±s,n=10)
2.3 各组小鼠结肠组织形态损伤评分
与空白对照组比较,模型组的结肠组织形态损伤评分明显升高(P<0.01)。与模型组比较,各给药组的结肠组织形态损伤评分则明显降低(P<0.05),其中BZ-H组和LD组结肠组织形态损伤评分改善效果最好,详见表4。
表4 各组小鼠结肠组织形态损伤评分结果Table 4 Morphological injury score of colon tissue of mice in each group(±s,n=10)

表4 各组小鼠结肠组织形态损伤评分结果Table 4 Morphological injury score of colon tissue of mice in each group(±s,n=10)
与空白对照组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01。
组别空白对照组模型组LD组BZ-L组BZ-M组BZ-H组分数0.00±0.00 4.36±0.68**2.65±0.57##3.76±0.78#3.23±0.45#2.55±0.76##
2.4 各组小鼠结肠组织病理学观察
空白对照组小鼠结肠黏膜上皮排列整齐,结肠绒毛完整,结肠肠腺多种细胞排列整齐,未炎症细胞浸润。模型组小鼠肠绒毛破损严重,有脱落坏死,大部分肠腺出现坏死和溶解,可见大量炎性细胞浸润。给予药物后,以上损伤出现不同程度的改善,结肠黏膜结构分层比较清晰,结肠肠腺细胞排列比较整齐,炎性细胞数量明显减少,其中BZ-H组和LD组结肠组织病理变化改善最优,见图1。

图1 各组小鼠结肠组织病理学变化(HE染色,200×)Figure 1 Histopathological changes of colon tissue of mice in each group(HE staining,200×)
2.5 各组小鼠结肠组织炎症因子水平比较
与空白对照组比较,模型组小鼠结肠组织中促炎因子TNF-α、IL-1β和IL-6水平明显升高(P<0.01),而抑炎因子IL-10的水平明显降低(P<0.01)。与模型组比较,各给药组的促炎因子TNF-α、IL-1β和IL-6水平明显降低(P<0.05),而抑炎因子IL-10水平则明显升高(P<0.05),其中BZ-H组和LD组改善效果最优,见图2。
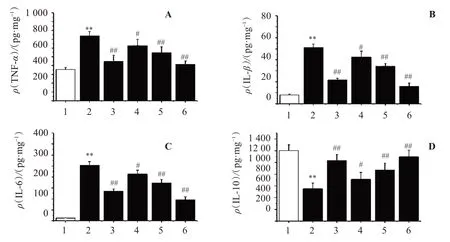
图2 各组小鼠结肠组织炎症因子水平Figure 2 Levels of inflammatory factors in colonic tissue of mice in each group(xˉ±s,n=10)
2.6 各组小鼠结肠组织SOD活性和MDA水平
与空白对照组比较,模型组结肠组织SOD活性明显降低(P<0.01),而MDA水平明显升高(P<0.01)。与模型组比较,各给药组的SOD活性明显升高(P<0.01),而MDA水平明显降低(P<0.05),其中BZ-H组和LD组改善效果最好,见图3。

图3 各组小鼠结肠组织SOD活性和MDA水平Figure 3 SOD activity and MDA level in colon tissue of mice in each group(xˉ±s,n=10)
2.7 结肠组织TLR4和NF-κBp65蛋白表达水平
与空白对照组比较,模型组结肠组织的TLR4和NF-κB p65的蛋白表达量明显升高(P<0.01)。与模型组比较,各给药组结肠组织的TLR4和NF-κB p65的蛋白表达量明显降低(P<0.05),其中BZ-H组和LD组改善效果最好,见图4。

图4 各组结肠组织TLR4和NF-κB p65蛋白表达水平Figure 4 Expression TLR4 and NF-κB p65 in colon tissues of mice in each group(xˉ±s,n=10)
3 讨论
UC是一种慢性非特异性炎症性的肠道疾病,UC患者经常出现腹痛、黏液便和排脓血便等症状,目前,其发病机制尚不得知,可能是由于外部环境引起宿主的免疫反应和基因改变等[12]。柳氮磺吡啶在临床上常用于治疗UC的常用药物,但长期使用多种严重副作用,如中性粒细胞缺乏、药疹和剥脱性皮炎等[13],故抗UC新药的开发仍是目前极为重要的任务之一。
本实验通过自由饮用3%DSS溶液构建小鼠UC模型,观察白芷乙素抗UC的作用效果。本研究发现,白芷乙素各剂量组均能明显改善UC小鼠症状,如降低DAI评分,减轻结肠组织损伤以及减少结肠组织炎症细胞的浸润,其中BZ-H组的改善效果最优。在炎症发展过程中,TNF-α、IL-1β、IL-6和IL-10作为重要的细胞因子参与到多种的炎症信号通路中。其中TNF-α和IL-1β常用于评价机体炎症严重程度的重要指标[14]。IL-1β参与了UC患者的免疫应答反应,而TNF-α参与了UC患者结肠黏膜损伤[15],两者与UC的发生发展密切相关。IL-10是一种重要的炎症抑制因子,其可通过抑制机体多种炎症因子的合成,如TNF-α、IL-1β、IL-6等[16],调节机体的炎症反应。此外,IL-10还可调节机体肠道细胞的免疫平衡,维持正常肠道黏膜微生态平衡[17]。SOD活性和MDA水平是反映机体氧化损伤严重程度的重要指标[18]。本研究发现白芷乙素能够显著降低UC小鼠结肠组织TNF-α、IL-1β、IL-6和MDA水平,升高结肠组织IL-10水平和SOD活性,改善UC小鼠的炎症和氧化损伤。
NF-κB是UC炎症过程得以持续发展的重要指标,其通过促进多种致病因子表达和释放[19],如TNF-α、IL-1β、IL-6引起机体产生级联效应的炎症反应,使炎症过程持续放大,进一步导致肠黏膜损伤,引导UC的发生发展[20]。本研究发现,白芷乙素各剂量组可明显降低UC小鼠结肠组织中TLR4和NF-κB p65蛋白表达水平,提示白芷乙素可抑制UC小鼠TLR4/NF-κB p65信号通路,这可能是其抗UC的重要作用机制。
综上所述,白芷乙素对DSS诱导的UC小鼠具有一定的保护作用,其机制可能与抑制炎症、抗氧化损伤以及调节TLR/NF-κB信号通路有关。本研究为抗UC新药研发提供了实验依据。

