浸渍罗哌卡因和地塞米松的明胶海绵用于腰椎后路手术后镇痛临床疗效观察
郭峻臣,刘志强,汪在德,郑礼鹏,雷飞,冯大雄
1 西南医科大学附属医院脊柱外科,四川泸州 646000;2 乐山市人民医院骨科
腰椎退变性疾病的患者在后路内固定及减压手术后会出现剧烈疼痛,这主要源于手术创伤及神经根损伤或水肿[1],高效的镇痛对患者术后快速康复尤为重要[2]。资料表明许多接受腰椎手术的患者术前已长期使用镇痛药物,包括阿片类药物[3-5],这使其术后疼痛管理复杂且困难。尽管几个世纪以来,全身用阿片类药物在术后镇痛中扮演着重要角色,但其存在频繁的不良反应,如呼吸抑制、恶心、呕吐等[6-8]。与之相比,一些新的镇痛模式,如局部麻醉镇痛、选择性神经根阻滞,降低了并发症的发生率及病死率[9-10]。基于此,WHO 提出采用多模式、个性化的方案来管理术后疼痛,建议减少阿片类药物的使用,并提出将各类辅助镇痛药物作为围手术期疼痛管理的新武器[2-3,8]。地塞米松和罗哌卡因具有抗炎消肿和镇痛的药理作用,两者联合应用的安全性及药代动力学证据已被以往研究证实[10-11]。有学者报道,将地塞米松、利多卡因和维生素B12混合用于椎旁神经阻滞,可在一定程度上减轻腰椎间盘突出症术后根性疼痛,但此法存在局部药物浓度无法维持、作用时间短等缺陷[12]。为此本研究参考之前研究[1,12-13]的方法,通过观察浸渍罗哌卡因和地塞米松的明胶海绵用于腰椎后路手术术后镇痛的效果,为临床应用提供一定的参考。
1 资料与方法
1.1 临床资料 选取2019年10月—2020年12月于西南医科大学附属医院脊柱外科行1~3个节段腰椎后路钉棒系统内固定+椎管减压+椎间融合手术的患者200例,并将其随机分为A 组、B 组各100例。A 组男40例,女60例;年龄18~78(53. 45 ± 16. 21)岁;术前ASA 分级:Ⅰ级60例,Ⅱ级33例,Ⅲ级7例;手术节段:单节段28例,双节段53例,三个节段19例。 B 组男36例,女64例;年龄18~80(55. 23 ±15. 44)岁;术前ASA 分级:Ⅰ级58例,Ⅱ级34例,Ⅲ级8例;手术节段:单节段26例,双节段51例,三个节段23例。两组性别构成、年龄、术前ASA 分级、手术节段比较差异无统计学意义。纳入标准:诊断为腰椎椎间盘突出症或腰椎管狭窄症或腰椎滑脱症,有明确手术指征;行1~3个节段腰椎后路钉棒系统内固定+椎管减压+椎间融合手术;手术均采用非减压侧Wiltse 入路,减压侧经正中入路[14],以及Magerl法[15]置钉;均使用同种类型、材料及品牌的植入物。排除标准:合并脊柱感染、创伤、肿瘤性疾病;既往接受过腰椎手术;术中出现医源性神经损伤、脑脊液漏;术后出现严重的谵妄、认知功能障碍、脑梗死、肺栓塞;有原发性神经系统疾病;中途因其他原因拒绝或不能完成调查者。本研究经本院伦理委员会审核批准并与患者签署知情同意书。
1.2 镇痛处理 A 组:关闭切口前用注射器向规格为60 mm×20 mm×5 mm 的明胶海绵内注入2 mL 0. 2% 罗哌卡因与1 mL 地塞米松磷酸钠注射液(1 mL∶5 mg)的混合液,并将其置于手术节段减压侧椎旁及椎弓根螺钉的内侧、非减压侧的多裂肌及最长肌间隙。B 组:关闭切口前用注射器向规格为60 mm×20 mm×5 mm 的明胶海绵内注入3 mL 0. 9%生理盐水,并将其置于手术节段减压侧椎旁及椎弓根螺钉的内侧、非减压侧的多裂肌及最长肌间隙。所有患者术后不做常规镇痛处理,若患者诉有中度及以上疼痛,予以地佐辛5 mg 肌肉注射作为抢救剂量,必要时3~6 h 给药1次,使疼痛视觉模拟评分法(VAS)评分<4分。
1.3 观测指标
1.3.1 血清SP 分别于术前、术毕(术后1 h 内)及术后24、48 h 采集静脉血3 mL,注入促凝真空采血管内,10~20 min 充分混合均匀后,4 ℃下3 000 r/min 离心20 min(离心半径10 cm),收集血清。采用人P 物质(SP)酶联免疫分析(ELISA)试剂盒(江苏晶美生物科技有限公司)测定血清SP。
1.3.2 疼痛VAS 评分 入院时记录患者术前疼痛VAS 评分,术后48 h 内每6 小时(术前标记为T0,术后各时间点标记为T1~T8)记录1次患者疼痛VAS评分。
1.3.3 JOA 评分及改善率 记录患者术前及术后第7 天的腰椎JOA 评分,并计算治疗改善率。改善率=(治疗后评分-治疗前评分)÷(29-治疗前评分)×100%。
1.3.4 其他指标 记录患者术后首次下床活动时间以及阿片类药物(均使用地佐辛注射液作为抢救性镇痛)消耗量(mg)。
1.3.5 患者满意度 出院前进行患者满意度问卷调查,以“非常满意”“满意”“一般”“不满意”进行分级。
1.4 统计学方法 采用SPSS25. 0 统计软件。正态分布的计量资料以±s表示,组间比较采用单因素方差分析(方差齐时的两两比较采用LSD-t法);计数资料比较采用χ2检验;采用Pearson 相关分析疼痛VAS 评分与SP 水平的相关性。P<0. 05 为差异有统计学意义。
2 结果
2.1 两组手术相关资料比较 两组手术时间及术中出血量比较差异无统计学意义,见表1。
表1 两组手术相关资料比较(± s)

表1 两组手术相关资料比较(± s)
组别A组B组P n 100 100手术时间(min)144. 32 ± 22. 03 148. 71 ± 22. 08 0. 293术中出血(mL)175. 99 ± 27. 79 164. 76 ± 38. 66 0. 121
2.2 两组血清SP 水平比较 血清SP 水平术前两组比较差异无统计学意义,术毕及术后24、48 h时A组低于B组(P均<0. 05),见表2。
表2 两组各时间点血清SP水平比较(± s)
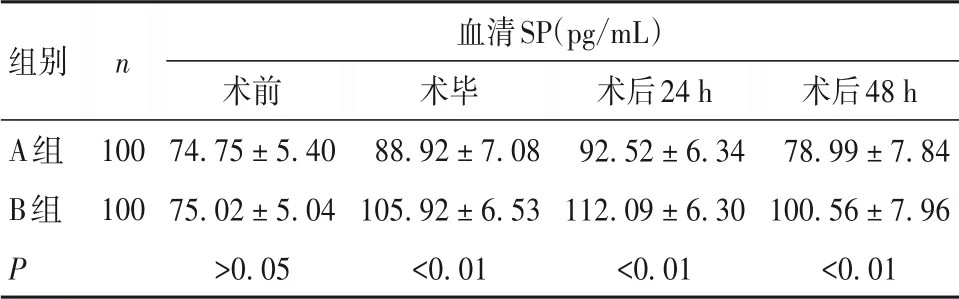
表2 两组各时间点血清SP水平比较(± s)
组别A组B组P n 100 100血清SP(pg/mL)术前74. 75 ± 5. 40 75. 02 ± 5. 04>0. 05术毕88. 92 ± 7. 08 105. 92 ± 6. 53<0. 01术后24 h 92. 52 ± 6. 34 112. 09 ± 6. 30<0. 01术后48 h 78. 99 ± 7. 84 100. 56 ± 7. 96<0. 01
2.3 两组疼痛VAS 评分比较 两组疼痛VAS 评分术前比较差异无统计学意义,术后各时间点A 组均低于B组(P均<0. 05),见表3。
表3 两组各时间点疼痛VAS评分比较(± s)
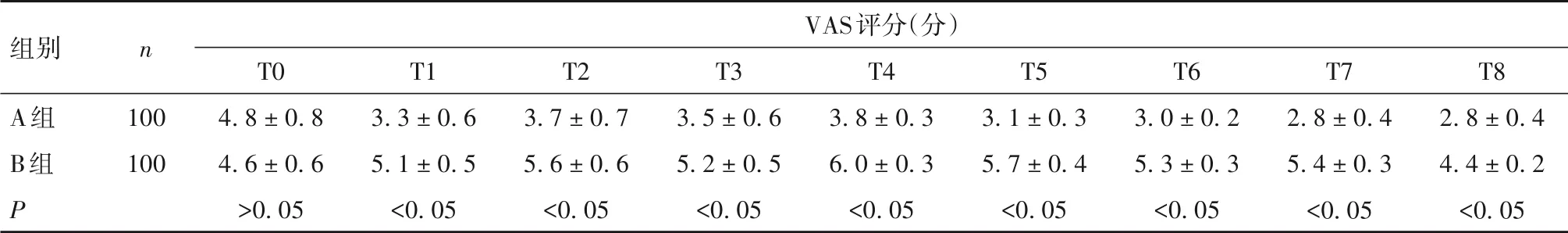
表3 两组各时间点疼痛VAS评分比较(± s)
组别A组B组P n 100 100 VAS评分(分)T0 4. 8 ± 0. 8 4. 6 ± 0. 6>0. 05 T1 3. 3 ± 0. 6 5. 1 ± 0. 5<0. 05 T2 3. 7 ± 0. 7 5. 6 ± 0. 6<0. 05 T3 3. 5 ± 0. 6 5. 2 ± 0. 5<0. 05 T4 3. 8 ± 0. 3 6. 0 ± 0. 3<0. 05 T5 3. 1 ± 0. 3 5. 7 ± 0. 4<0. 05 T6 3. 0 ± 0. 2 5. 3 ± 0. 3<0. 05 T7 2. 8 ± 0. 4 5. 4 ± 0. 3<0. 05 T8 2. 8 ± 0. 4 4. 4 ± 0. 2<0. 05
2.4 两组腰椎JOA 评分及改善率比较 A 组、B 组术前腰椎JOA 评分分别为(11. 9 ± 2. 0)、(11. 6 ±1. 8)分,术后分别为(19. 8 ± 2. 2)、(16. 9 ± 3. 1)分,治疗改善率分别为(51. 70 ± 7. 98)%、(41. 33 ±5. 51)%,A 组术后腰椎JOA 评分及治疗改善率均高于B组(P均<0. 05)。
2.5 两组首次下床活动时间、地佐辛使用量比较 A 组首次下床活动时间早于B 组(P<0. 05),术后地佐辛消耗量低于B组(P<0. 05),见表4。
表4 两组首次下床活动时间、地佐辛使用量比较(± s)

表4 两组首次下床活动时间、地佐辛使用量比较(± s)
组别A组B组P n 100 100首次下床活动时间(d)4. 1 ± 0. 9 5. 6 ± 1. 2<0. 01术后地佐辛注射液用量(mg)11. 98 ± 5. 07 18. 23 ± 6. 68<0. 01
2.6 两组术后镇痛满意度比较 A 组“非常满意”36例,“满意”48例,“一般”10例,“不满意”6例;B 组患者“非常满意”25例,“满意”40例,“一般”23例,“不满意”12例;A 组“非常满意”及“满意”比例高于B组(P均<0. 05)。
2.7 两组疼痛程度与血清SP 水平的相关性 术后24、48 h 时,A 组疼痛VAS 评分与血清SP 水平呈正相关(r分别为0. 696、0. 690,P均<0. 05),B 组疼痛VAS 评分与血清SP 水平亦呈正相关(r分别为0. 713、0. 702,P均<0. 05)。
3 讨论
随着人口老龄化加剧,需要通过手术治疗腰椎退变性疾病的患者愈发常见[16]。与其他手术相比,腰椎后路手术肌肉剥离范围广、组织牵拉时间长、需植入内固定系统,故手术区域炎症反应更重,切口急性疼痛程度亦更剧烈[1,17];此外,患者还存在因神经损伤或水肿反应导致的神经病理性疼痛[12,18]。因此,术后镇痛是脊柱外科医生需面临的挑战。据报道,在接受脊柱手术的患者中,有50% 以上术后疼痛未得到充分控制,并导致后期出现不同程度的慢性疼痛和(或)功能障碍[8,19]。安全有效的疼痛管理对于减少术后并发症、缩短卧床时间、促进功能恢复、提高治疗满意度、预防后期的慢性疼痛都是至关重要的,也是加速外科康复理念的关键环节[20]。
美国麻醉学协会提出,超前、多模式、个性化的镇痛方案是围手术期疼痛管理的最佳方法[21]。各类辅助镇痛药物的应用为脊柱外科术后镇痛提供了更多途径,尽管阿片类药物仍无法被完全替代,但探究新的镇痛药物及模式在脊柱外科术后疼痛管理中的应用,以减少阿片类药物的消耗是必要的。
研究发现,引起术后疼痛的炎症级联反应是术后急性疼痛的根源,该反应在麻醉清醒前就已发生。SP 是主要的促炎细胞因子,其C-末端也参与痛觉的传递,血清SP水平与手术创伤严重程度及骨科患者术后急性疼痛程度密切相关[17,22-25]。本研究相关分析显示,术后24、48 h 时,A、B 两组血清SP 水平与疼痛VAS 评分分别呈正相关,与上述研究相符。同时本研究结果显示,A 组术后各时间点血清SP 水平、疼痛VAS 评分及术后阿片类药物用量均低于B组,首次下床活动时间早于B组,而术后腰椎JOA 评分、治疗改善率及患者满意度均高于B组,表明在横突及椎旁放置浸渍地塞米松和罗哌卡因的明胶海绵能够有效抑制术后炎症反应、缓解患者术后疼痛、减少阿片类药物消耗量,使患者能够尽早下床活动,加速术后康复,提高患者满意度。
罗哌卡因是一种长效酰胺类局麻药,通过阻止局部刺激向大脑中枢传递信号来达到镇痛效果,其心肌毒性较小,在低浓度(0. 2%)时具有良好的感觉、运动解离作用,并可阻断过强的刺激传导,给予神经休息、调节和修复的机会[26-27]。MAROUN 等[1]实验发现,罗哌卡因在明胶海绵中能够更好地维持局部作用的浓度,延长药物缓释时间,他们将罗哌卡因浸渍的明胶海绵放置在患者手术椎体横突上,结果显示患者术后疼痛VAS 评分和阿片类药物消耗量较对照组显著降低,但这种方法对下肢根性疼痛的缓解作用较弱。脊神经出椎间孔后分为后支、前支和交通支,而腰椎神经后支向后行经背侧和尾侧,通过横突上缘的一个解剖孔进入背部,并在此水平分为内侧支、中间支和外侧支,外侧支支配髂肋肌以及背部肌肉外侧的皮肤;中间支支配脊肌和最长肌;而内侧支则向背部的脊横肌、横隔肌、棘间肌、脾间肌和关节突关节提供神经支配[28-29]。该实验中,明胶海绵里的罗哌卡因主要在横突水平上释放,从而阻断后支,并减轻上述区域的术后疼痛,且罗哌卡因并无抗炎作用[1],因此该方法对神经根水肿或周围炎症引起的下肢根性疼痛缓解作用并不明显。地塞米松具有强大的抗炎、消肿作用,可通过降低血管通透性减少组织水肿,还可通过抑制受损神经的自发放电来减轻神经病理性疼痛[30-33];更重要的是,地塞米松具有复杂的空间结构,影响了罗哌卡因的释放和吸收,从而使罗哌卡因的药理作用延长[34]。本研究将罗哌卡因与地塞米松联用,并将药液浸渍的明胶海绵放置于减压侧椎弓根螺钉的内侧,使药物能够更好地达到神经根附近,在局部发挥抗神经根周围炎症、减轻水肿以及镇痛的作用[11,13];此外,本研究在手术非减压侧的多裂肌及最长肌间隙和减压侧的椎旁也放置了浸渍后的明胶海绵,这相当于同时进行了长效的神经根阻滞和局部浸润麻醉,不仅有效缓解了神经病理性疼痛,也减轻了手术创伤导致的炎症反应和切口急性疼痛。
综上所述,在横突及椎旁放置浸渍罗哌卡因和地塞米松的明胶海绵,可有效减轻腰椎后路内固定、减压手术患者的术后疼痛,减少阿片类药物消耗量,缩短术后卧床时间,加速术后康复,促进功能恢复,提高治疗满意度。当然,本研究仍存在一定的局限性,表现为虽然观察记录了术后48 h内的炎症水平、疼痛程度,评估了住院期间的腰椎功能恢复情况等,但缺乏对后期慢性疼痛、功能障碍等的评估及随访。因此,后续应对患者进行长期随访,记录其术后更长时间的疼痛VAS 评分、ODI 评分、JOA 评分等,以对各组患者术后慢性疼痛的发生率及功能恢复情况行进一步研究。

