四种新西兰大白兔宫腔粘连模型的建立与评价及其对子宫内膜容受性的影响
祖珍玉罗 敏*申东翔张 科李军鹏陈 洁吴 琳
(1.广州中医药大学,广州 510000;2.中国人民解放军南部战区总医院,广州 510000)
宫腔粘连(intrauterine adhesions,IUA)主要由外伤或手术引起的子宫内膜损伤,导致宫腔部分或完全闭塞,并伴有进行性纤维化严重的宫腔粘连,可能导致不孕、反复流产、腹痛和其他不良妊娠结局[1-3]。产后刮宫术最容易导致IUA的发生,临床90%的IUA与其相关[4]。宫腔粘连的形成涉及一系列复杂的机制。在激素刺激下,正常子宫内膜在整个生殖周期中都表现出从基底层再生功能层的能力[5]。一旦子宫内膜受损而无法修复,子宫腔内形成纤维粘连,粘连性结缔组织缺乏血液循环,形成动脉纤维化伴血管闭塞性损伤,导致局部缺氧坏死,从而影响着床和妊娠[6-9]。此外,细胞外基质的内稳态被破坏将会产生异常的炎症反应,也会降低子宫内膜容受性[10-12]。IUA治疗的主要目的是重建宫腔并恢复子宫内膜功能,然而对于基底层严重受损和功能性子宫内膜丧失的中重度IUA,由于当前研究缺乏高效稳定且符合临床病理特征的IUA动物模型,子宫内膜再生仍然是一个巨大的挑战。
目前IUA建模方法包括各种自制刮匙和手术刀造成的机械损伤、电刀和双向电极造成的电烧伤、酒精造成的化学损伤和细菌脂多糖造成的感染损伤[13-14]。这些造模方法的损伤部位不同,损伤程度不一,造模后的效果评价也无固定的标准。另外,这些模型的建立涉及子宫外浆膜层和肌层的穿透,可能会导致子宫全层损伤,这与典型临床因素引起的IUA病理特征不同。在本研究中我们采用乙醇灌注、100℃沸水、机械损伤和机械损伤合并感染(宫腔留置LPS棉线)的方法建立新西兰大白兔IUA模型,并从形态学和病理组织学方面对模型的有效性和行为表征进行了优化比较和评价,同时检测造模后其对子宫内膜容受性和生育力的影响,旨在建立稳定高效符合临床IUA病理特征的IUA动物模型从而为探讨IUA的损伤修复及防治机制提供初步依据。
1 材料和方法
1.1 实验动物
普通级健康成年未孕雌性新西兰大白兔125只,普通级健康成年雄性新西兰大白兔8只,兔龄6~8周,体重2.4~2.6 kg,购自广东省医学实验动物中心[SCXK(粤)2019-0023]。分笼饲养,使用标准颗粒饲料,适应性喂养7 d后进行后续实验,其间自由摄食和饮水,室温(22±2)℃,湿度45%~65%,通风良好,定期进行14 h∶10 h的光暗循环。兔子宫组织取材和相关实验于中国人民解放军南部战区总医院实验动物中心实验室内进行[SYXK(粤)2019-0100]。动物实验过程中,严格按照3R原则给予人道主义关怀,通过中国人民解放军南部战区总医院动物实验伦理审查(2019102502)。
1.2 主要试剂与仪器
脂多糖(LPS,Sigma,美国);Masson染色试剂盒(Sigma,美国);BX-51显微镜系统及数字图像采集系统(Olympus,日本);计算机图像分析系统Image-ProPlus6.0(SilverSpring,美国)等。
1.3 实验方法
1.3.1 脂多糖手术缝线制备
称取0.6 mg细菌脂多糖溶于100 mL无菌生理盐水中,配成浓度为6 mg/L的脂多糖溶液,将其置于4℃冰箱中保存,将0号医用无菌手术缝线(10 cm)在使用前1 d浸泡在LPS生理盐水中24 h。
1.3.2 实验分组及模型的制备
选用100只健康雌性普通级新西兰大白兔并将其随机分为假手术组(I组)、机械损伤组(II组)、热损伤组(III组)、化学损伤组(IV组)和机械感染双损伤组(V组),每组20只;余25只雌兔随机分为假手术组(I组)、机械损伤组(II组)、热损伤组(III组)、化学损伤组(IV组)和机械感染双损伤组(V组),每组5只。后续实验均在其发情期进行。成年雌性新西兰白兔耳缘静脉注射20%乌拉坦,剂量为5 mL/kg,所有手术都由同一个研究者在无菌条件下完成。为了最大限度地减少偏差,子宫角被随机分配进行处理。具体操作步骤如下:麻醉后置于仰卧位,下腹刮毛,用1%碘酊消毒。确认充分麻醉后,在下腹正中纵切口2 cm进入腹腔,找到双侧子宫,根据分组给与相应处理后缝合子宫切口和腹部切口。假手术组:打开腹腔后不对子宫作任何处理,关腹。机械损伤组:首先在一侧子宫靠近卵巢端中下1/3处行0.5 cm纵切口手术,然后用8 mm的子宫内膜刮匙器从4个不同方向(前、后、左、右)搔刮子宫中上2/3处的子宫内膜,当宫腔内壁变得粗糙有颗粒感时,停止刮宫;机械损伤合并感染(双重损伤)双损伤IUA模型按Xiao等[15]研究方法,机械损伤后兔子宫腔留置LPS棉线2 d;热损伤组IUA模型按Xu等[16]研究方法,采用100℃热水损伤一侧宫腔15 s后,用生理盐水冲洗腹膜腔和宫腔;化学损伤组:将95%的乙醇轻轻注入一侧子宫,损伤30 s后用生理盐水冲洗腹膜腔和宫腔;各造模组对侧子宫均不做任何处理。造模术后,给予每组每只新西兰白兔每日十万IU青霉素,连续腹腔注射3 d。
1.3.3 观察指标
(1)病理组织大体形态观察及切片染色
各组新西兰大白兔在造模4、7、14和28 d后,开腹取出子宫并分离,首先观察其大体形态,是否有粗糙、肿胀、变窄、弹性丧失和充血等形态学改变。然后将分离出的子宫置于4%多聚甲醛浸泡固定后标准石蜡包埋,切成5μm切片以备后续染色。
(2)子宫内膜腺体数量检测
兔子宫组织样本的石蜡切片行HE染色。将染色的切片在室温下风干并用中性树脂固定,用显微镜观察子宫形态,计算腺体数量,并在每张切片上随机选择至少5个高倍镜视野图像,计算平均值。
(3)子宫内膜纤维化程度检测
兔子宫组织样本的石蜡切片行Masson染色。使用Masson染色试剂盒对石蜡包埋的载玻片进行染色。然后用显微镜观察纤维化,应用图像处理软件Image-ProPlus 6.0计算每个视野中子宫内膜间质纤维化(蓝色胶原纤维)面积与每个视野子宫内膜间质及腺体总面积的比值,并在每张切片上随机选择至少5个高倍镜视野图像,计算平均值。
(4)子宫内膜厚度检测
兔子宫组织样本的石蜡切片行HE染色和Masson染色。采用图像处理软件Image-ProPlus 6.0测量子宫内膜厚度,计算平均值。
(5)生殖功能检测
评价经过四种造模方法损伤过的兔子宫的生殖功能,通过检测各造模组在妊娠率和增加胚胎着床数方面的变化来评估受损雌兔子宫在接受受精卵和为发育中的胎儿提供足够的营养,并支持胚胎正常发育的功能。造模后第14天,将假手术组、机械损伤组、机械感染双损伤组、化学损伤组和热损伤组每组各5只雌兔与雄兔合笼交配,在妊娠中期(7~9 d)处死雌兔,检查并记录各组子宫的妊娠率及胚胎着床数目。
1.4 统计学方法
采用IBM SPSS 22.0统计软件进行统计分析。所有的测量数据以平均数±标准差(±s)表示,采用双尾非配对和t检验进行配对比较,组间比较采用单因素方差分析(one-way ANOVA)和Dunnett检验。差异有统计学意义(P<0.05),数据条形图采用GrapgPad Prism 8.0软件进行作图。
2 结果
2.1 子宫组织学损伤情况
观察各组子宫腔狭窄及出血水肿情况。假手术组兔宫腔形态规则,子宫内膜结构完整。损伤4 d后,化学损伤和热损伤组兔宫腔形态规则,间质出现出血、水肿,其余两组宫腔有未见明显肿胀或充血;损伤后7 d,四组兔子宫壁均有粗糙和有粘连带出现,化学损伤和热损伤组兔部分宫腔缩小变窄;损伤后14 d后,机械损伤组兔宫腔基本恢复正常形态,未见出血水肿,机械感染双损伤组兔子宫壁粗糙比较明显,化学损伤组部分宫腔水样扩张,宫腔形态改变;损伤28 d后,除热损伤组外,其余3组兔子宫外观基本恢复,子宫壁光滑无粗糙感,出血水肿基本消失,热损伤组兔部分子宫内膜组织出现坏死脱落(图1)。

图1 各组造模后子宫大体形态学变化Figure 1 Gross morphological changes of the uterus after modeling in each group
2.2 HE染色评价损伤后子宫内膜腺体数目变化
HE染色后,对照组子宫的浆膜、肌肉、子宫内膜和上皮层均正常,组织结构连续完整。上皮细胞多为单层柱状,子宫内膜层富含管状腺体,间质细胞均匀分布。四组模型子宫内膜间质结构疏松,粘膜下纤维化,可见散在的柱状细胞,腺体较少,部分间质有大量炎性细胞浸润,并伴有不同程度的充血和出血。机械损伤组和机械感染双损伤组子宫内膜功能层均有少量腺体再生,化学损伤组和热损伤组均未观察到这种现象(图2)。在造模后4、7、14和28 d测定各组模型的子宫内膜腺体数目。术后4、7和14 d,机械感染双损伤组、化学损伤组和热损伤组相对于假手术组的子宫内膜腺体数目逐渐减少,均具有显著性差异(P<0.05);机械感染双损伤组、化学损伤组造模28 d,相较于14 d的腺体数目增多(P<0.01),而热损伤组子宫内膜腺体数目仍继续下降,均具有显著性差异(P<0.001);与假手术组相比,机械损伤组的腺体数目略有减少,无显著差异(P>0.05)(图3)。

图2 各造模组兔子宫内膜腺体情况Figure 2 Intrauterine gland conditions of rabbits in each model group
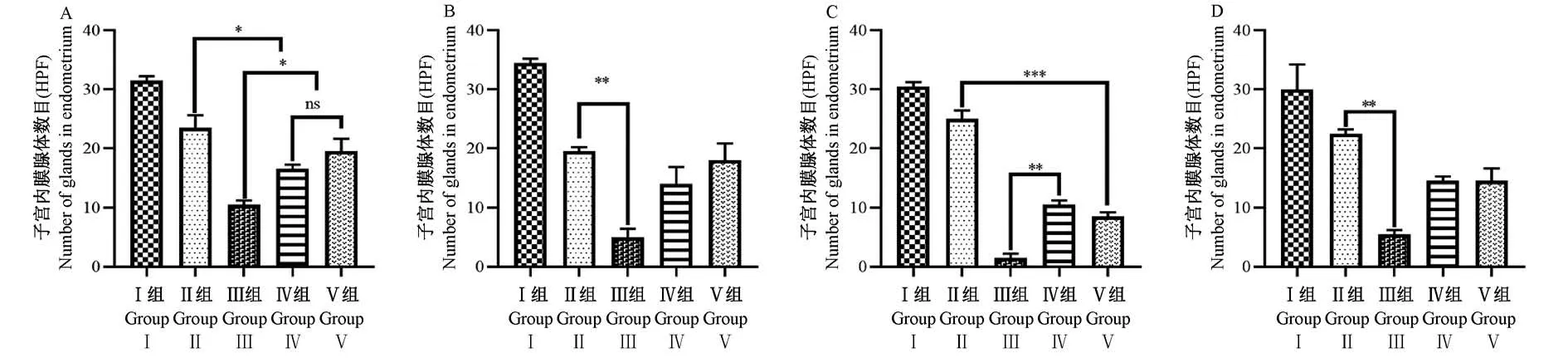
图3 各组造模后不同时间子宫内膜腺体数目分析比较Figure 3 Number of endometrial glands in each group at different time after modeling was analyzed and compared
2.3 Masson染色评价损伤后纤维化增生的变化
正常子宫的上皮、血管、腺体和肌肉染成红色,而子宫内膜和子宫浆膜染成浅蓝色,表明胶原纤维水平较低。四组模型子宫内深蓝色染色面积均有扩大,表明胶原纤维增生。有部分子宫内膜碎片散落宫腔内,间质细胞排列紊乱,胶原纤维分布不均(图4)。在造模后4、7、14和28 d测定各组模型的纤维化面积比率。术后14 d,机械感染双损伤组、化学损伤组和热损伤组子宫内膜纤维化面积比逐渐增高,均具有显著性差异(P<0.05);机械感染双损伤组和化学损伤组在造模后28 d,纤维化面积比率相较于14 d有所降低(P<0.01),而热损伤组纤维化面积比仍继续增高,差异具有显著性(P<0.001);与假手术组相比,机械损伤组的纤维化面积比略有增高,无显著差异(P>0.05)(图5)。
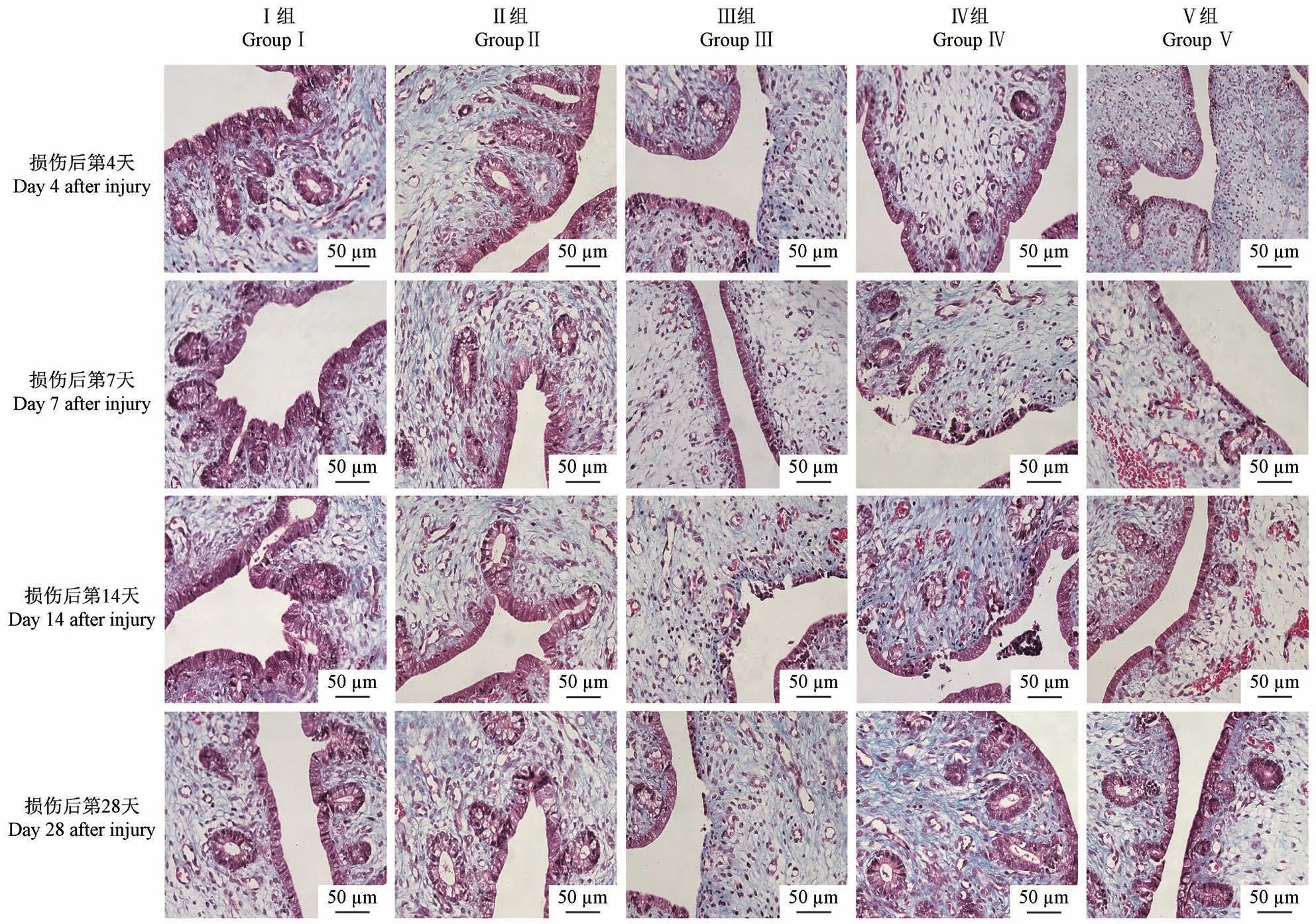
图4 各造模组兔子宫内膜纤维化情况Figure 4 Intrauterine membrane fibrosis of rabbits in each model group
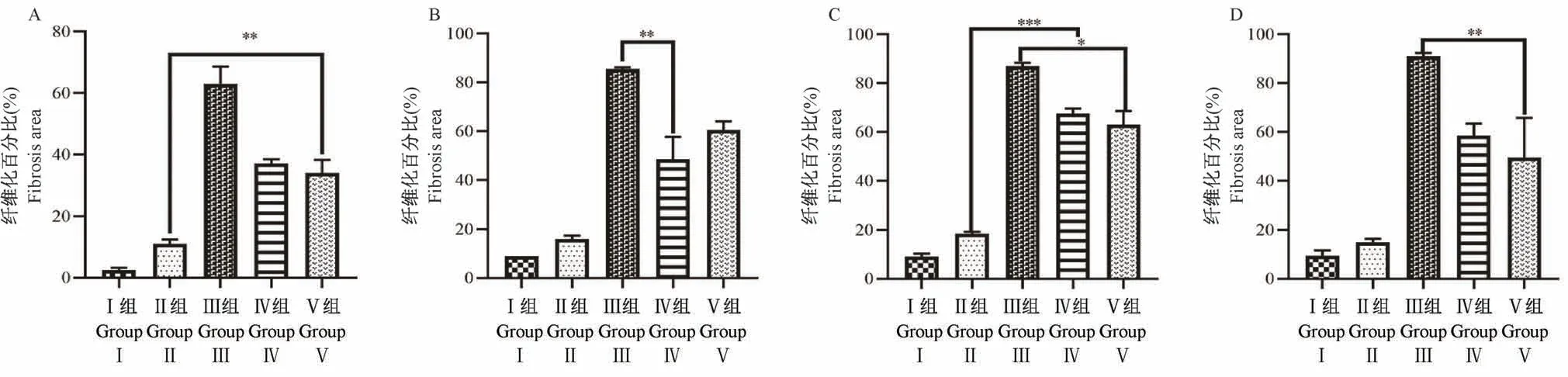
图5 各组造模后不同时间子宫内膜纤维化面积比分析比较Figure 5 Analysis and comparison of area ratio of endometrial fibrosis in different time after modeling in each group
2.4 HE染色和Masson染色评价损伤后子宫内膜厚度变化
正常子宫内膜表面呈波浪形,子宫黏膜下层和基底层呈圆形或椭圆形。四组损伤模型兔子宫宫腔形态不规则,有扩张或萎缩,部分浅肌层缺失,腺体稀疏,部分损伤部位有脱落的内膜碎片(图6)。在造模后4、7、14和28 d测定各组模型的子宫内膜厚度。术后14 d,机械感染双损伤组、化学损伤组和热损伤组子宫内膜厚度均有变薄(P<0.05);化学损伤组在造模后28 d,内膜厚度相较于14 d有增厚(P<0.01),而热损伤组内膜厚度仍继续下降,具有显著性差异(P<0.001);与假手术组相比,机械感染双损伤组和机械损伤组的内膜厚度略有下降,无显著差异(P>0.05)(图7)。
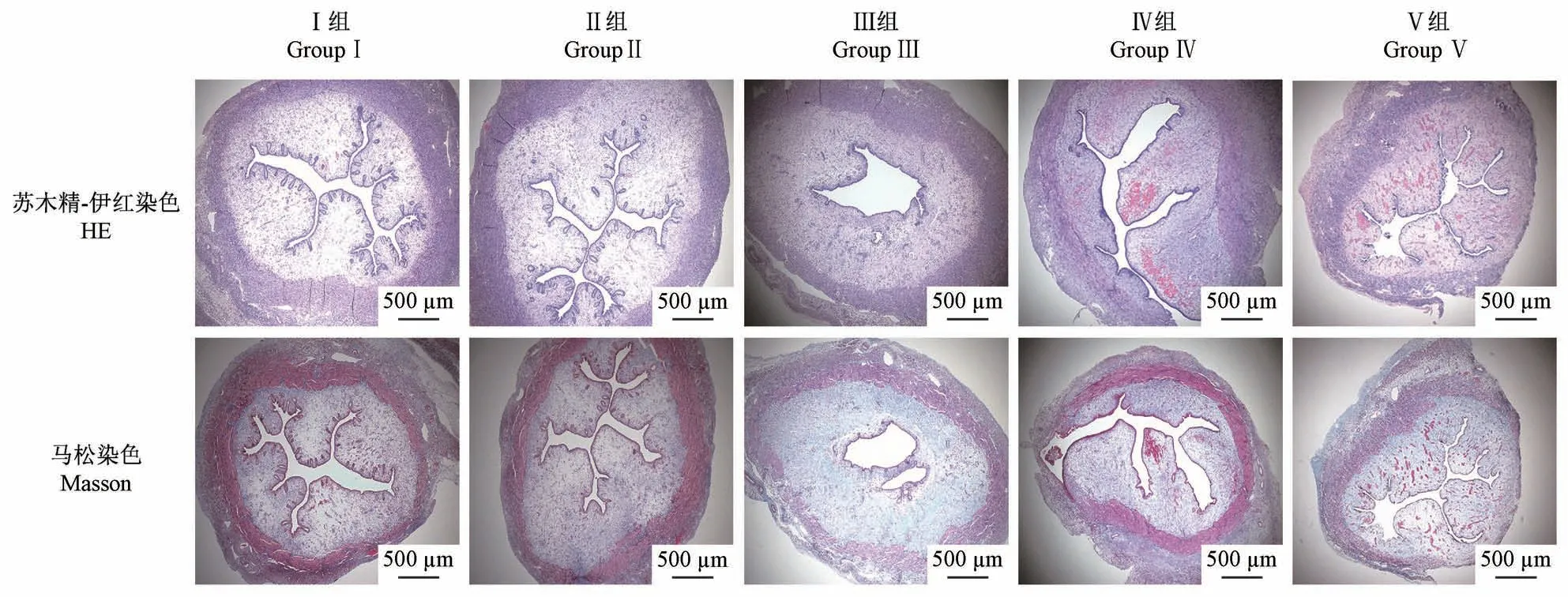
图6 各造模组兔子宫内膜厚度情况Figure 6 Intrauterine film thickness of rabbits in each model group
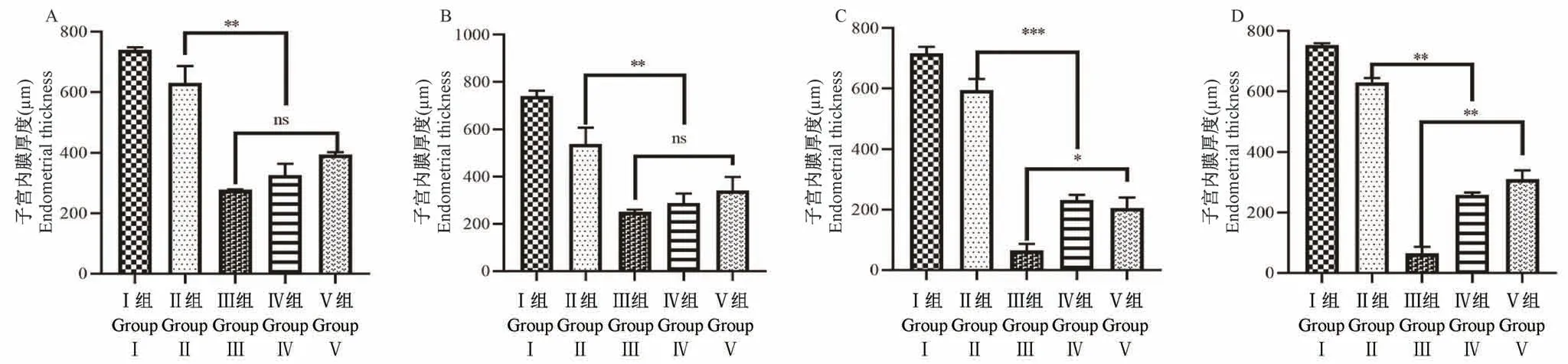
图7 各组造模后不同时间子宫内膜厚度分析比较Figure 7 Analysis and comparison of endometrial thickness of each group at different time after modeling
2.5 生殖功能检测研究
评价假手术组、机械损伤组、机械感染双损伤组、化学损伤组和热损伤组五组模型雌兔子宫内膜的生殖功能变化(图8)。根据子宫大体形态学观察及HE和Masson染色实验结果,发现造模14 d后兔子宫内膜损伤程度较接近于中重度IUA病理特征,为进一步验证,在造模14 d后,将雌兔、雄兔进行合笼交配,并计算妊娠率和子宫胚胎着床数目。结果显示与假手术组相比,化学损伤组和热损伤组兔子宫胚胎着床数目减少,妊娠率下降,均具有显著性差异(P<0.05);而机械感染双损伤组和机械损伤组兔子宫的胚胎着床数目和妊娠率相比于假手术组略有下降,无显著差异(P>0.05);热损伤组子宫胚胎植入数目和妊娠率相较于假手术组显著下降(P<0.01)(图9)。
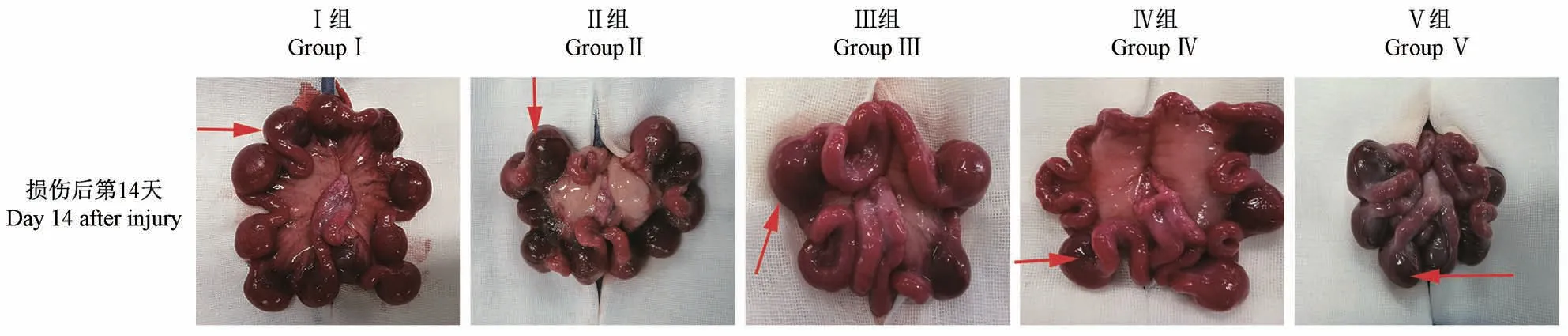
图8 各组造模后14 d的兔子宫胚胎植入情况Figure 8 Implantation of rabbit uterine embryos with different modeling methods
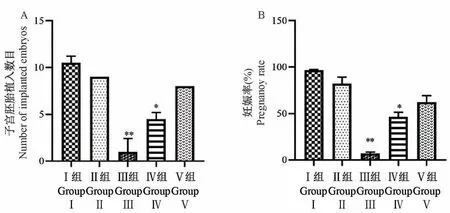
图9 各组造模7 d后兔子宫妊娠率及胚胎着床数目分析比较Figure 9 Analysis and comparison of pregnancy rate and number of embryo implantation in each group after modeling
3 讨论
近年来,不孕不育的发病率逐年增高,在临床中因子宫内膜损伤引起的宫腔纤维化和粘连是引发不孕不育的主要原因,子宫内膜再生已成为妇科和生殖医学亟待解决的重要难题。当前很多研究在不同的子宫损伤模型中通过使用干细胞和药物疗法对其治疗效果进行了评估,然而由于缺乏标准化的模型导致疗效的客观评价和定量分析模式很难统一,因此建立稳定有效的子宫损伤IUA动物模型非常必要且迫切。
许多研究人员尝试使用各种方法构建IUA动物模型,有通过在宫腔内放置铜线的方法,也有通过细菌性脂多糖棉线宫腔感染的方法模拟建立子宫内膜损伤模型,但尚未找到最佳高效的方案建立符合临床IUA病理特征的动物模型[17]。本研究通过优化比较新西兰大白兔不同宫腔粘连模型的相关病理指征,并从生殖功能方面评价其对子宫内膜容受性的影响,进一步验证其有效性和安全性,以探讨更符合人类IUA临床病理特征的稳定动物模型,为后续研究其发病机制及治疗策略提供参考。
IUA是由于子宫内膜损伤导致子宫内膜变薄、纤维化和粘连形成而引起的。子宫内膜厚度是判断IUA最直观的方法[18]。腺体细胞和间充质细胞在子宫内膜增殖期起着重要作用。正常子宫内膜受损或周期性脱落后,开始一系列自我修复过程,这涉及子宫内膜干细胞的分化及纤维化因子和抗纤维化因子的平衡机制[15]。因此子宫内膜厚度、腺体数目及纤维化比率是本研究中主要观察的指标。另外,本研究中所用的新西兰大白兔子宫与一般家畜不同,两个子宫是完全独立的,无子宫角和子宫体之分,左右各一个子宫,各自有一个子宫颈,分别开口于阴道基部,两子宫颈间有间膜固定[16]。由于是两个完全独立的子宫,而本研究目的是比较和评价经四种不同损伤方法处理的新西兰大白兔宫腔粘连IUA模型,并设置假手术组进行对照,所以在造模时选择雌兔的随机一侧子宫进行不同干预处理,对侧子宫仅作自身对照并未检测相关数据。
本研究从形态学、病理组织学方面对化学损伤、热损伤、机械损伤和机械损伤合并感染(双损伤)四种损伤方法诱导的兔IUA模型进行了比较和评价,结果显示,在术后4、7 d,化学损伤组和热损伤组兔子宫宫腔出现轻微出血水肿,机械损伤和感染双损伤组病理组织学形态方面基本无变化,术后14 d,与假手术组对比,机械感染双损伤组、化学损伤组和热损伤组子宫内膜厚度均变薄(P<0.05),化学损伤组和热损伤组纤维化率增高、腺体数目减少(P<0.05),机械损伤和感染双损伤腺体数目及纤维化面积比变化不明显。为了进一步探讨四种造模方法对子宫内膜容受性的影响,本研究在造模后14 d进行了生殖功能实验研究,结果表明相对于假手术组,化学损伤组和热损伤组妊娠率和子宫胚胎着床数目均有降低(P<0.05),其中热损伤组妊娠率和子宫胚胎着床数目急剧下降(P<0.001)。机械损伤组和机械感染双损伤妊娠率及子宫胚胎着床数目与假手术组相比基本无差异,这说明机械损伤及感染双损伤程度较轻,并未严重损伤子宫内膜进而导致妊娠率及子宫胚胎着床数目的显著下降;而化学损伤和热损伤这两种造模方法都在不同程度上损伤了子宫内膜的生育功能。
LPS经常用于肺炎、脓毒症等疾病的动物实验模型的构建,也被用于构建子宫内膜炎动物模型[19]。本研究初步推测损伤和炎症是IUA最常见的病因,因此机械损伤和机械感染双损伤模型应该是比较符合临床病理特征,然而在实验中却并未达到理想稳定的损伤效果。Kim等[19]对此有两种解释,首先是机械损伤稳定性低,实验操作人员选择刮宫的力度、时间和角度的不一致都可能会导致损伤造成的效果不同,通过这种方法建立的模型受到操作者经验、手术器械和实验条件的限制。其次是机械损伤和LPS引起的炎症反应会刺激子宫内膜的自我修复机制,由于自身修复作用使模型的准确性受到一定的影响。
热损伤法引起的温度升高对子宫内膜的功能层和基底层均造成严重损伤,导致子宫内膜细胞蛋白的凝固,继而坏死、脱落和纤维化,最终导致子宫内膜的缺失,并可能损伤子宫内膜肌层,导致出血和周围坏死。这与IUA临床病理特征不符,因此不推荐推广应用。
化学损伤法中所有乙醇的浓度、用量和灌注的起止时间是固定的,这保证了模型的稳定性和可重复性。此外,化学损伤建立的IUA模型与在临床IUA中观察到的的病理特征相似,包括子宫内膜变薄,腺体数量减少、纤维化。后续的生殖功能实验结果也显示其损伤子宫内膜的容受性而导致妊娠率和胚胎着床数目下降。虽然化学损伤诱导的IUA模型在临床上较少见,但从其与临床IUA病理特征的相似性、实验操作可控性、模型稳定性及可重复性考虑,可以作为一种稳定高效的IUA动物模型。
综上所述,化学损伤造模法对子宫内膜厚度、腺体数量和纤维化程度及妊娠率、子宫胚胎着床数均有一定的影响,同时可以保留子宫全层结构,这是判断中重度IUA模型成功与否的最基本的表型指标,是一种符合IUA临床病理特征的动物模型,可以为深入研究IUA的发病及治疗机制提供重要的模型参考。

