中华蜜蜂DnaJB6 的生物信息学分析与功能预测
赵 航,张文豹,张淑欣,何学梅,梁 丽
(曲阜师范大学生命科学学院,山东 曲阜 273165)
昆虫授粉是一项重要的生态系统服务,不仅在野生植物的发育与繁衍中发挥重要作用,而且保证了农作物的产量和品质[1]。据统计,大约有65%的被子植物和86%的农作物需要昆虫授粉[2]。蜜蜂是最主要的授粉昆虫,大约有40%的昆虫授粉由蜜蜂完成。蜜蜂授粉可以大幅提升农作物收益,我国每年由蜜蜂授粉促进的农作物增产产值超过500 亿[3,4]。蜜蜂种类繁多,其中意大利蜜蜂(Apis mellifera ligustica) 和中华蜜蜂(Apis cerana cerana) 是我国2 个主要养殖品种[5]。中华蜜蜂具有多种优良特性,如相较于意大利蜜蜂,中华蜜蜂具有更好的抗螨能力[6]。然而,从1896 年至今,中华蜜蜂种群数量至少下降了40%[7,8]。近年气候变化、农药滥用、病虫害频发是中华蜜蜂种群数量快速下降的主要驱动力[7,9,10]。
热激胁迫是环境胁迫的一种,它不仅扰乱线粒体稳态、破坏细胞功能,导致细胞的氧化损伤[11]。对蜜蜂而言,热激胁迫虽然很少直接杀死蜜蜂,但是会影响蜜蜂的分布、行为和生理状态[12-14]。研究表明,热激胁迫对蜜蜂的身体形态、生长发育和生殖功能产生不利影响[15-18]。同时,热激胁迫还可以与其它胁迫协同作用,降低蜜蜂对其它胁迫的耐受能力[12,19]。综上所述,热激胁迫对蜜蜂的生命活动产生不可忽视的影响。
在进化过程中,蜜蜂获得了许多热激胁迫防御机制,以减轻热激胁迫对自身的伤害[20]。在行为水平上,当蜂巢温度过高时,工蜂会煽动翅膀增加散热。同时,增加负责采水蜜蜂的数量,并将采集到的水洒在蜂巢上,以降低蜂巢温度[21-23]。在分子水平上,蜜蜂通过上调多种基因和蛋白的表达来抵御热激胁迫,如热激蛋白家族(Heat shock protein,Hsp)、核因子Y(Nuclear factor Y, NF-Y)、乙酰胆碱酯酶1(Acetylcholinesterase 1, AchE1)[24-26]。其 中,Hsp 家族是热激胁迫诱导表达的一类保守蛋白质,能帮助蛋白质保持正确的构象,防止蛋白质错误折叠和聚集[27]。研究发现,发挥分子伴侣功能的Hsp 家族是蜜蜂抵御热激胁迫的关键蛋白。在热激胁迫条件下,蜜蜂的sHsp22.6、Hsp60、Hsp70ab、Hsp90 均诱导表达,帮助蜜蜂抵御热激胁迫[28-30]。这些结果表明Hsp 家族在抵御热激胁迫中发挥重要作用。
DnaJ 家族也称Hsp40 家族,因具有高度保守的J 结构域而得名。蜜蜂DnaJ 家族有二十多个成员,依据结构特点分为DnaJA、Dna-JB、DnaJC 3 个亚家族[31]。DnaJ 作为辅助伴侣蛋白,激活分子伴侣蛋白Hsp70 的ATP 酶活性,参与蛋白质的翻译、折叠、去折叠、转位和降解过程[32]。DnaJB6 是广泛表达、功能多样的1 个J 结构域蛋白[34]。它具有3 个保守结构域,分别为N 端的J 结构域、G/F 富集区和C 端的丝氨酸富集区域[35,36,37]。由于选择性剪接,人的DnaJB6 具有2 个不同长度的cDNA,它们编码2 种不同的蛋白质,分别称为Dna-JB6a 和DnaJB6b[38]。它们的N 端氨基酸残基相同,但是DnaJB6a 的C 端有105 个氨基酸残基而DnaJB6b 的C 端仅有10 个氨基酸残基[39]。C 端氨基酸的差异使二者具有不同的亚细胞定位。DnaJB6a 具有核定位信号序列,定位于细胞核;DnaJB6b 则缺少核定位信号序列,主要定位于细胞质[40]。在哺乳动物中,DnaJB6 参与多种生命活动,如小鼠胎盘发育、疾病、神经干细胞的自我更新等[41-45]。但是,作为热激蛋白家族的成员之一,DnaJB6在中华蜜蜂中的结构以及在热激胁迫中的作用却少有报道。
本研究主要对中华蜜蜂DnaJB6 进行生物信息学分析,并检测其在热激胁迫下的表达模式,从而阐明DnaJB6 在中华蜜蜂抵御热激胁迫中的可能作用。本研究可为进一步研究中华蜜蜂DnaJB6 的结构与功能提供理论依据。同时,还丰富了蜜蜂热激胁迫响应机制的理论知识,对蜜蜂的育种工作有一定的指导作用。
1 材料与方法
1.1 核酸和氨基酸序列
先前实验室同学克隆得到的中华蜜蜂DNAJB6 的编码区(Coding sequence,CDS)。其他10 种昆虫的DnaJB6 氨基酸序列是从NCBI 数据库下载的,它们的登录号及物种名分 别 为 XP_006564598(Apis mellifera) 、XP_006619442(Apis dorsata)、XP_012342620(Apis florea)、XP_016919326(Apis cerana)、XP_033185595(Bombusvancouverensis nearcticus) 、 XP_012135622(Megachile rotundata) 、 XP_011138491(Harpegnathos saltator)、XP_029665386(Formica exsecta)、XP_035726509(Vespamandarinia) 、XP_015182179(Polistes dominula)。
1.2 生物信息学分析
首先依据标准密码子表,计算DnaJB6 的CDS 编码的氨基酸序列。然后,进入Blastx 分析界面,选择默认数据库、物种insects(taxid:6960),对DNAJB6 的CDS 进行比对,寻找与其编码相似蛋白质的基因,初步预测DnaJB6的功能。再利用多种生物信息学软件分析DnaJB6 的理化性质、保守结构域、跨膜结构、亚细胞定位、信号序列、蛋白质修饰位点、蛋白质同源性、二级结构、三级结构、相互作用的蛋白。本文使用的各种生物信息学分析软件详见表1,未特殊说明的生物信息学软件,均使用默认参数进行分析预测。
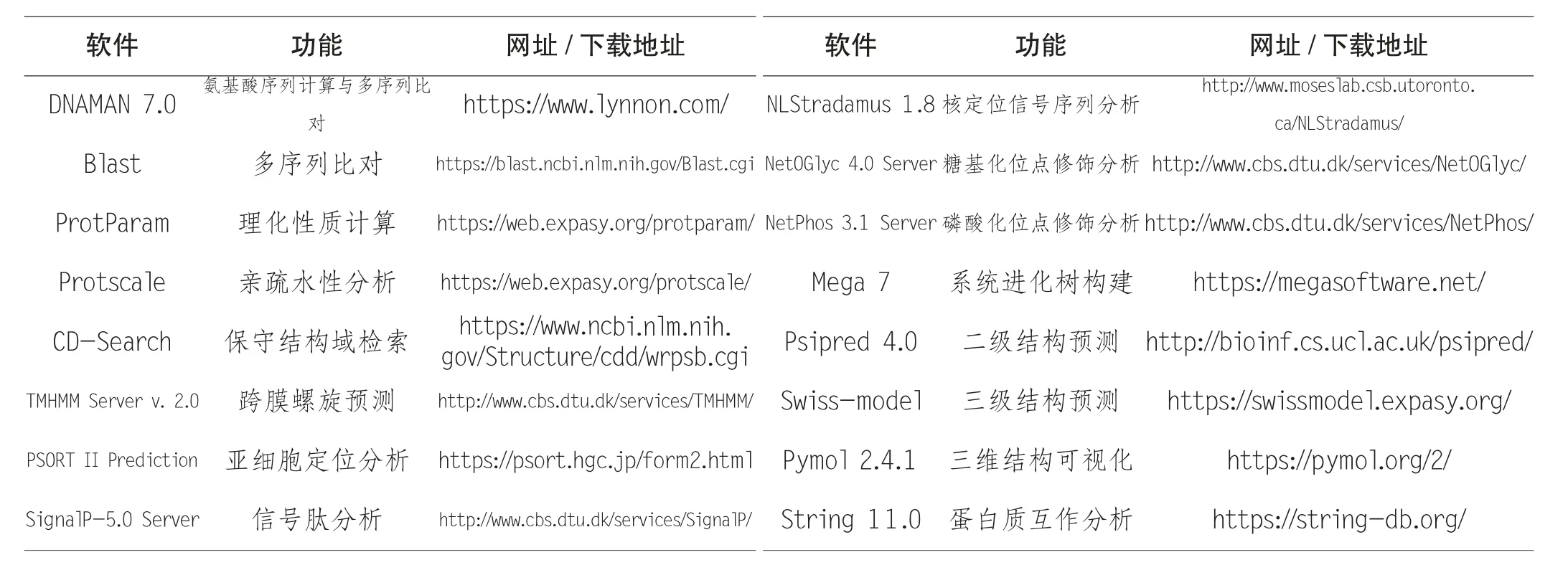
表1 本文使用的多个生物信息学分析软件
2 结果与分析
2.1 生物信息学分析结果
2.1.1 理化性质分析结果
为了确定中华蜜蜂DnaJB6 的各种理化性质,我们利用ProtParam 计算了它的多个参数,结果如表2 所示。表2 显示,DnaJB6 相对分子质量为 37.21 kD, 分子式为C1647H2527N479O501S5。在所有氨基酸残基中,带负电荷的氨基酸残基有39 个,带正电荷的氨基酸残基54 个,理论等电点为9.71。DnaJB6的不稳定系数为45.83,大于40 表示蛋白质不稳定。同时,该蛋白质的脂溶系数为47.09,总的亲水性平均系数为-0.913。上述结果表明,DnaJB6 是一个带正电的不稳定的亲水性蛋白。

表2 中华蜜蜂DnaJB6 的多种理化性质
为了进一步掌握中华蜜蜂DnaJB6 的亲水性,我们使用Protscale 进行更加准确的亲疏水性分析,结果如图1 和表3 所示。图1 和表3 显示,在所有氨基酸中,疏水性最强的是第160 位的甘氨酸残基,其得分为1.344;亲水性最强的是323 位的赖氨酸残基,其得分为-3.500。并且该蛋白质83%的氨基酸残基得分为负数,负数表示亲水性。该结果进一步验证了中华蜜蜂DnaJB6 的亲水性。
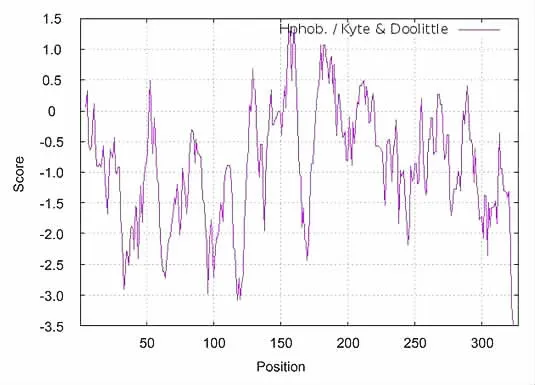
图1 中华蜜蜂DnaJB6 亲疏水性分析结果

表3 中华蜜蜂DnaJB6 的亲疏水分析结果
2.1.3 保守结构域分析结果
为了确定中华蜜蜂DnaJB6 的保守结构域,我们利用CD-Search 分析它的氨基酸系列,从而找到保守结构域,结果如图2 所示。图2 显示,DnaJB6 的3-66 位氨基酸构成Pfam 序号为PF00226 的J 结构域。并且HPD基序与其它的5 个氨基酸残基构成保守的Hsp70 相互作用位点,介导DnaJB6 与Hsp70的相互作用。这结果表明,中华蜜蜂DnaJB6具有保守的J 结构域,属于DnaJ 超家族。

图2 中华蜜蜂DnaJB6 保守结构域分析结果
2.1.4 跨膜结构分析结果
为了获知中华蜜蜂DnaJB6 是否具有跨膜结构,我们使用TMHMMServer v.2.0 分析其氨基酸序列,确定其是否具有可形成跨膜结构的α-螺旋,结果如图3 所示,DnaJB6 蛋白不仅跨膜螺旋数为零,而且没有跨膜信号。由此可推测中华蜜蜂DnaJB6 不具有跨膜结构,不属于膜蛋白。
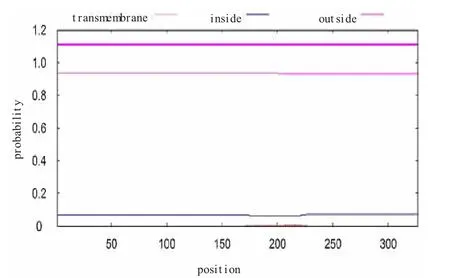
图3 中华蜜蜂DnaJB6 跨膜结构分析结果
2.1.5 亚细胞定位分析结果
为了确定中华蜜蜂DnaJB6 的亚细胞定位,我们采用PSORT II Prediction 预测其亚细胞定位,结果如表4 所示。从表4 可以看出,DnaJB6 有73.9%的可能定位于细胞核,14.4%的可能定位在细胞质,定位线粒体和细胞骨架的概率均为4.3%。通过上述结果可知中华蜜蜂DnaJB6 很可能是定位于细胞核的核蛋白。

表4 中华蜜蜂DnaJB6 亚细胞定位预测结果
2.1.6 信号序列分析结果
为了确定中华蜜蜂DnaJB6 是否具有信号序列。如果有,有的又是哪类信号序列。我们使用SignalP-5.0 Server 分析其是否具有信号肽,结果如表5 所示,DnaJB6 具有信号肽的可能性仅为0.06%,无信号肽的概率为99.94%。由此可断定,中华蜜蜂DnaJB6 无信号肽。

表5 中华蜜蜂DnaJB6 信号肽分析结果
为了确定中华蜜蜂是否具有核定位信号,我们使用NLStradamus 1.8 分析其可能具有的核定位信号,结果如图4 所示。图4 显示,DnaJB6 有86.7%的可能性具有核定位信号,核定位序列为318-327 位的TKKHDKSKRK。该结果表明,中华蜜蜂DnaJB6 很可能具有核定位信号序列。

图4 中华蜜蜂DnaJB6 核定位信号序列分析结果
2.1.7 蛋白质修饰位点分析结果
为了解中华蜜蜂DnaJB 的肽链合成后加工情况,我们使用NetPhos 3.1 Server 分析磷酸化修饰位点,结果如图5。图5 显示,DnaJB6具有49 个可能的磷酸化修饰位点。在这些磷酸化位点中,丝氨酸、苏氨酸、酪氨酸位点分别为30、15、4 个。并且,不同位点的氨基酸残基由不同的蛋白质激酶磷酸化。

图5 中华蜜蜂DnaJB6 磷酸化修饰位点分析结果
为了解中华蜜蜂DnaJB 的糖基化修饰情况,我们使用NetOGlyc 4.0 Server 分析DnaJB6的糖基化修饰位点,结果如图6 所示。图6 显示,DnaJB6 具有15 个潜在的糖基化修饰位点,分 别 是15、16、74、165、169、172、173、175、177、227、229、240、307、311、318 位氨基酸。在这些糖基化修饰位点中,丝氨酸有11 个、苏氨酸为4 个。综合磷酸化修饰位点结果可知,中华蜜蜂DnaJB6 肽链合成后,需要进行糖基化和磷酸化修饰才能形成成熟的蛋白质。
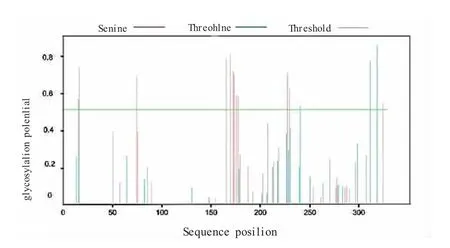
图6 中华蜜蜂DnaJB6 糖基化修饰位点分析结果
2.1.8 蛋白质同源性分析结果
为了研究中华蜜蜂DnaJB6 在进化过程中的保守性,我们下载了中华蜜蜂DnaJB6 的Blastp 序列比对结果中的蜜蜂科6 个物种、蚁科2 个物种和胡蜂科2 个物种的氨基酸序列。在DNAMAN 软件中,利用全局比对算法进行多序列比对,计算这11 条序列的总体相似度,结果如图7 所示,黑色标记的是相同的氨基酸位点,粉色标记的是75%相似度以上的氨基酸位点,蓝色标记的是50%相似度以上的氨基酸位点,未标记的为50%以下的氨基酸位点,短横线为插入的空位。这11 条氨基酸的总相似度达到86.73%。由此可知,DnaJB6 在进化过程中较为保守。

图7 11 种膜翅目昆虫DnaJB6 的多序列比对结果
为了探究膜翅目DnaJB6 之间的亲缘关系,我们使用Mega7 软件中的最大简约法构建蜜蜂科中蜜蜂属的Apis mellifera、Apis dorsata、Apis florea、Apis cerana、Apis cerana cerana、熊蜂属的Bombus nearcticus、切叶蜂属的Megachile rotundata; 蚁 科 的Harpegnathos saltator、Formica exsecta和胡蜂科Vespa mandarinia、Polistes dominula的系统进化树,结果如图8 所示。从图8 可以看出,蚁科和胡蜂科聚为一类,再与Megachile rotundata 和Bombus nearcticus聚成大类。在自展检验值高于70的分支中,蚁科的两个物种离中华蜜蜂的遗传距离最远,熊蜂属的Bombus nearcticus遗传距离最近。由此推测,在膜翅目Dna-JB6 的遗传进化上,相较于蚁科,中华蜜蜂与胡蜂科亲缘关系更近;在蜜蜂科中,熊蜂属与中华蜜蜂的亲缘关系更近,切叶蜂属较远。

图8 最大简约法构建的DnaJB6 系统进化树
2.1.9 蛋白质结构预测结果
为了解中华蜜蜂DnaJB6 的二级结构,我们利用Psipred 4.0 预测它的二级结构,结果如图9 所示。图9 显示,DnaJB 的二级结构主要包括7 个α 螺旋(粉红色)、6 个β 叠片(黄色) 和多个无规卷曲(灰色)。其中,DnaJB6的4-7、16-30、39-55、59-73 位的4 个α螺旋构成保守J 结构域。并且,第二个和第三个螺旋之间包含一个保守的HPD 基序。由此可知,中华蜜蜂DnaJB6 的二级结构主要为α螺旋、β 折叠和无规卷曲。
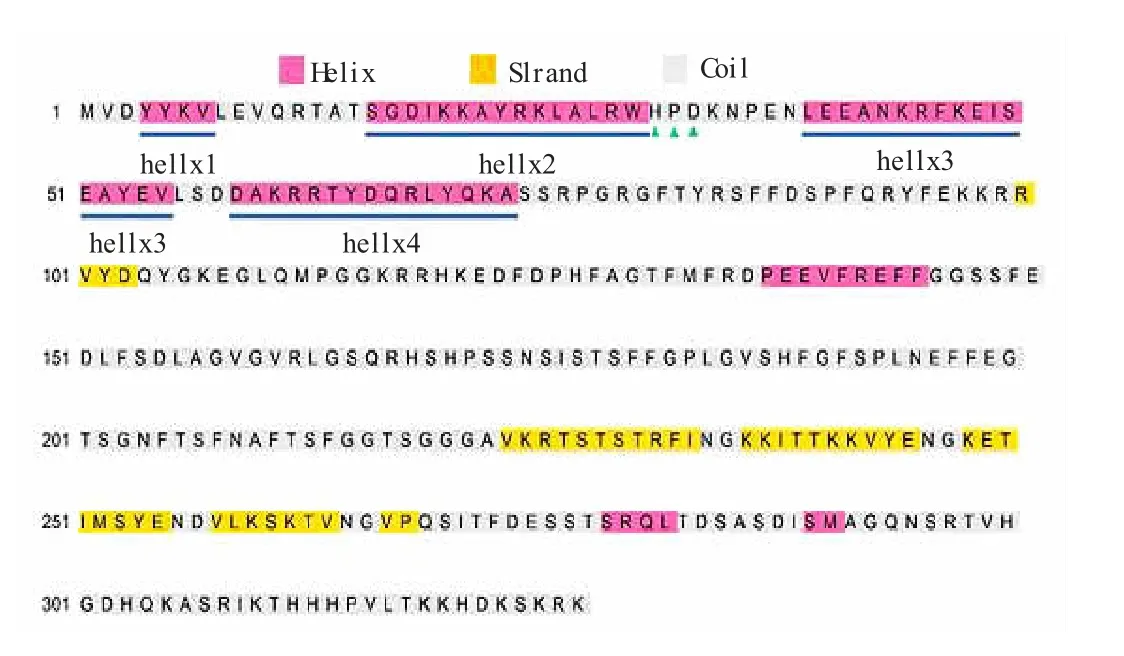
图9 中华蜜蜂DnaJB6 二级结构预测结果
为了探究中华蜜蜂DnaJB6 的三维结构,我们采用同源建模的方法,对中华蜜蜂Dna-JB6 的三维结构进行预测,结果如表6 和图10A 所示。表6 和图10A 显示,Swiss-model软件以PDB 数据库中序号为6u3r.1 的蛋白为模板。它与中华蜜蜂DnaJB6 的序列相似度为52.69%。该三维结构预测的GMQE 值为0.4,QMEAN 为-4.13,存在形式为单体。并且,为了更好的展示中华蜜蜂DnaJB6 的三维结构,我们利用Pymol 2.4.1 软件对其三维结构进行可视化。同时,计算DnaJB6 三维结构的表面静电势分布,显示最保守的HPD 基序的棒状结构,可视化结果如图10B 所示。

表6 同源建模结果的参数
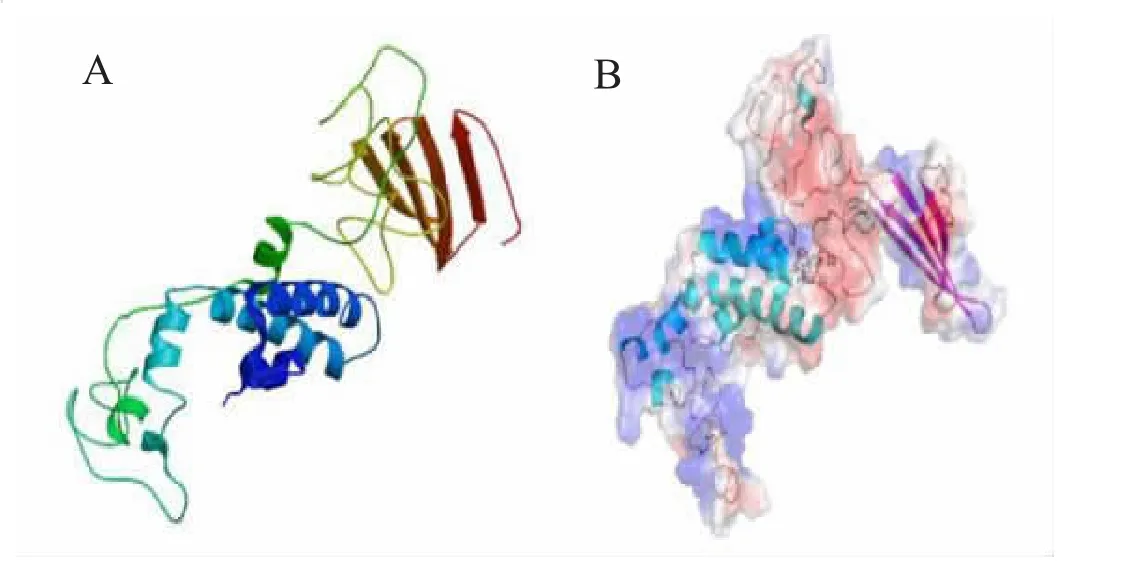
图10 中华蜜蜂DnaJB6 的三维结构预测及其可视化结果
在A 和B 图卡通模式的三维结构中,不同颜色代表不同的二级结构。B 图的表面静电势分布图中的红色代表负的静电势,蓝色代表正的静电势。
2.1.10 蛋白质互作分析结果
为了研究与中华蜜蜂DnaJB6 相互作用的蛋白质,我们使用String11.0 软件分析与其相互作用的蛋白质。 String11.0 自动匹配LOC408966 蛋白质作为相似蛋白质,并依此进行蛋白质互作分析,得到的结果如图11 所示。图11 显示,高度可信(得分高于0.7) 的相互作用蛋白质有7 个,其中有4 个Hsc70 蛋白质家 族 蛋 白, 分 别 为 Hsc70-3、 Hsp70cb、Hsc70-4 和Hsc70-5。Hsc70 是Hsp70 家族的成员。这些结果表明,中华蜜蜂DnaJB6 与多种热激蛋白家族蛋白质相互作用,特别是Hsc70 蛋白家族。并且,很可能作为辅助伴侣分子,与Hsp70 相互作用,从而发挥生物功能。
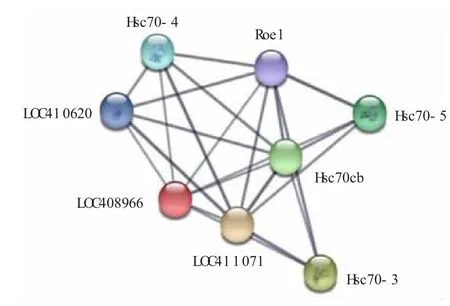
图11 中华蜜蜂DnaJB6 相互作用蛋白质的预测结果
2.2 讨论
由于选择性剪接,DnaJB6 具有多个亚型。在东方蜜蜂中,DnaJB6 具有2 个亚型,分别为长327 bp 的亚型1(XP_016919326) 和290 bp 的亚型2(XP_016919327)[46]。通过序列比对发现,克隆得到中华蜜蜂DnaJB6 与东方蜜蜂的DnaJB6 亚型1 完全相同,亚型2 缺少的59-95 位氨基酸残基。中华蜜蜂DnaJB6 的59-73 位氨基酸构成J 结构域的第四个α-螺旋(图9)。但是,利用Psipred 4.0 对东方蜜蜂DnaJB6 亚型2 进行二级结构预测却发现其59-69 位仍可以形成α- 螺旋,即其仍具有4个α-螺旋组成的J 结构域。尽管在哺乳动物中,DnaJB6 的部分亚型可能会因为缺少C 端的核定位信号序列而分布于细胞质,这可能会造成二者功能上的差异[40]。但同时,也有研究报道,在热激胁迫条件下,定位于细胞质的亚型可以转移至细胞核[47]。这些结果表明,由于选择性剪接形成的中华蜜蜂DnaJB6 的两个亚型在功能上很可能相同。
蛋白质由20 种常见氨基酸连接而成。由于不同氨基酸侧链残基的性质差异,氨基酸的组成、排列赋予了蛋白质特性,如等电点、半衰期、亲/疏水性、稳定性等。预先掌握蛋白质这些特征参数,有利于开展后续的生化实验。中华蜜蜂DnaJB6 总的亲水性平均系数为-0.913,并且83%的氨基酸表现为亲水性(表3 和图1)。这些结果表明,该蛋白质很可能易溶于水。同时,DnaJB6 含有的带正电的残基明显多于带负电的残基,说明中华蜜蜂Dna-JB6 带正电。
结构域是在二级结构基础上形成的三级结构局部折叠区,是相对独立的稳定的紧密球状实体。在进化过程中,相对保守的结构域称为保守结构域。并且保守结构域多为蛋白质的功能结构域。DnaJ 蛋白家族的保守结构域为J结构域。并且,J 结构域包含4 个α- 螺旋,其中螺旋Ⅱ和螺旋Ⅲ反向平行,通过含HPD基序的柔性环相连,两端的短螺旋Ⅰ、Ⅳ则稳定反向平行螺旋间的相互作用[48]。其中的HPD 是DnaJ 蛋白最保守的基序,同时也是激活Hsp70 的ATP 酶活性所必须的[49]。中华蜜蜂DnaJB6 具有较为保守的由4 个α- 螺旋构成的J 结构域(图9)。并且,具有保守的HPD 基序。DnaJB6 作为DnaJ 蛋白质家族的一员,可能参与蛋白质的翻译、折叠、去折叠、转位和降解过程[32]。
蛋白质磷酸化修饰是指肽链合成后加工过程中,在各种蛋白激酶的作用下,将ATP 的γ- 磷酸基转移到蛋白质的Ser、Thr、Tyr 残基的羟基上的过程,是存在于各类生物中调节蛋白质活性的一种基本的、普遍的机制。并且,蛋白质的磷酸化修饰也影响蛋白质的高级结构的形成。糖基化修饰能够改变蛋白质的构象,提高蛋白质的稳定性。中华蜜蜂DnaJB6具有15 个糖基化与49 个磷酸化修饰位点(图5 和图6)。并且,DnaJB6 蛋白为不稳定蛋白(表2)。综上可推测,磷酸化与糖基化修饰可能是维持DnaJB6 稳定的重要原因。
同源建模指在已经通过实验方法测定三级结构的蛋白质的数据库中,选取与待测蛋白质同源性较高的蛋白质作为模板,再利用计算机模拟和计算预测其三维空间结构。模板与中华蜜蜂DnaJB6 的序列相似度为52.69%。并且,同源建模的GMQE 值为0.4,QMEAN 为-4.13(表6)。这些结果表明,预测获得的三维结构模型的可信度一般,需要进一步的实验验证与调整。

