2017—2019年四川部分地区PRRSV ORF5基因的遗传演化分析
唐伟明,秦立廷,董友富,陈 婷,罗 刚,卞 婷,张振东
(1.江苏科技大学生物技术学院,江苏 镇江 212018;2.山东新希望六和集团有限公司,山东 青岛 266000;3.青岛嘉智生物技术有限公司,山东 青岛 266000)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的一种急性、热性、高度接触性传染病,临床危害主要表现为母猪繁殖障碍、生长猪呼吸道疾病以及感染猪的继发感染。自20世纪80年代末和90年代初发现PRRSV以来,到目前为止在全球范围内仍未取得实质性的控制,给生猪产业带来了巨大的经济损失[1]。
PRRSV是一种呈球形、有囊膜的单股正链RNA病毒,全长基因组约15 kb,根据国际病毒学分类委员会(International Committee on Taxonomy of Virus,ICTV)最新的分类,其被归为套式病毒目(Nidovirales)、动脉炎病毒科(Arterividae)中的β动脉炎病毒属(Betarterivirus),包括PRRSV1和PRRSV2两个基因型,代表毒株分别为LV和VR-2332[2]。PRRSV具有广泛的变异和毒株多样性,Stadejek等将PRRSV1分为4个亚型[3],Shi等利用ORF5基因进行的遗传演化分析,将PRRSV2划分为9个谱系(Lineage)[4]。目前,我国PRRSV的流行以PRRSV2为主,主要包括4个谱系(Lineage 1,3,5,8)[5-6]。早期流行毒株以CH-1a 为代表的Lineage 8和以BJ-4为代表的Lineage 5为主[7];2006年,我国出现以JXA1和HuN4等为代表的高致病性PRRSV(HP-PRRSV),属于Lineage 8[8];2010年,我国东南部地区出现以QYYZ为代表的Lineage 3毒株[9];2013年,NADC30-like毒株(Lineage 1)传入我国,造成PRRS疫情的新流行[10];近年来,我国PRRSV毒株流行情况愈加复杂,疫苗演化毒株、多谱系重组毒株、新毒株层出不穷[11-12],给我国PRRS的防控带来了巨大的挑战。
本试验对2017—2019年四川部分地区PRRSV阳性样品进行RNA提取,RT-PCR扩增ORF5基因,选取阳性产物进行克隆测序,与PRRSV参考毒株进行比较,以期阐述四川地区PRRSV的流行情况及病毒演化趋势,为PRRS的防控提供参考依据。
1 材料与方法
1.1 PRRSV阳性样品 47份PRRSV阳性样品于2017—2019年采集自四川省部分规模化猪场,由山东新希望六和集团有限公司于-80 ℃保存。
1.2 主要试剂 MagZol Reagent,购自Magen生物科技有限公司;2×TaqMaster Mix(Dye Plus)和HiScript II 1 st Strand cDNA Synthesis Kit,均购自南京诺唯赞生物科技有限公司;胶回收试剂盒,购自江苏康为世纪生物科技有限公司;pMD19-T载体,购自TaKaRa公司;DH5α感受态细胞由本实验室自制。
1.3 RNA提取与反转录 将PRRSV阳性样品研磨、离心,吸取上清300 μL于1.5 mL离心管,加入750 μL MagZol Reagent,彻底裂解后加入200 μL三氯甲烷,室温静置5 min,4 ℃离心机中以12 000 r/min离心15 min以形成三相分层体系;小心吸取上层水相转至新的1.5 mL离心管中,加入等体积异丙醇,室温静置10 min,4 ℃离心机中以12 000 r/min离心15 min以沉淀RNA;弃掉上清,加入1 mL 75%乙醇洗涤沉淀,反复2次;最后吸弃残留的液体,干燥晾干,加入20~30 μL DEPC水溶解RNA。将提取的RNA按照HiScript Ⅱ 1 st Strand cDNA Synthesis Kit说明书进行反转录,合成cDNA,置于-20 ℃保存备用。
1.4 引物设计与ORF5基因的扩增 根据GenBank中PRRSV 2的常见参考毒株序列,设计1对可扩增ORF5基因全长序列的引物。引物序列:上游引物ORF5-F:5′-GAGACCATGAGGTGGGCAAC-3′;下游引物ORF5-R:5′-CACTGGCGTGTAGGTAATG-3′,预期扩增片段大小为742 bp,引物由生工生物工程(上海)股份有限公司合成。PCR扩增反应体系50 μL:上、下游引物(10 μmol/L)各2 μL,模板5 μL,2×TaqMaster Mix 25 μL,ddH2O 18 μL。PCR反应条件:98 ℃预变性3 min;98 ℃变性15 s,55 ℃退火15 s,72 ℃延伸1 min,共35个循环;72 ℃延伸7 min。
1.5ORF5基因片段的克隆与测序 对ORF5基因RT-PCR扩增产物进行胶回收,克隆于pMD19-T载体,转化大肠杆菌DH5α感受态细胞,培养16~24 h后,挑取单菌落进行培养,鉴定阳性菌液送至生工生物工程(上海)股份有限公司进行序列测定。
1.6ORF5基因的同源性比对及其遗传演化分析 使用DNASTAR软件中MegAligen将获得的ORF5基因序列与常见参考毒株的ORF5基因序列进行核苷酸同源性分析和氨基酸序列比对;使用MEGA 7软件将35个ORF5序列与21个参考毒株进行进化树绘制分析,所用方法为“Maximun Likeihood”,模型为“Kimura 2-parameter substitution”,使用1 000 Bootstrap replicates,PRRSV参考毒株信息见表1。
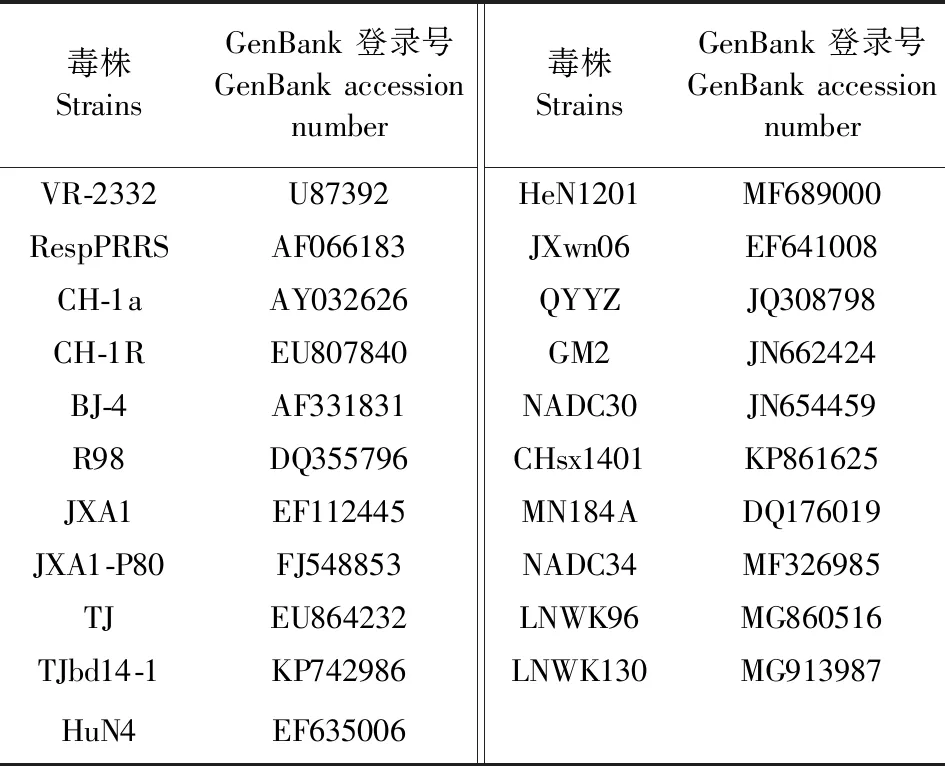
表1 参考毒株信息Table 1 Reference strains used in the study
2 结果
2.1 PRRSVORF5基因的RT-PCR扩增 对2017—2019年收集的四川省部分规模化猪场的47份 PRRSV阳性病料抽提RNA,利用设计好的引物进行ORF5基因的扩增,结果显示,47份阳性病料均能扩增出大小为742 bp的目的条带,部分样品的电泳结果见图1。
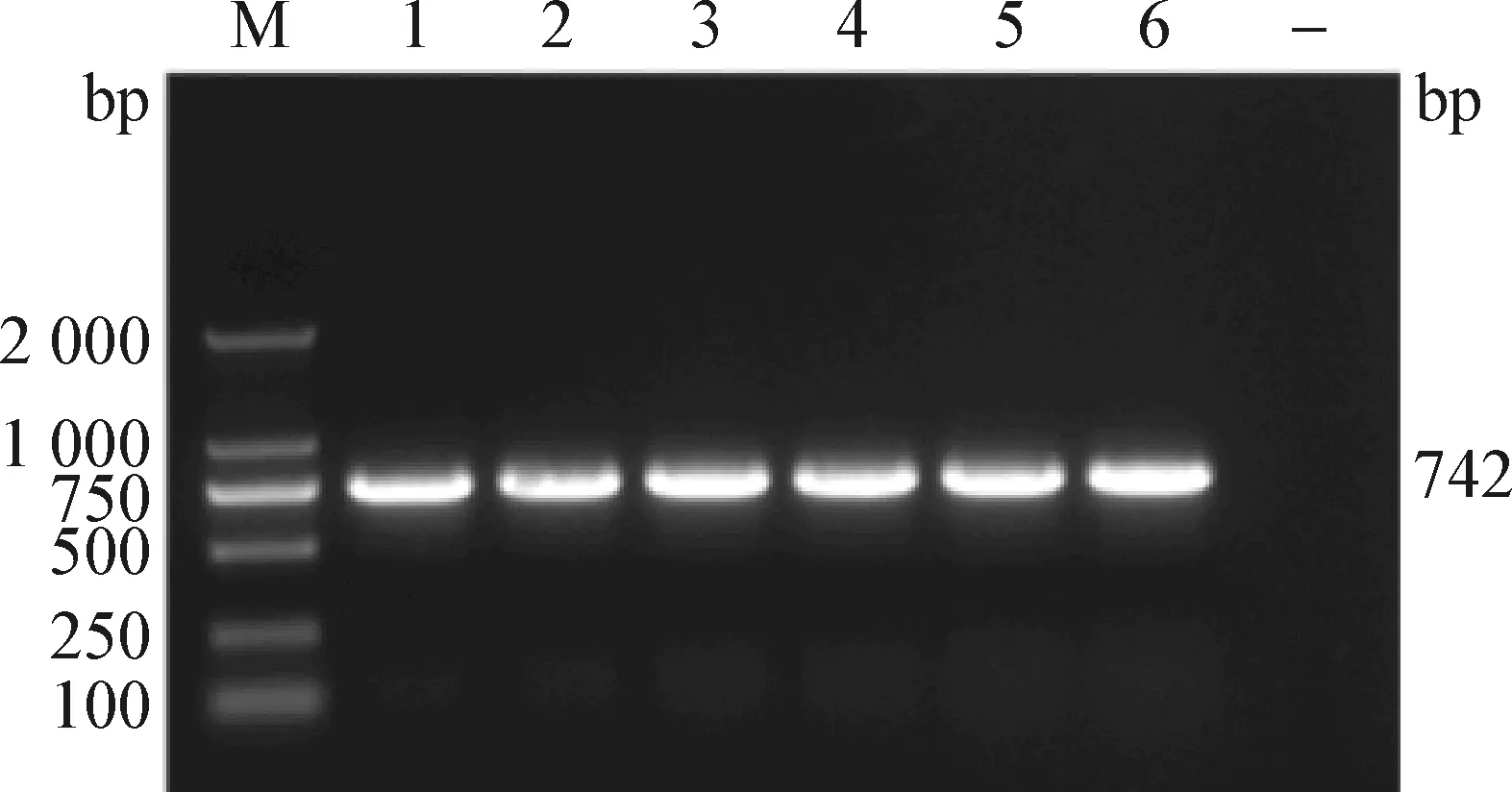
图1 PRRSV ORF 5 基因扩增Fig.1 Amplification of PRRSV ORF 5M:DL-2 000 DNA marker;-:阴性对照;1~6:部分样品M:DL-2 000 DNA marker;-:Negative control;1-6:Several samples
2.2 PRRSVORF5核苷酸同源性分析 47个PCR产物经克隆后测序,共获得47条PRRSVORF5基因序列,各序列之间的核苷酸同源性为84.2%~100.0%,剔除部分同源性为100%的序列,将35份阳性样品的核苷酸序列与国内外已发表的参考毒株ORF5基因序列进行同源性比对分析。结果显示,与PRRSV原始毒株LV(欧洲型)和VR-2332(美洲型)的核苷酸同源性分别为60.7%~64.6%和84.9%~99.3%,表明分离毒株均为PRRSV2。进一步分析,分离毒株与以NADC30等为代表的谱系1毒株核苷酸同源性为86.1%~93.7%,与以QYYZ为代表的谱系3毒株核苷酸同源性为82.6%~84.4%,以HP-PRRSV及其疫苗毒株为代表的谱系8毒株核苷酸同源性为84.2%~99.2%(表2)。其中,分离于不同时间和地区的SC1704与SC1706,SC1807与SC1808,SC1712、SC1713与SC1904核苷酸同源性为100.0%,表明PRRSV可持续传播与流行。
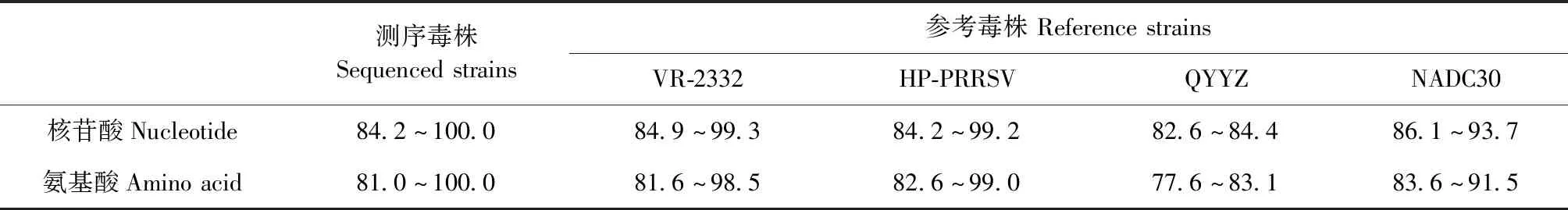
表2 本试验测序毒株与参考毒株之间ORF 5核苷酸及推导氨基酸同源性比较Table 2 Homology comparison of ORF 5 nucleotide and deduced amino acid between sequenced strains and reference strains (%)
2.3 PRRSVORF5基因的遗传演化分析 将35个毒株序列与常见参考毒株的ORF5基因进行比对并构建分子遗传进化树(图2)。结果显示,35个分离毒株分属于3个谱系(1,5,8),其中以VR-2332为代表的谱系5毒株13株(37.1%),以HP-PRRSV为代表的谱系8毒株10株(28.6%),以NADC30为代表的谱系1毒株12株(34.3%),表明四川地区PRRSV的流行主要以该3个谱系毒株为主。
2.4 PRRSVORF5推导的氨基酸同源性分析 将35个毒株ORF5基因推导的氨基酸序列与常见参考毒株进行比对,结果如表2所示,与谱系1毒株NADC30、谱系3毒株QYYZ、谱系5毒株VR-2332和谱系8毒株HP-PRRSV氨基酸同源性分别为83.6%~91.5%、77.6%~83.1%、81.6%~98.5%和82.6%~99.0%。进一步比较发现,SC1702等11个分离毒株ORF5基因在第34位存在1个氨基酸的缺失(图3),更有意思的是这11个缺失毒株均属于谱系1毒株(图2),表明该缺失可能存在毒株特异性,值得进一步研究。
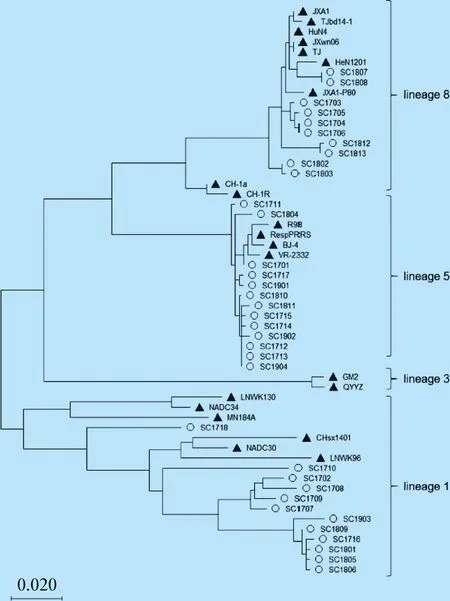
图2 PRRSV ORF 5 基因遗传进化树Fig.2 Phylogenetic tree based on PRRSV ORF 5 gene▲:参考毒株;○:分离毒株▲:Reference strains;○:Isolated strains

图3 PRRSV ORF 5基因推导的氨基酸序列分析(0~100)Fig.3 Sequence analysis of deduced PRRSV ORF 5 amino acid(0-100)▄:氨基酸缺失位点▄:Deletion site of amino acid
3 讨论
PRRSV具有极易变异和快速演化的能力,变异株、新毒株层出不穷,据Han等研究分析报道[6],自2006年HP-PRRSV暴发以来,我国的PRRS疫情可分为3个流行阶段,第1阶段为2006—2008年,以最初暴发的具有高同源性的HP-PRRSV为主;第2阶段为2009—2012年,PRRSV毒株之间的重组活动导致了疫情的再度流行,并且自该时期开始,PRRSV变异与演化的速率呈现出明显加快的趋势[13],这可能与HP-PRRSV减毒活疫苗的逐步推广使用有关;2013年以来为第3阶段,近年来HP-PRRSV似乎“销声匿迹”,分离到的毒株多数是HP-PRRSV疫苗毒、疫苗演化毒株及其与NADC30-like毒株的重组毒株。另外,以QYYZ为代表的谱系3毒株也在小范围内流行。2017年下半年,以nsp2编码区100个氨基酸的连续缺失为特征的NADC34-like毒株在我国被分离[14],我国PRRSV临床毒株的遗传多样性和复杂性再次增加。
本试验通过对2017—2019年四川地区收集的47份PRRSV阳性样品进行ORF5基因的扩增、克隆、测序,结果发现,近几年四川地区PRRSV的流行主要以PRRSV 2 谱系1,5,8毒株为主,其中以VR-2332为代表的谱系5毒株占比最高(37.1%),推测可能与谱系5来源疫苗毒的广泛使用有关。NADC30-like毒株占比34.3%,超过HP-PRRSV毒株(28.6%),进一步说明NADC30-like毒株正逐步取代HP-PRRSV,成为该地区的优势流行毒株,但需要指出的是NADC30-like毒株与HP-PRRSV及其疫苗演化毒株之间的重组毒株越来越多,且ORF5为重组热点区域,不排除本试验中的分离毒株是以HP-PRRSV为骨架,ORF5区域为NADC30-like的重组毒株,因此,基于目前国内PRRSV的流行情况,以ORF5进行谱系划分的标准需进一步商榷。此外,本试验中未检测到以QYYZ为代表的谱系3毒株,但其在我国南部部分地区有流行之势,部分研究已在四川地区检测并分离到QYYZ-like及其与其他谱系的重组毒株[15],因此,对谱系3毒株的监测需引起重视。ORF5基因编码的GP5蛋白是PRRSV重要的囊膜糖蛋白,其第27~41位氨基酸为重要的抗原相关区域,本试验中发现11个分离株在第34位存在1个氨基酸的缺失,该缺失是否影响GP5蛋白的抗原表达需要进一步研究。更有意思的是,11个缺失毒株均属于以NADC30-like为代表的谱系1毒株,表明该缺失可能存在毒株特异性,该缺失对PRRSV致病力的影响值得进一步研究。

