井冈羟胺A 酯类衍生物的酶法合成及其生物活性
叶 康, 江瑞妮, 苍 涛, 陆跃乐, 陈小龙, 范永仙
(1. 浙江工业大学 生物工程学院,杭州 310014;2. 浙江工业大学 化学工程学院,杭州 310014;3. 浙江省农业科学院 农产品质量安全与营养研究所,杭州 310021)
井冈霉素 (validamycin) 是由吸水链霉菌井冈变种合成的一类农用抗生素[1],包括A、B、C、D、E、F、G 和H 共8 个组分,具有低毒、高效、廉价等优势,被广泛用于水稻纹枯病的防治[2]。井冈羟胺A (validoxylamine A) 作为井冈霉素A 中的活性结构单元,具有抑菌、杀虫活性[3],是重要的生物农药中间体[4](图式1)。
研究表明,井冈羟胺A 作为一种竞争性的海藻糖酶抑制剂,能够高效抑制海藻糖的水解,阻断生物体内的能量代谢,达到抑制病虫害的效果[5]。然而,尽管在离体试验中井冈羟胺A 对海藻糖酶表现出极强的抑制活性[6-7],但是由于其含多个羟基结构,而生物体对井冈羟胺A 的吸收效果较差,所以在活体实验中未能表现出应有的生物活性[8]。因此,如何提高井冈羟胺A 对昆虫表皮的透皮作用成为研究的热点和难点。郑鹛[9]合成了菊酰基井冈羟胺A 化合物,其在500 mg/L 下对苜蓿蚜虫死亡率达96.7%。郑辉[10]通过化学法构建了多种井冈羟胺A 衍生物的化合物库,在一定程度上拓宽了井冈羟胺A 的应用范围。
酯化反应是常见的用于改变化合物极性的药物设计手段,但井冈羟胺A 的多羟基结构加大了其通过化学方法进行酯化修饰的难度。与井冈羟胺A 结构类似的糖类化合物,在经脂肪酶Novozym 435 酯化合成糖酯后,已广泛用于食品、化妆品以及医药等领域[11]。由于在传统的化学酯化过程中,极易产生多种副产物,因此需要涉及羟基的保护/脱保护等复杂步骤[12-13],而脂肪酶催化的酯化反应具有高度的选择性,能在温和的条件下一步合成单一位点的酯化产物[14-16],并且现有的固定化技术不仅能够有效提高脂肪酶在有机溶剂中的耐受性,而且固定化脂肪酶还能够回收再利用,降低了使用成本[15,17]。鉴于此,本研究以井冈羟胺A 为先导化合物,利用脂肪酶Novozym 435将不同的有机酸引入井冈羟胺A 分子中,设计合成了9 个未见文献报道的井冈羟胺A 酯类衍生物(图式2),并测定了其对立枯丝核菌、油菜菌核病菌以及豆蚜的生物活性。
1 实验部分
1.1 仪器与试剂
Bruker Avance Ⅲ 500 MHz 核磁共振仪 (以DMSO-d6或者Methanol-d4为溶剂,TMS 作为内标)。薄层层析硅胶板 (GF 254 型) 购自青岛海洋化工;柱层析硅胶 (300~400 目,粒度为40~45 μm)购自阿拉丁 (上海) 试剂有限公司;脂肪酶Novozym 435 购自北京高瑞森科技有限公司;全部试剂均为市售分析纯。
1.2 目标化合物合成
将8 g 井冈羟胺A 加入500 mL 叔丁醇中,100 ℃下回流5 h,得到井冈羟胺A-叔丁醇饱和溶液,备用。在单口圆底烧瓶中,依次加入井冈羟胺A-叔丁醇饱和溶液21 mL (含井冈羟胺A 0.5 mmol)、有机酸2 mmol、Novozym 435 脂肪酶60 mg 和4Å分子筛600 mg,于60 ℃恒温磁力搅拌水浴锅中反应。24 h 后补加井冈羟胺A 固体170 mg (0.5 mmol),继续反应24 h,采用薄层色谱(TLC,V(正丙醇):V(乙酸) :V(水) = 4 : 1 : 1) 监控至反应终点。过滤,减压脱去溶剂,用10 mL正丁醇萃取,再用饱和氯化钠洗涤,保留有机相,减压蒸馏除去有机溶剂,硅胶柱层析 (V(正丙醇) :V(乙酸) = 8 : 1) 纯化,减压脱去溶剂并干燥后得到井冈羟胺A 酯类衍生物。
9 种新型衍生物的结构经1H NMR、13C NMR和HRMS 验证,相关数据如下。
井冈羟胺A 芥酸酯 (Ⅰ):淡黄色油状液体,收率42%。1H NMR (500 MHz, Methanol-d4),δ: 5.98 (d,J= 13.7 Hz,1H), 5.36 (t,J= 4.9 Hz, 2H), 4.81 (d,J= 12.9 Hz, 1H), 4.61(d,J= 13.0 Hz, 2H), 4.21 (p,J= 14.4, 12.8 Hz, 3H), 3.99 (d,J= 8.4 Hz, 1H), 3.70 (s, 1H), 3.67 - 3.58 (m, 3H), 3.46 (d,J=15.1 Hz, 2H), 3.33 (d,J= 1.7 Hz, 3H), 3.27 (d,J= 8.8 Hz,1H), 2.40 - 2.32 (m, 2H), 2.12 (s, 1H), 2.09 - 2.03 (m, 4H),2.03 (s, 1H), 1.66 - 1.60 (m, 2H), 1.38 - 1.28 (m, 32H), 0.92(t,J= 6.8 Hz, 3H)。13C NMR (126 MHz, Methanol-d4),δ:175.70, 140.51, 140.84, 125.12, 75.02, 74.43, 74.12, 72.73,72.36, 70.74, 65.91, 63.33, 56.27, 54.83, 37.75, 33.04, 31.26,30.81, 30.72, 30.61, 30.58, 30.42, 30.31, 30.29, 30.24, 28.10,26.08, 26.04, 26.03, 22.57, 14.47。HRMS:C36H65NO9[M+H]+,测试值656.470 0,计算值656.469 3。
井冈羟胺A 对氟苯乙酸酯 (Ⅱ):淡黄色油状液体,收率34%。1H NMR (500 MHz, DMSO-d6),δ: 7.31 (dd,J= 8.4,5.5 Hz, 2H), 7.13 (t,J= 8.8 Hz, 2H), 5.75 (d,J= 4.1 Hz, 1H),4.20 (d,J= 3.1 Hz, 1H), 4.18 (d,J= 3.0 Hz, 1H), 4.00 (s, 1H),3.98 (s, 1H), 3.96 - 3.96 (m, 2H), 3.95 (s, 2H), 3.91 (s, 2H),3.74 (d,J= 5.9 Hz, 2H), 3.66 (s, 2H), 3.43 - 3.32 (m, 4H),3.26 - 3.22 (m, 1H), 3.08 - 3.01 (m, 2H), 2.99 - 2.92 (m, 1H),1.99 - 1.92 (m, 1H), 1.75 - 1.66 (m, 1H), 1.02 (t,J= 13.4 Hz,1H)。13C NMR (126 MHz, DMSO-d6),δ: 171.19, 160.29 (d,J= 242.6 Hz), 140.72, 131.46 (d,J= 8.1 Hz), 130.78, 120.00,114.99 (d,J= 20.8 Hz), 74.61, 73.39, 72.61, 71.61, 71.11,70.18, 65.47, 61.45, 54.10, 52.09, 38.40, 35.97, 27.52。HRMS:C22H30FNO9[M+H]+,测试值472.197 9,计算值472.197 7。
井冈羟胺A 对氯苯乙酸酯 (Ⅲ):淡黄色油状液体,收率39%。1H NMR (500 MHz, DMSO-d6),δ: 7.40 - 7.34 (m,2H), 7.33 - 7.28 (m, 2H), 5.74 (dd,J= 15.2, 4.0 Hz, 1H), 4.68(d,J= 13.3 Hz, 1H), 4.61 - 4.54 (m, 2H), 4.50 (s, 3H), 4.20(dd,J= 10.7, 3.1 Hz, 2H), 3.99 (t,J= 8.0 Hz, 2H), 3.74 (d,J=9.5 Hz, 1H), 3.68 (s, 1H), 3.48 (dd,J= 10.4, 3.7 Hz, 1H), 3.45 -3.38 (m, 2H), 3.35 (td,J= 9.1, 8.7, 3.9 Hz, 2H), 3.28 - 3.22(m, 1H), 3.12 (s, 1H), 3.05 (s, 1H), 3.01 (d,J= 9.2 Hz, 1H),2.96 (d,J= 9.3 Hz, 1H), 1.97 (s, 1H), 1.71 (dd,J= 10.9, 3.6 Hz,1H), 1.06 (dt,J= 13.4 Hz, 1H)。13C NMR (126 MHz, DMSOd6),δ: 170.87, 140.68, 135.07, 131.51, 128.28, 119.85, 74.57,73.33, 72.65, 70.58, 70.16, 70.07, 65.52, 61.40, 54.05, 52.04,38.40, 35.90, 27.48。HRMS:C22H30ClNO9[M+H]+,测试值488.167 7,计算值488.168 2。
井冈羟胺A3-苯丙酸酯 (Ⅳ):黄色油状液体,收率26%。1H NMR (500 MHz, DMSO-d6),δ: 7.27 (t,J= 7.5 Hz,2H), 7.21 (d,J= 7.6 Hz, 2H), 7.18 (t,J= 7.3 Hz, 1H), 5.78 (d,J= 4.5 Hz, 1H), 4.72 - 4.34 (m, 8H), 4.18 (dd,J= 10.9,3.1 Hz, 1H), 4.00 (d,J= 6.2 Hz, 1H), 4.00 - 3.95 (m, 2H),3.74 (d,J= 6.3 Hz, 1H), 3.43 (dd,J= 8.9, 5.7 Hz, 1H), 3.38 (t,J= 4.2 Hz, 1H), 3.36 (d,J= 9.0 Hz, 1H), 3.27 (dd,J= 9.4,4.4 Hz, 1H), 3.12 (d,J= 4.7 Hz, 1H), 3.06 (q,J= 4.2, 3.7 Hz,1H), 3.00 (t,J= 9.7 Hz, 1H), 2.85 (t,J= 7.6 Hz, 2H), 2.61 (t,J= 7.6 Hz, 2H), 1.98 (tdt,J= 10.2, 6.8, 4.0 Hz, 1H), 1.70 (dt,J= 14.4, 3.5 Hz, 1H), 1.04 - 0.98 (m, 1H).13C NMR (126 MHz,DMSO-d6),δ: 172.75, 141.05, 141.00, 128.77, 128.65, 126.49,120.32, 75.07, 73.75, 73.70, 73.06, 71.45, 70.60, 65.33, 61.86,54.62, 52.58, 36.33, 35.59, 30.76, 27.91. HRMS: C23H33NO9[M+H]+,测试值498.268 1,计算值498.268 8。
井冈羟胺A 肉桂酸酯 (Ⅴ):黄色油状液体,收率33%。1H NMR (500 MHz, Methanol-d4),δ: 7.69 (dd,J=16.0, 7.1 Hz, 1H), 7.58 (dd,J= 6.2, 2.8 Hz, 2H), 7.38 (dd,J=4.6, 2.2 Hz, 3H), 6.53 ((d, J = 5.0 Hz, 1H), 5.94 (d,J= 4.4 Hz,1H), 4.90 (s, 1H), 4.85 (s, 1H), 4.36 - 4.25 (m, 1H), 4.18 (d,J= 14.1 Hz, 1H), 4.12 (d,J= 14.1 Hz, 1H), 3.97 (d, J = 5.8 Hz,1H), 3.66 (d,J= 6.8 Hz, 1H), 3.64 (d,J= 5.6 Hz, 1H), 3.61 (d,J= 3.4 Hz, 1H), 3.59 (d,J= 9.1 Hz, 1H), 3.57 (d,J= 5.3 Hz,1H), 3.56 (d,J= 6.0 Hz, 1H), 3.54 (d,J= 9.2 Hz, 1H), 3.48(dd,J= 9.8, 4.1 Hz, 1H), 3.42 (d,J= 4.3 Hz, 1H), 3.32 (s, 2H),3.31 - 3.29 (m, 1H), 3.26 (s, 1H), 3.23 (t,J= 9.3 Hz, 1H), 2.17(s, 1H), 2.04 - 1.99 (m, 1H), 1.85 (d,J= 6.1 Hz, 1H)。13C NMR (126 MHz, Methanol-d4),δ: 177.21, 145.19, 141.16,134.35, 130.17, 124.27, 117.43, 75.00, 74.56, 73.26, 72.92,71.42, 70.12, 64.95, 61.12, 54.99, 53.39, 38.51, 27.29。HRMS: C23H31NO9[M+H]+,测试值466.206 9,计算值466.206 2。
井冈羟胺A 水杨酸酯 (Ⅵ):黄色油状液体,收率14%。1H NMR (500 MHz, Methanol-d4),δ: 7.86 (s, 1H), 7.44(s, 1H), 6.89 (dd,J= 7.2, 3.8 Hz, 1H), 6.87 - 6.84 (m, 1H),5.93 (d,J= 14.7 Hz, 1H), 4.68 (s, 1H), 4.56 (s, 1H), 4.45 (s,2H), 4.23 (d,J= 5.1 Hz, 1H), 4.16 (s, 1H), 4.14 (m, 1H), 4.10(s, 1H), 4.02 (s, 1H), 3.93 (dJ= 4.9 Hz, 2H), 3.83 (s, 1H), 3.64 -3.61 (m, 2H), 3.58 (s, 2H), 3.52 (s, 1H), 3.45 (d,J= 6.7 Hz,2H), 3.04 (s, 1H), 2.24 - 2.19 (m, 1H), 1.80 (s, 2H), 1.51 -1.47 (m, 1H)。13C NMR (126 MHz, Methanol-d4),δ: 170.23,164.06, 141.65, 134.19, 133.24, 126.13, 119.02, 112.90,112.49, 73.68, 73.47, 73.09, 71.14 70.05, 69.78, 65.72, 61.84,56.11, 55.93, 37.07, 25.75。HRMS: C21H29NO10[M+H]+,测试值456.186 0,计算值456.186 4。
井冈羟胺A 阿魏酸酯 (Ⅶ):黄色油状液体,收率12%。1H NMR (500 MHz, DMSO-d6),δ: 7.69 (d,J= 14.2 Hz,1H), 7.22 (s, 1H), 7.10 (s, 1H), 6.95 - 6.88 (m, 1H), 6.87 -6.76 (m, 1H), 6.41 (d,J= 12.5 Hz, 1H), 6.01 - 5.95 (m, 1H),4.77 (d,J= 7.3 Hz, 1H), 4.74 (d,J= 12.1 Hz, 1H), 4.72 - 4.69(m, 1H), 4.36 - 4.30 (m, 1H), 4.29 - 4.25 (m, 1H), 4.21 (s,1H), 4.19 (s, 1H), 4.13 (s, 1H), 4.03 (s, 1H), 4.00 (s, 1H), 3.96(s, 2H), 3.89 (s, 3H), 3.70 (s, 2H), 3.65 - 3.60 (m, 2H), 3.57 (s,1H), 3.52 (s, 1H), 3.51 (s, 1H), 3.05 (s, 1H), 2.25 - 2.17 (m,1H), 1.88 (s, 1H), 1.64 (s, 1H)。13C NMR (126 MHz,Methanol-d4),δ: 177.36, 147.11, 145.55, 144.14, 140.29,127.19, 125.73, 124.87, 120.03, 115.06, 75.14, 73.68, 73.13,71.57, 71.01, 69,89, 63.32, 61.92, 55.36, 55.08, 52.87, 38.52,25.24。HRMS: C24H33NO11[M+H]+,测试值512.213 1,计算值512.212 6。
井冈羟胺A11-马来酰亚胺十一酸酯 (Ⅷ):褐色油状液体,收率52%。1H NMR (500 MHz, Methanol-d4),δ: 6.14 -5.75 (m, 1H), 4.82 - 4.71 (m, 1H), 4.59 (s, 1H), 4.51 (s, 1H),4.29 (t,J= 6.7 Hz, 1H), 4.19 (s, 1H), 4.18 - 4.07 (m, 2H), 4.02(q,J= 7.0 Hz, 1H), 3.99 - 3.93 (m, 1H), 3.91 - 3.84 (m, 1H),3.78 (s, 1H), 3.70 - 3.61 (m, 2H), 3.61 - 3.57 (m, 2H), 3.50 (s,1H), 3.48 - 3.47 (m, 2H), 3.35 - 3.22 (m, 3H), 3.05 - 2.94 (m,1H), 2.66 - 2.50 (m, 4H), 2.40 - 2.21 (m, 2H), 2.16 - 2.01 (m,1H), 1.92 (s, 1H), 1.65 - 1.52 (m, 5H), 1.33 - 1.23 (m, 12H)。13C NMR (126 MHz, Methanol-d4),δ: 177.08, 173.55, 141.25,124.61, 75.03, 73.80, 73.13, 71.55, 71.08, 70.65, 65.28, 64.36,54.67, 52.68, 38.99, 37.52, 34.08, 29.11, 28.93, 28.71, 28.15,28.03, 24.96, 24.93。HRMS: C29H48N2O11[M+H]+,测试值601.329 4,计算值601.329 2。
井冈羟胺A 环丙烷羧酸酯 (Ⅸ):淡黄色油状液体,收率48%。1H NMR (500 MHz, Methanol-d4),δ: 5.73 (m, 1H),4.63 (dd,J= 9.2, 6.2 Hz, 2H), 4.56 (d,J= 5.9 Hz, 1H), 4.36(d,J= 5.5 Hz, 1H), 4.27 - 4.19 (m, 3H), 4.19 - 4.05 (m, 3H),4.00 (s 1H), 3.96 - 3.87 (m, 1H), 3.72 - 3.60 (m, 4H), 3.59 -3.43 (m, 3H), 3.08 - 2.98 (m, 1H), 2.20 (d,J=6.4 Hz, 1H),1.97 - 1.84 (m, 2H), 1.66 (d,J= 3.9 Hz, 1H), 1.14 - 1.01 (m,2H), 1.01 - 0.89 (m, 2H)。13C NMR (126 MHz, Methanol-d4),δ: 173.61, 141.93, 125.11, 74.89, 74.50, 74.16, 73.92, 72.30,71.03, 67.99, 63.96, 56.68, 55.33, 37.25, 25.71, 13.24, 9.36。HRMS: C18H29NO9[M+H]+,测试值404.185 1,计算值404.185 6。
1.3 生物活性测试
1.3.1 抑菌活性 立枯丝核菌Rhizoctonia solani和油菜菌核病菌Sclerotinia sclerotiorum,分别由浙江大学和浙江省农业科学院提供。
采用菌丝生长速率法[18]测定化合物Ⅰ ~Ⅸ 对植物病原真菌的抑制活性,药剂质量浓度为200、100、50、25、12.5 和6.25 μmol/L。将目标化合物用5 mL 含0.1% Tween-80 的无菌水溶解,加入热培养基中,配制成含药培养基。在含药培养基上接入菌饼,每个药剂设置3 次重复。置于生化培养箱 (温度23 ℃) 中培养,待空白对照菌落长至培养皿2/3 直径时,测定处理组菌落直径,并按 (1)式计算抑制率。采用SPSS 软件计算EC50值和95%置信区间。
式中:I—菌丝生长抑制率,%;D0—空白对照菌落直径,mm;Dt—药剂处理菌落直径,mm。
1.3.2 杀虫活性 豆蚜Aphis craccivora,由浙江省农业科学院提供。
采用浸叶法[19]测定目标化合物对豆蚜的杀虫活性。准确称取待测化合物50 mg,用正丙醇溶解并配制成质量浓度为500 mg/L 的药液。将感染蚜虫的蚕豆叶片浸入药液中10 s,取出悬挂10~20 min 风干水分后,置于带有湿滤纸片的培养皿中,每个处理设置3 个重复。于23~25 ℃室内培养,相对湿度65%,24 h 后统计结果。以井冈羟胺A 与井冈霉素A 为阳性对照,正丙醇为阴性对照,另设空白对照 (CK)。以毛笔拨动虫体无反应记为死亡,当CK 死亡率大于10%时判定试验无效。
分别按 (2)、(3) 式计算死亡率 (M) 和校正死亡率 (Ma)。
式中:N1—豆蚜死亡数;N2—豆蚜总数;M1—施药组死亡率,%;M2—空白组死亡率,%。
2 结果与讨论
2.1 目标化合物的合成
在合成化合物之前,通过制备井冈羟胺A-叔丁醇饱和溶液将反应液中井冈羟胺A 的质量浓度由5.5 g/L 提高至8.2 g/L,有利于提高酶催化反应速率。有研究表明,在脂肪酶催化糖酯合成研究中,提高酰基供体的浓度能够促进反应的进行[20-21]。Yan 等[22]研究了糖酯合成过程中底物物质的量之比对产率的影响,发现过量的酰基供体对提高糖酯的产率有较大作用。本研究通过对多个反应条件的探索,最终确定反应温度为60 ℃,底物n(井冈羟胺A) :n(有机酸) = 1 : 4,分子筛质量浓度为30 g/L,脂肪酶质量浓度为3 g/L。当以酚酸作为酰基供体时,反应时间需延长至7 d 后才检测到少量产物的生成,这与文献报道的由Novozym 435 催化水杨酸酯的合成效率相似[23-25],可能是由于水杨酸苯环上的羟基对脂肪酶具有一定抑制效应[26]。Novozym 435 作为催化剂在合成多元醇酯化物时具有区域选择性。例如:在催化合成海藻糖二酯时,其酯化位点在两个伯羟基[27],在催化葡萄糖与脂肪酸的酯化反应中,其酯化位点同样在6 位的伯羟基[28-29]。本研究以Novozym 435 为催化剂合成井冈羟胺A 酯类衍生物,反应过程简单,选择性高,产物单一有利于分离纯化,并且反应用到的脂肪酶、分子筛、叔丁醇均能够回收再利用,符合可持续发展理念。
2.2 化合物的核磁数据分析
以目标化合物 Ⅳ 的结构 (图式3) 为例。其与井冈羟胺A 的1H NMR 谱及13C NMR 谱的信号归属如表1 所示。高分辨质谱显示分子中只增加了一个酰基,说明产物为井冈羟胺A 的一酰基化产物;通过比较原料和产物的1H NMR 谱发现,酯化后井冈羟胺A 在δ1.70 处的多重峰向低场移动至δ2.00,这是5 位质子受吸电子基团的诱导效应所致,而比较13C NMR 谱发现,井冈羟胺A 中δ63.06 向低场移动至δ65.33,这是7 位碳受吸电子基团的诱导效应所致,δ38.86 向高场移动至δ36.33,这是6 位碳受γ-效应所致。根据这些结果初步说明酶催化酯化反应区域选择性发生在7 位。进一步分析发现,7 位伯碳上质子的化学位移向低场移动到δ4.18 和4.00。化合物IV 的二维谱图远程异核化学位移相关谱 (HMBC,图1) 显示,7 位伯碳上的质子 (δ4.18 和4.00) 与δ172.75的羰基碳存在远程相关,因此,确定井冈羟胺A 酯化物的酯化位点发生在7 位伯羟基。
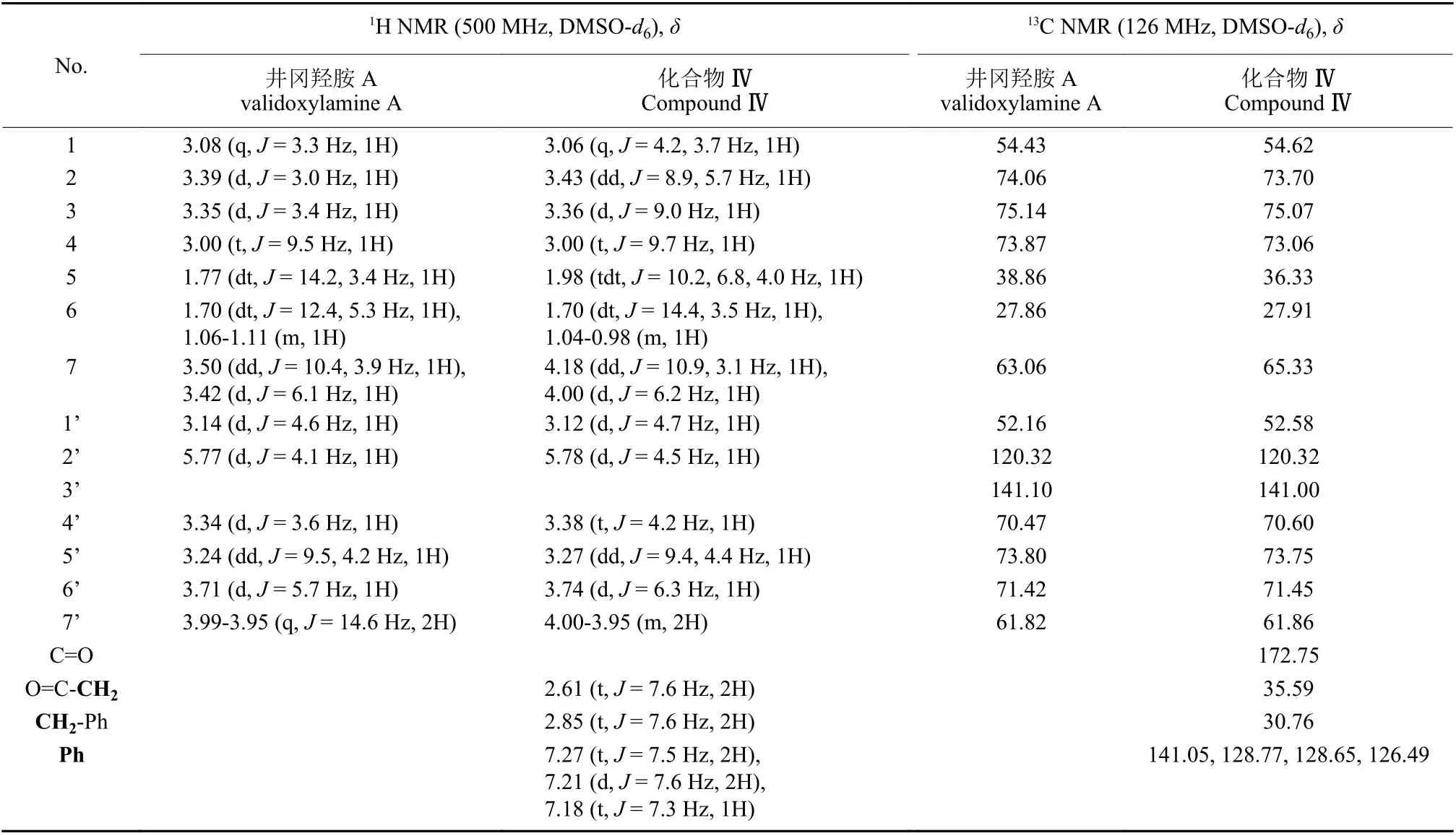
表1 化合物 Ⅳ 与井冈羟胺A 的核磁数据分析Table 1 NMR data analysis of compound Ⅳ and validoxylamine A
2.3 对立枯丝核菌和油菜菌核病菌的抑菌活性
目标化合物对立枯丝核菌的抑制作用见表2。除化合物 Ⅱ、Ⅳ、Ⅸ 外,其余化合物在200 μmol/L下对立枯丝核菌的抑制率均大于50%,其中化合物Ⅰ和 Ⅲ 的抑制率分别为71.22%和73.48%。在测定化合物的EC50值时发现,化合物Ⅰ、Ⅲ、Ⅷ表现出优于先导化合物井冈羟胺A 的抑菌活性。初步构效关系分析结果表明:直链有机酸作为酰基供体有利于提高目标化合物的抑菌活性,尤其是低浓度下还能保持较高的抑菌活性 (EC50值:井冈霉素A < Ⅰ < Ⅷ < Ⅲ < 井冈羟胺A < Ⅴ < Ⅵ <Ⅱ < Ⅶ < Ⅸ < Ⅳ);苯环上取代基的电负性增强有利于提高化合物的抑菌活性 (EC50值:Ⅱ < Ⅲ),推测是由于卤素作为亲脂基团,能够改善膜透过性,从而增强了化合物的抑菌活性[30];此外,烷烃链上的双键对化合物的抑菌活性具有促进作用(EC50值:Ⅴ < Ⅳ)。
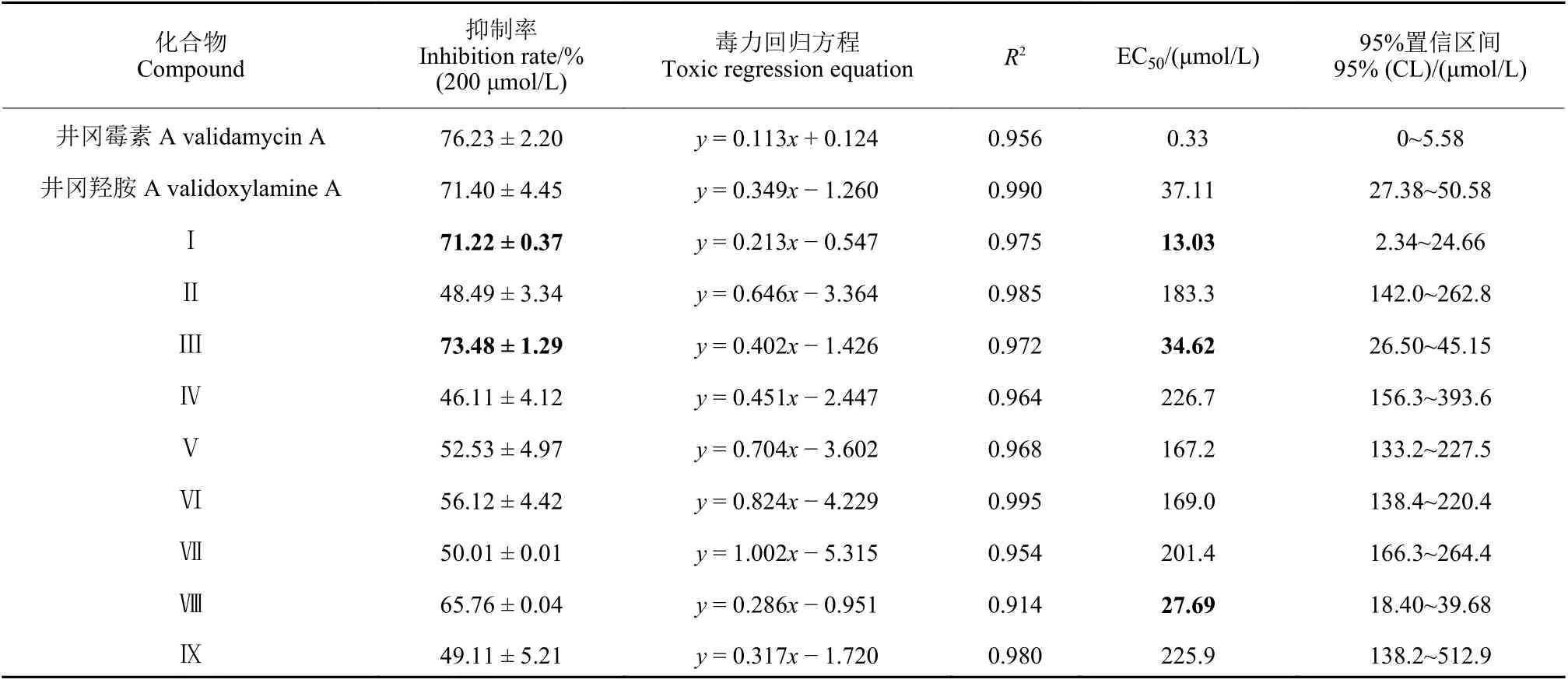
表2 井冈羟胺A 酯类衍生物对立枯丝核菌的抑制作用及EC50 值Table 2 Inhibition and EC50 values of validoxylamine A ester derivatives on R. solani
目标化合物对油菜菌核病菌的抑制活性如图2所示。在200 μmol/L 下,先导化合物井冈羟胺A并未表现出较高的抑制活性,而通过酯化反应引入不同酰基供体的衍生物却有部分表现出了更强的抑菌活性,如目标化合物 Ⅲ、Ⅷ 对油菜菌核病菌的抑制率比井冈霉素A 提高了1.5 倍。表明通过对井冈羟胺A 进行衍生化反应,能够拓宽其抗菌谱,有利于开发以井冈羟胺A 为先导化合物的杀菌剂。
2.4 对豆蚜的杀虫活性
如图3 所示,在500 mg/L 下,井冈羟胺A 与井冈霉素A 对豆蚜的校正死亡率分别为7.71%和32.74%,除了目标化合物Ⅰ和 Ⅸ外,其余化合物的杀虫活性相对于井冈羟胺A 都得到了提高,其中化合物 Ⅶ 的校正死亡率最高,为64.60%。
初步构效关系研究表明,当以碳链长度过大的有机酸 (化合物Ⅰ) 作为酰基供体时,由于空间位阻增大,削弱了相应衍生物的杀虫活性,而烷基链上的双键对衍生物的杀虫活性具有促进作用(校正死亡率:Ⅳ < Ⅴ);此外,苯环上卤素的电负性越强,杀虫活性越弱;甲氧基团 (化合物 Ⅶ) 对酯化产物的杀虫活性有着显著的增强作用。
3 结论
井冈羟胺A 为生物农药活性中心,利用脂肪酶法可选择性地对其进行酯化,获得系列新型化合物。本研究以井冈羟胺A 为先导化合物,经脂肪酶催化合成了9 种未见文献报道的井冈羟胺A酯类衍生物。抑菌活性研究表明,所有化合物对立枯丝核菌都表现出一定的抑制活性,其中化合物物Ⅰ、Ⅲ、Ⅷ 的EC50值分别为13.03、34.62和27.69 μmol/L,并且化合物 Ⅲ和 Ⅷ 在200 μmol/L下对油菜菌核病菌的抑制率分别为29.88% 和28.71%,优于井冈羟胺A。此外,对井冈羟胺A的结构进行修饰,还能增强其对蚜虫的杀虫活性,目标化合物 Ⅶ 在500 mg/L 下对蚜虫的致死率为64.60%。本研究为新型井冈羟胺A 酯类衍生物的设计和构效关系提供了新思路。

