水晶冰菜总黄酮大孔树脂纯化工艺及体外降糖活性研究
孙美玲, 冯晓光, 侯雪飞, 常希光, 陈湘宁
(1.北京农学院食品科学与工程学院,农产品有害微生物及农残安全检测与控制北京市重点实验室北京 102206; 2.北京裕农优质农产品有限公司,北京 101400)
水晶冰菜(Mesembryanthemumcrystallinum)是番杏科(Aizoaceae)日中花属(Mesembryanthemum)中的1 a或2 a生的草本植物,又名冰叶日中花、非洲冰花以及冰草等[1]。水晶冰菜原产自南非沙漠地区,近年来由日本引进至中国国内,其茎叶的表层部位分布着大量凸起的盐囊泡细胞,在阳光照射下晶莹剔透,因此而得名[2-3]。水晶冰菜生食口感清脆、生津止渴、健脾开胃,不仅含有蛋白质、脂肪、维生素、氨基酸、钙、镁和铁等基本营养成分,而且含有苹果酸、肌醇和黄酮类化合物[4-5]。作为高营养价值的功能性蔬菜,水晶冰菜不仅能抗氧化、抗肿瘤、增强人体免疫力,而且能预防心脑血管疾病、动脉粥样硬化和糖尿病等发生[6-7]。糖尿病是中国最常见的慢性病,其中Ⅱ型糖尿病患者的比例在95%左右,这和饮食习惯有直接的关系,而控制餐后体内的血糖水平已被视为治疗该病的有效手段[8]。α-葡萄糖苷酶和α-淀粉酶是将碳水化合物消化为葡萄糖的关键酶,在酶的催化下葡萄糖经小肠进入血液使血糖升高,目前临床上常使用阿卡波糖作为抑制剂降低血糖水平,但时常伴随着一些副作用如胃肠功能紊乱等发生[9]。相比之下,天然降血糖药物则因其天然性更安全。天然降血糖药物是指含有降糖活性物质如多糖、生物碱、萜类、酚酸类和黄酮类物质等的植物[10]。水晶冰菜中含有大量黄酮类物质[11],具有一定的降糖活性,因此具备作为天然降血糖药物的潜力。目前,与水晶冰菜相关的研究多集中在栽培种植[12]和景天酸代谢等方面[13],对其纯化尤其是体外降糖活性的关注较少。本研究以水晶冰菜为原料,对水晶冰菜总黄酮粗提物进行大孔树脂纯化,以吸附率和解吸率为指标,对6种不同极性的树脂(D101、AB-8、NKA-9、HPD-100、X-5、S-8)进行筛选,再通过静态与动态吸附与解吸试验,探讨样品质量浓度、pH值、洗脱液体积分数、上样流速与上样体积、洗脱流速与洗脱体积对水晶冰菜总黄酮树脂纯化的影响;在此基础上,以对α-葡萄糖苷酶和α-淀粉酶的抑制率评价指标,阿卡波糖为对照,考察纯化前后总黄酮的体外降糖活性变化,探讨水晶冰菜作为天然降血糖药物的潜力,为水晶冰菜生物活性的开发利用奠定理论基础。
1 材料与方法
1.1 试验材料
水晶冰菜购自北京农学院家属院超市;芦丁、维生素C、阿卡波糖标准品、大孔树脂(D101、AB-8、NKA-9、HPD-100、X-5、S-8)均购自北京中科生邦有限公司;α-淀粉酶 (166.7 μkat·g-1)、α-葡萄糖苷酶 (166.7 μkat·g-1) 、4-硝基苯-β-D-吡喃葡萄糖苷酶(pNPG),购自北京畅华志诚科技有限公司;其余试剂为分析纯,购自北京华佰泰生物科技有限公司。
1.2 仪器与设备
AL204电子天平:梅特勒-托利多仪器有限公司;T6-新世纪紫外分光光度计:北京普析通用仪器有限公司;L530台式离心机:湖南赫西仪器装备有限公司;KQ-500DE超声波清洗机:昆山超声仪器有限公司;FT135中草药粉碎机:天津泰斯特仪器有限公司;BK-FD10T台式冷冻干燥机:济南欧莱博科学仪器有限公司;DZF-1真空干燥箱:上海科恒实业发展有限公司;RE-2000B旋转蒸发仪:上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 水晶冰菜总黄酮粗提物的制备 将水晶冰菜置于60 ℃真空干燥箱内干燥48 h蒸干水分,碾碎过60目筛后取100 g于烧杯中加入2 500 mL体积分数70%乙醇溶液搅拌30 min,在60 ℃下以250 W的功率在超声波清洗机中超声120 min,之后于离心机中10 000 r·min-1下离心15 min,残渣重复提取2次,合并上清液转移至旋转蒸发仪内蒸至无醇味,于冷冻干燥机中干燥24 h,得水晶冰菜总黄酮粗提物(以下简称粗提物),用去离子水溶解配置成不同质量浓度粗提物溶液备用。
1.3.2 水晶冰菜总黄酮质量浓度的测定 参考荆常亮[14]的方法稍作修改,采用NaNO2-Al(NO3)3比色法,得到芦丁标准曲线的线性回归方程为:y=0.102 1x+0.000 2,R2=0.999 8,进而测定水晶冰菜总黄酮质量浓度。
1.3.3 大孔树脂的筛选 选取6种极性不同的大孔树脂(D101、AB-8、NKA-9、HPD-100、X-5、S-8),具体参数如表1所示。按照杨宇华等[15]方法进行预处理,按照m(大孔树脂/g)∶V(粗提物溶液/L)=1∶20的比例在25 ℃、180 r·min-1的水浴恒温振荡器中振荡24 h,真空抽滤,测定滤液中总黄酮质量浓度C1;用去离子水冲洗吸附后的大孔树脂至液体清亮无浑浊,加入20 mL体积分数70%乙醇作为解吸液,同样条件下振荡24 h,真空抽滤,测定滤液中总黄酮质量浓度C2。大孔树脂吸附率、解吸率和回收率的公式如下:
(1)
(2)
(3)
式中:Q1、Q2、R分别为大孔树脂的吸附率、解吸率和回收率;C0、C1、C2分别为吸附前、吸附后和解吸液中总黄酮质量浓度;V1、V2分别为样品溶液和解吸液体积。
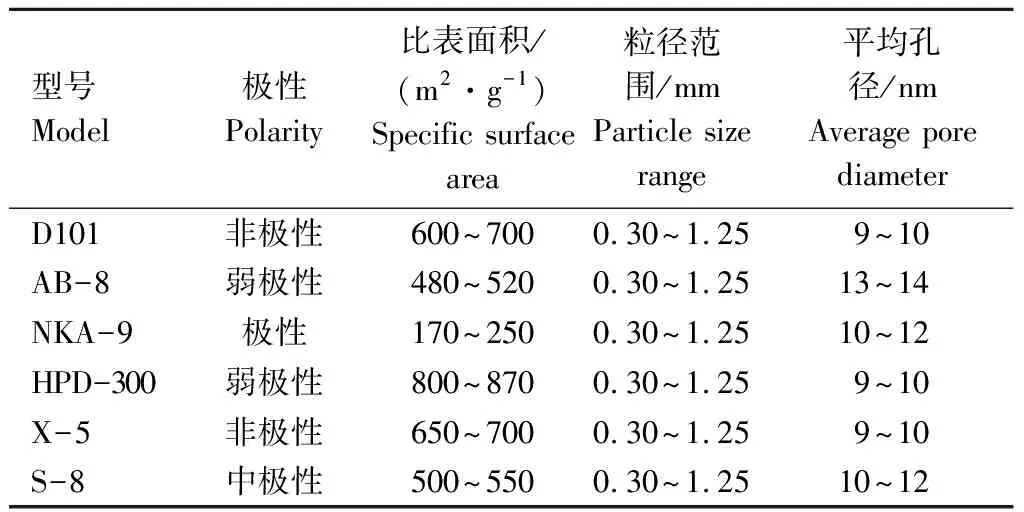
表1 6种大孔树脂参数比较Table 1 Comparison of parameters of six macroporous resins
1.3.4 水晶冰菜总黄酮大孔树脂纯化静态吸附和解吸试验 (1)静态吸附动力学曲线的绘制。称取2 g大孔树脂,加入40 mL 粗提物溶液,按照1.3.3方法处理,每30 min从溶液中快速吸取1 mL,以时间为横坐标,吸附率为纵坐标绘制吸附动力学曲线。
(2)粗提物溶液质量浓度对静态吸附的影响。称取8份1 g大孔树脂,加入20 mL 粗提物溶液,分别调节粗提物溶液质量浓度为0.02、0.05、0.10、0.15、0.20、0.25、0.30、0.35 g·L-1,按照1.3.3方法进行吸附处理,计算吸附率。
(3)pH值对静态吸附的影响。称取9份1 g大孔树脂,加入20 mL 粗提物溶液,分别调节粗提物溶液和体积分数70%乙醇解吸液pH值为1~9,按照1.3.3方法进行吸附和解吸处理,计算吸附率和解吸率。
(4)洗脱液体积分数对静态吸附的影响。称取7份1 g大孔树脂,加入20 mL 粗提物溶液,洗脱液乙醇体积分数为30%~90%,按照1.3.3方法进行解吸处理,计算解吸率。
1.3.5 水晶冰菜总黄酮大孔树脂纯化动态吸附和解吸试验 (1)上样流速和上样体积对动态吸附的影响。选取1.6 cm×30 cm的玻璃管层析柱湿法装柱,确定柱床体积1 BV=40 mL,在静态吸附基础上以40、60、80、100和120 mL·h-1的流速上样,计算吸附率。在合适的流速条件下,每8 mL收集1管流出液,共收集20管,测定总黄酮质量浓度,绘制泄漏曲线。
(2)洗脱流速和洗脱体积对动态吸附的影响。选取最佳上样条件上样,待吸附饱和后用去离子水冲洗树脂至洗脱液无色,先固定体积分数80%乙醇溶液为200 mL,在静态吸附基础上以40、60、80、100和120 mL·h-1的流速洗脱,计算解吸率。在合适的流速条件下,每8 mL收集1管洗脱液,共收集25管,测定总黄酮质量浓度,绘制洗脱曲线。
1.3.6 水晶冰菜总黄酮纯化物纯度测定 将洗脱液转移至旋转蒸发仪内蒸至无醇味,于低温冷冻干燥机中干燥24 h,得水晶冰菜总黄酮纯化物(以下简称纯化物),按下式计算纯度:
(4)
式中:m1、m2分别为粗提物和纯化物的质量。
1.3.7 水晶冰菜总黄酮体外降血糖活性试验 (1)抑制α-葡萄糖苷酶的活性测定。参考康彤[16]的方法稍作修改,将50 μL不同质量浓度(0.01、0.04、0.08、0.12、0.15 g·L-1)粗提物和纯化物溶液分别与50 μL α-葡萄糖苷酶(8.335 nkat·mL-1)均匀混合,于37 ℃下保温15 min。然后加入100 μL 的pNPG(3 mmol·L-1,溶解于0.1 mol·L-1,pH值6.8磷酸盐缓冲液中),在37 ℃反应20 min,添加750 μL Na2CO3(0.1 mol·L-1)终止反应,在405 nm处测定吸光度。用阿卡波糖作阳性对照,等体积磷酸盐缓冲液(0.1 mol·L-1,pH值6.8)代替α-葡萄糖苷酶溶液做对照组,抑制率公式如下:
(5)
式中:W为粗提物溶液或阿卡波糖对α-葡萄糖苷酶的抑制率;A为粗提物或纯化物组的吸光度;A0为对照组的吸光度;A1为PBS和pNPG溶液与酶溶液混合反应的吸光度;A2为PBS和pNPG溶液混合反应的吸光度。
(2)抑制α-淀粉酶的活性测定。参考李波等[17]的方法稍作修改,将100 μL不同质量浓度(0.01、0.04、0.08、0.12、0.15 g·L-1)粗提物和纯化物溶液分别与200 μL α-淀粉酶溶液(16.67 nkat·mL-1)在37 ℃下预混合10 min,加入400 μL 可溶性淀粉溶液(1.0 g·mL-1)在37 ℃下反应15 min,反应结束后添加400 μL DNS试剂终止。将混合物在沸水浴加热5 min,冰水浴冷却至25 ℃,并用2.9 mL去离子水稀释,于540 nm处测定其吸光度。用阿卡波糖作阳性对照,等体积磷酸盐缓冲液(0.1 mol·L-1、pH值6.8)代替α-淀粉酶溶液做对照组,抑制率公式如下:
(6)
式中:W为粗提物溶液或阿卡波糖对α-淀粉酶的抑制率;A为粗提物或纯化物组的吸光度;A0为对照组的吸光度。
1.3.8 数据分析 每组试验重复3次,试验结果以均值±标准差表示,用SPSS Statistics 21和Microsoft Excel 2007软件进行试验数据分析和绘图;IC50值指酶抑制剂对酶的半抑制质量浓度,利用 GraphPad Prism 8 软件进行计算分析。
2 结果与分析
2.1 不同大孔树脂对水晶冰菜总黄酮的吸附和解吸效果
合适的纯化树脂不仅要求吸附能力强,也需要较高的解吸能力。如图1所示,对比6种大孔树脂吸附率可知,AB-8最高为(51.36±0.07)%,D101吸附率为(48.32±0.21)%,比AB-8低0.59%,排在6种大孔树脂第3位。对比解吸率可知,D101最高为(54.95±0.09)%,明显高于其他大孔树脂。通过综合考虑,选择吸附和解吸效果较好的大孔树脂D101对水晶冰菜总黄酮粗提物进行纯化。

注:不同小写字母代表相同指标内差异显著,P<0.05。下同。
2.2 D101型大孔树脂对水晶冰菜总黄酮静态吸附和解吸试验结果
2.2.1 D101型大孔树脂静态吸附动力学曲线 D101型大孔树脂的静态吸附动力学曲线如图2所示。当吸附时间在0.5~3.5 h内,吸附率随时间延长有明显上升趋势,3.5 h时吸附率为35.39%,此后曲线逐渐趋于平缓,基本到达吸附平衡,在10 h时达到最大吸附率44.10%。
2.2.2 粗提物质量浓度对D101型大孔树脂静态吸附的影响 由图3知,D101型大孔树脂吸附率与粗提物质量浓度呈正相关。当粗提物质量浓度0.02~0.15 g·L-1时,吸附率显著上升;当粗提物质量浓度大于0.15 g·L-1时吸附率缓慢上升,且在0.30 g·L-1时达到最大吸附率51.86%,此后吸附率略微下降。
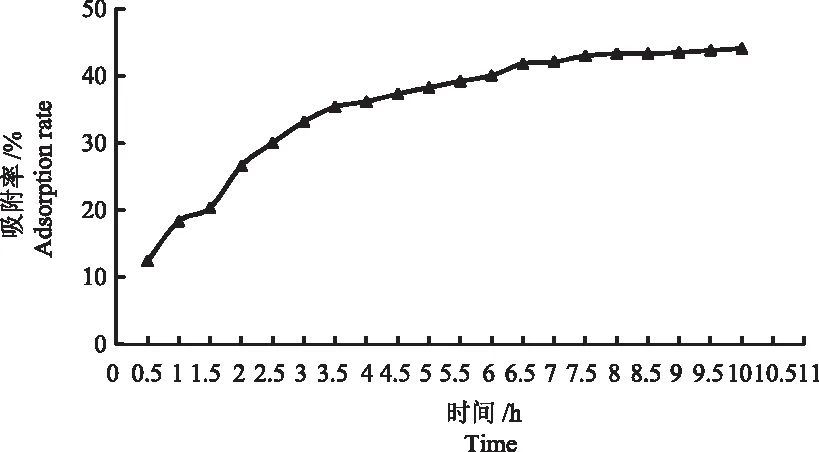
图2 D101型大孔树脂静态吸附动力学曲线Fig.2 Static adsorption kinetic curve of D101 macroporous resin

图3 粗提物质量浓度对D101型大孔树脂吸附率的影响Fig.3 Effect of total flavonoids on adsorption and desorption rate of D101 macroporous resin
2.2.3 pH值对D101型大孔树脂吸附率和解吸率的影响 由图4可知,当溶液pH值在1~4 时,D101型大孔树脂吸附率逐渐上升,当pH值为4时达到80.65%;当pH值大于4时,吸附率随pH值的上升而逐渐下降,即在酸性条件下吸附率明显上升,在碱性条件下急剧下降。同时,洗脱液pH值也呈现出先上升后下降的趋势,在pH值6时解吸率最高为54.87%,此后缓慢下降。

图4 pH值对D101型大孔树脂吸附率和解吸率的影响Fig.4 Effect of pH value on adsorption rate and desorption rate of D101 macroporous resin
2.2.4 洗脱液乙醇体积分数对D101型大孔树脂解吸率的影响 由图5可知,当洗脱液乙醇体积分数在30%~60%时,D101型大孔树脂解吸率随乙醇体积分数的上升而缓慢上升,而在乙醇体积分数60%~80%范围内急剧提升,当乙醇体积分数80%时达到最大解吸率81.28%,之后缓慢下降。

图5 洗脱液乙醇体积分数对D101型大孔树脂解吸率的影响Fig.5 Effect of volume fraction of eluent ethanol on desorption rate of D101 macroporous resin
2.3 D101型大孔树脂对水晶冰菜总黄酮动态吸附和解吸试验结果分析
2.3.1 上样流速和上样体积对D101型大孔树脂吸附率的影响 由图6知,D101型大孔树脂吸附率随上样流速的上升而下降,而且下降趋势明显。当上样流速为60 mL·h-1时D101型大孔树脂吸附率为79.43%,略高于20、40 mL·h-1时的吸附率。从节约时间成本提高试验效率的角度来讲,选择60 mL·h-1作为最佳上样流速,此时动态泄露曲线如图7所示。当流出液中目标成分的质量浓度为上样液质量浓度的1/10时即为泄漏点,此时大孔树脂基本达到吸附饱和状态,可以停止上样。第6管时流出液质量浓度0.026 g·L-1,第7管时流出液质量浓度为0.036 g·L-1,接近上样液质量浓度0.30 g·L-1的1/10,因此选择第7管56 mL为最佳上样体积。
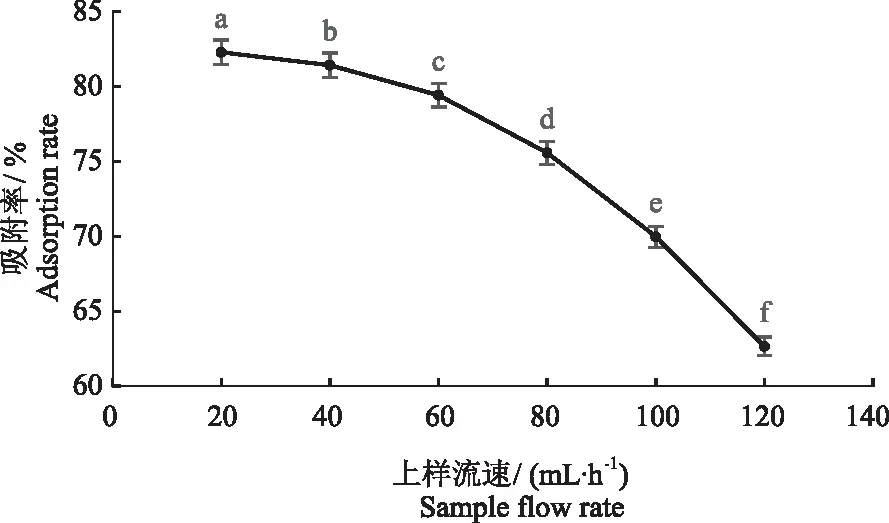
图6 上样流速对D101型大孔树脂吸附率的影响Fig.6 Effect of sample flow rate on adsorption rate of D101 macroporous resin
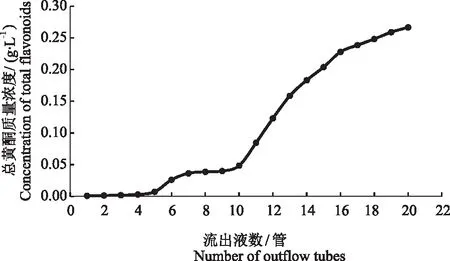
图7 水晶冰菜总黄酮的动态泄露曲线Fig.7 Dynamic leakage curve of total flavonoids in Mesembryanthemum crystallinum
2.3.2 洗脱流速和洗脱体积对D101型大孔树脂解吸率的影响 由图8可知,当固定体积分数80%乙醇溶液为200 mL时,随着洗脱流速的上升,D101型大孔树脂的解吸率先上升后下降。当洗脱流速在40 mL·h-1时达到最大的解吸率83.43%,而洗脱流速在60 mL·h-1时的解吸率为81.93%,略高于40 mL·h-1时的吸附率,从减少时间成本的角度选择60 mL·h-1作为最佳洗脱流速,对应的动态洗脱曲线如图9所示。随着洗脱体积的上升,洗脱液中总黄酮质量浓度先增大后减小,在第6管即洗脱体积为48 mL时达到峰值,到洗脱体积128 mL时总黄酮质量浓度几乎不变,说明在此时总黄酮基本洗脱完全,故选择128 mL作为最佳洗脱体积。

图8 洗脱流速对D101型大孔树脂解吸率的影响Fig.8 Effect of elution velocity on desorption rate of D101 macroporous resin
2.4 水晶冰菜总黄酮纯化物纯化验证结果
当粗提物质量浓度0.30 g·L-1、pH值4、上样流速60 mL·h-1、上样体积56 mL,洗脱液为80%的乙醇溶液、洗脱液pH值6、洗脱流速60 mL·h-1、洗脱体积128 mL时,经D101型大孔树脂纯化后水晶冰菜总黄酮纯化物纯度达到57.67%,较粗提物纯度提高了2.98倍,表明该纯化工艺条件下D101型大孔树脂对水晶冰菜总黄酮纯化有显著效果。
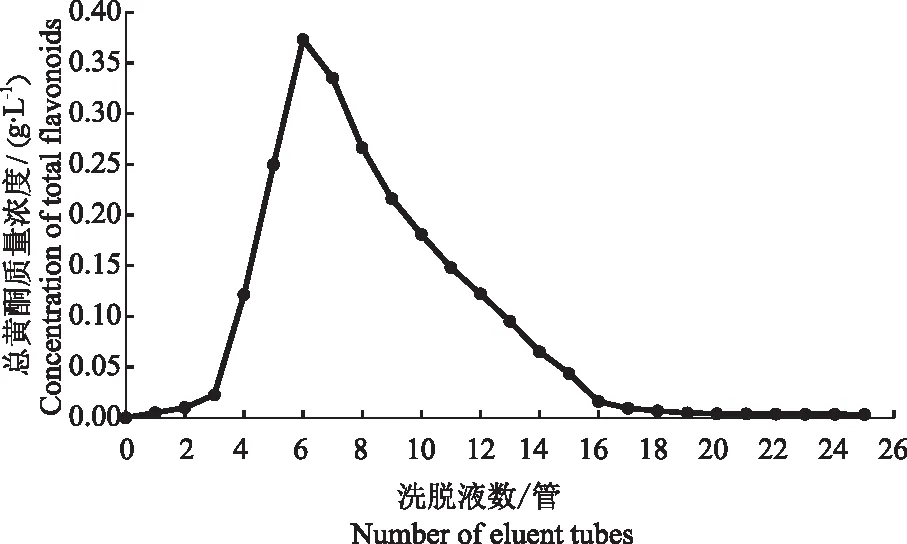
图9 水晶冰菜总黄酮的动态洗脱曲线Fig.9 Dynamic elution curve of total flavonoids in Mesembryanthemum crystallinum
2.5 水晶冰菜总黄酮体外降血糖活性试验结果
由表2可知,随着质量浓度的增大,粗提物、纯化物和阿卡波糖对α-葡萄糖苷酶和α-淀粉酶活性的抑制率均显著上升。当质量浓度为0.35 g·L-1时,粗提物、纯化物和阿卡波糖对α-葡萄糖苷酶活性的抑制率分别为52.58%、62.17%和69.78%,对α-淀粉酶的抑制率分别为57.78%、54.53%和43.66%。此时,对于α-葡萄糖苷酶活性抑制效果,阿卡波糖高于纯化物高于粗提物,呈显著性差异;对于α-淀粉酶活性抑制效果,阿卡波糖与纯化物无显著性差异,但均显著高于粗提物。由表3可知,粗提物、纯化物和阿卡波糖对α-葡萄糖苷酶活性抑制的IC50值分别为0.274、0.178、0.149 g·L-1;对α-淀粉酶活性抑制的IC50值分别为0.388、0.295、0.267 g·L-1。阿卡波糖与纯化物对2种酶活性的抑制效果无显著性差异,均显著高于粗提物。粗提物、纯化物和阿卡波糖对α-葡萄糖苷酶活性的抑制效果均显著高于对α-淀粉酶活性的抑制效果,这表明水晶冰菜总黄酮纯化物与阿卡波糖具有相当的降糖效果,且可以视为较强的α-葡萄糖苷酶抑制剂和较弱的α-淀粉酶抑制剂。
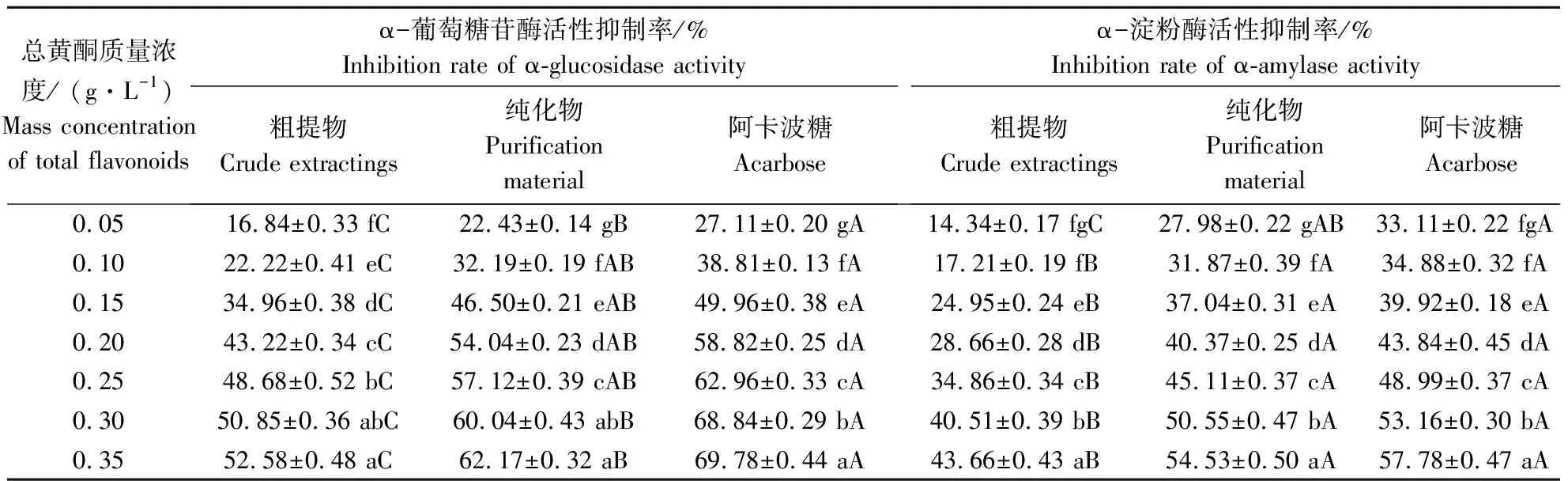
表2 水晶冰菜总黄酮及阿卡波糖对α-葡萄糖苷酶和α-淀粉酶活性抑制效果Table 2 Inhibitory effect of flavone and acarbose on α-glucosidase and α-amylase activity

表3 水晶冰菜总黄酮及阿卡波糖对α-葡萄糖苷酶和α-淀粉酶活性抑制的IC50值Table 3 Inhibitory effect of flavone and acarbose on α-glucosidase and α-amylase activity
3 结论与讨论
本文研究了不同因素对水晶冰菜总黄酮大孔树脂纯化工艺的影响,结果表明,D101型大孔树脂对水晶冰菜总黄酮有较好的吸附和解吸效果。在水晶冰菜总黄酮粗提物质量浓度0.30 g·L-1、pH值4、上样流速60 mL·h-1、上样体积56 mL,洗脱液为80%的乙醇溶液、洗脱液pH值6、洗脱流速60 mL·h-1、洗脱体积128 mL的条件下,经D101型大孔树脂纯化后,水晶冰菜总黄酮纯化物纯度达到57.67%,较粗提物的纯度提高了2.98倍。本研究同时发现水晶冰菜总黄酮对α-葡萄糖苷酶和α-淀粉酶表现出了不同程度的抑制能力,而且纯化后的抑制能力显著增强。本研究结果为开发水晶冰菜的功能活性奠定基础。
本研究采用D101型大孔树脂对水晶冰菜总黄酮粗提物进行纯化,原因是相比于其他类型的树脂,该树脂吸附和解吸附能力较好; AB-8吸附能力最强,推测其为弱极性树脂,具有从极性溶剂中吸附非极性物质和从非极性溶剂中吸附极性物质的双重性能[18],但是解吸率却较低,是因为AB-8树脂吸附的物质和树脂的结合力强,导致洗脱困难。作为合适的纯化树脂不仅要求吸附能力强,且更需要一定的解吸能力[19]。在静态吸附和解吸试验中,当粗提物质量浓度为0.30 g·L-1时吸附率达到最高51.86%,此后吸附率略微下降,该结果与王广慧等[20]研究结果一致,推测是粗提物质量浓度过低导致树脂无法吸附完全,而质量浓度过高时会产生少量杂质与黄酮类化合物竞争与树脂的吸附位点,造成吸附能力下降。当粗提物溶液pH值为4时吸附率最高,之后急剧下降,推测是因为总黄酮属于多羟基酚类化合物,在酸性条件下以分子状态存在,能通过范德华力吸附在树脂上,而在碱性条件下羟基去离子化形成离子型结构,吸附能力下降[21]。当洗脱液乙醇体积分数80%时解吸率最高,推测是因为随着乙醇体积分数的上升,极性增大,氢键逐渐断裂,解吸率上升,直到氢键断裂完全,解吸率不再有明显变化[22]。在动态吸附和解吸试验中,D101型大孔树脂的吸附率随上样流速的上升而下降,原因是上样流速变慢溶液可以和树脂充分接触,有效成分得到完全吸收,吸附率上升[23]。解吸过程中,洗脱流速过低或过高解吸率均有所下降,推测是因为在较低流速下洗脱液和总黄酮接触时间长,提高了醇溶性物质流出的可能性,而在较高流速下洗脱液未能和树脂上总黄酮类物质充分接触就被冲洗下来。目前,尚未发现对水晶冰菜纯化方法的报道,但袁茹楠等[24]采用AB-8大孔树脂纯化甘草渣总黄酮,纯化物纯度为53.43%,低于本研究结果,故认为D101型大孔树脂适用于水晶冰菜总黄酮的纯化。
通过纯化处理后的水晶冰菜总黄酮不仅能够抑制α-葡萄糖苷酶的活性,而且可以抑制α-淀粉酶的活性,对2种酶的IC50值分别为0.178、0.295 g·L-1,表现出了较高的降糖活性,推测水晶冰菜总黄酮在体内可以通过多途径多层次发挥不同程度的降糖作用[25]。目前,临床上最常用的降血糖类药物是阿卡波糖[26-27],而阿卡波糖和纯化物对α-淀粉酶的IC50值分别为0.267、0.295 g·L-1,无显著性差异。李萌萌等[28]报道的红树莓籽总黄酮对α-淀粉酶的IC50值为1.33 g·L-1,明显低于本研究结果。水晶冰菜总黄酮作为纯植物提取物与阿卡波糖有着相当的降糖活性,毒副作用小,具有广阔的应用前景。目前,相关研究尚未见关于水晶冰菜总黄酮降糖作用的报道,但李胜华等[29]发现蛇含委陵菜总黄酮对α-葡萄糖苷酶的活性抑制作用与本研究结果一致,但抑制能力却低于本研究结果,表明水晶冰菜总黄酮可以作为纯天然的α-葡萄糖苷酶和α-淀粉酶活性抑制剂,具有开发成为天然降血糖药物或者保健食品的潜力。本研究为水晶冰菜总黄酮开发成为天然降血糖药物或保健食品奠定理论基础。

