哈茨木霉菌诱导烟草抗黑胫病代谢差异的研究
刘利佳, 徐志强, 何佳, 丁永乐, 孙聚涛*
(1.河南农业大学烟草学院, 郑州 450000; 2.浙江中烟工业有限责任公司, 杭州 310009;3.河南中烟工业有限责任公司, 郑州 450000)
烟草黑胫病(tobacco black shank)又称烟草疫病,是由烟草疫霉菌(Phytophthoranicotianae)引起的一种毁灭性土传病害[1]。烟草疫霉菌发生范围广,危害重且防治难度大。病原菌发病流行期防治管理不当易造成大田烟株成片发病,严重时导致整片烟田发病,造成绝收,因此每年都对烟草生产造成巨大的经济损失。烟草疫霉菌长期寄生在病残体组织上或潜伏于土壤中,可在土壤中存活数年并逐年累积,其厚垣孢子可伴随雨水及灌溉水传播,待环境合适便萌发释放大量活动的游动孢子,造成二次侵染[2]。为降低烟草疫霉菌对烟叶产量和品质的影响,生产上常用化学杀菌剂防治烟草疫霉菌,虽然取得了一定的防治效果,但杀菌剂的滥用易使病原菌产生抗药性[3-4],还极易造成烟叶农药残留。
木霉菌对多种病原菌具有生防作用[5-8],且对植物具有促生作用[9-10]、对土壤具有改良作用[11-14]。黄艳青等[15]研究表明,木霉菌可诱导甜瓜抗枯萎病相关防御反应酶系,增强甜瓜对枯萎病的抗性;采用木霉菌拌种能够显著增加小麦根基土壤中真菌群落的丰富度,使真菌群落的优势度发生明显改变[16-17],根际土壤中病原真菌的比例显著降低[17-18]。但关于哈茨木霉菌诱导植物产生抗病防御反应及对病原菌产生拮抗作用的作用机理尚未见报道,因此,本试验以烟草栽培品种NC89为试验材料,通过超高效液相色谱与质谱联用(liquid chromatography-mass spectrometer,LC/MS)技术分析接种哈茨木霉菌前后NC89对烟草疫霉菌的抗性差异及代谢通路的变化,对比差异代谢物和代谢途径,深入研究哈茨木霉菌诱导提高NC89对烟草疫霉菌抗性的作用机理,为利用哈茨木霉菌防治烟草疫霉菌提供理论依据。
1 材料与方法
1.1 试验材料
试验于2020年10月在河南农业大学毛庄科教园区及烟草育种实验室进行。选取烤烟品种NC89为试验材料,由河南农业大学烟草育种实验室提供。烟草疫霉菌1号菌株由河南许昌烟草研究院分离提供。哈茨木霉菌制剂购自美国拜沃股份有限公司,有效成分含量为3×108CFU·g-1。
1.2 试验方法
1.2.1哈茨木霉带菌培养基质的培养 将培养基质(丹麦品氏0~10 mm泥炭土基质)与蛭石以10∶1的质量比混合均匀后,经121 ℃、30 min灭菌,待其充分冷却后制成无菌混合基质。按照无菌混合基质与哈茨木霉菌制剂以200∶1的质量比混合均匀后,用无菌水翻拌至湿润状态,封口置于25 ℃避光培养3 d,用以活化哈茨木霉菌。另制备未接种哈茨木霉菌的无菌混合基质备用。
1.2.2烟草疫霉菌株的活化与菌谷的制备 将保存的烟草疫霉菌接种至燕麦固体培养基,置于28 ℃生化培养箱中黑暗培养5 d活化[1]。在超净工作台中,将活化后的烟草疫霉菌沿菌落边缘用直径为5 mm的无菌打孔器打孔,并将打制的菌饼转接至装有小米培养基的接种袋中,每150 g灭菌小米培养基接种6个菌饼,摇匀,使菌饼在培养基中均匀分布(避免菌饼粘连在接种袋上)后,将接种袋封口置于28 ℃生化培养箱黑暗培养15 d至形成菌谷[19]。期间每日需要将小米摇散,避免因菌丝生长造成小米结块。
1.2.3试验设计 在河南农业大学科教园区将NC89包衣种子(包衣丸化使用的包衣料中主要成分是凹凸棒粉及滑石粉等惰性材料,其余辅料为粘合剂和染料等)均匀播种于50孔穴盘(无菌基质)中进行标准化育苗。成苗后,选取健壮且生长势均匀的烟草幼苗连其根部土壤一同移入装有相应培养基质(200 g)的塑料盆中(直径9 cm、高8 cm),移栽过程中应避免伤害到烟苗根部。培养基质共设置4个处理:①无菌基质 (NC89CK);②无菌基质,然后将制备好的烟草疫霉菌菌谷以0.5 g·株-1的比例轻埋于紧贴烟苗根部侧面深1 cm处,表面仍以无菌土覆盖,避免病原物逸散(NC89_P);③混合了哈茨木霉菌株的无菌基质(NC89_T);④无菌基质混合哈茨木霉菌株后,将制备好的烟草疫霉菌菌谷以0.5 g·株-1的比例轻埋于紧贴烟苗根部侧面深1 cm处,表面以混合了哈茨木霉菌的基质覆盖(NC89_T_P)。所有处理均以无菌水保湿,置于28 ℃的人工气候室中保湿培养。每个处理3次重复,每个重复10株,即每个处理30株烟苗。NC89_P和NC89_T_P处理接种烟草疫霉菌后,于开始发病时,按照烟草病虫害分级及调查方法(GB/T23222—2008规定)调查烟苗的发病情况,计算发病率和病情指数(disease index,DI)。
发病率=每个处理发病的株数/该处理总株数×100%
(1)
病情指数(DI)=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100
(2)
依据烟草品种抗病性鉴定标准(GB/T 23224—2008)将抗性分为六级:高抗或免疫(immune,I):DI=0;抗病(resistant,R):DI<20;中抗(middle resistant,MR):20≤DI<40;中感(middle susceptible,MS):40≤DI<60;感病(susceptible,S):60≤DI<80;高感(high susceptible,HS):80≤DI≤100。
1.3 LC/MS分析
将4个处理组的烟苗分别拔出,将根部用清水冲洗干净,用无菌剪刀将根茎交接处剪下,快速置于液氮中保存备用。其中,取一部分用干冰封存寄送至武汉金开瑞生物工程有限公司进行非靶向代谢组学分析。
1.3.1LC/MS前处理 每个处理取100 mg研磨好的根茎交接处组织样本置于EP管中,并加入500 μL 80%甲醇水溶液,漩涡震荡使其充分溶解,冰浴静置5 min使蛋白析出后,4 ℃ 15 000 r·min-1离心20 min;然后取一定量的上清液加入适量质谱级水稀释至甲醇含量为53%(以达到上机要求),4 ℃ 15 000 r·min-1离心20 min,收集上清液,于-80 ℃条件下保存,用于LC/MS分析。
1.3.2LC/MS分析和数据预处理 将经过前处理的样本采用Thermo Fisher 的Vanquish UHPLC色谱仪与Hypesil Gold column (100 mm×2.1 mm, 1.9 μm)色谱柱,色谱仪的设置参照Want等[20]的方法进行,色谱梯度洗脱程序见表1。
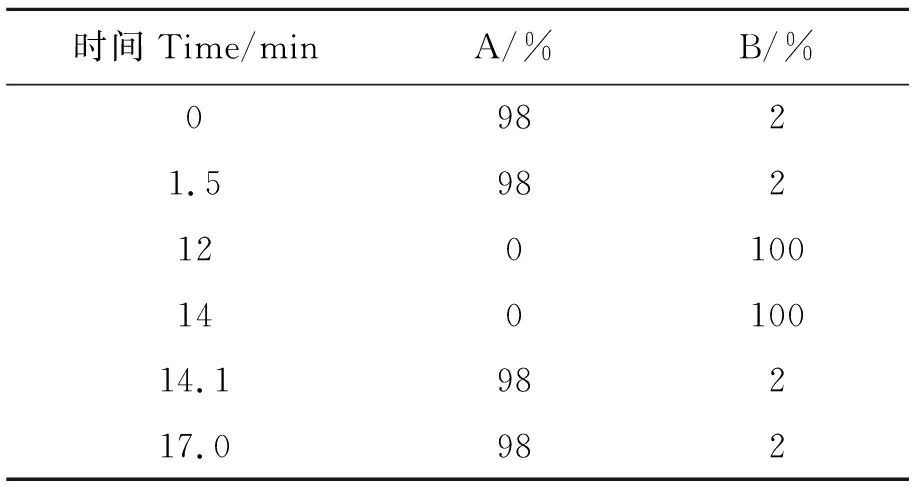
表1 洗脱梯度Table 1 Elution gradient
采用Thermo Fisher 的Q ExactiveTMHF质谱仪。质谱仪设置参照Boulesteix等[21]的方法进行。样品质谱信号采集分别采用正、负离子扫描模式。
质控(quality control,QC)样本由所有实验样本等体积混合制成,每个质控样本的体积和分析方法与供试样本完全相同。在整个分析过程中,每10个分析样本中插入一个质控样本,用于检测试验过程的可靠性。
1.3.3数据分析 将质谱分析得到的原始文件(.raw)导入Compound Discoverer 3.1软件,对LC/MS上机检测的结果进行谱图处理及数据库搜库,得到初步的代谢物定性定量结果,然后对数据进行质控,以保证数据结果的准确度和可靠性。接下来对代谢物进行多元统计分析,通过主成分分析反映组间样本的总体代谢差异;由监督的偏最小二乘法判别分析(PLS-DA)反映组内样本之间的变异度大小。最后,通过代谢通路综合差异代谢物分析解释代谢物的生物学意义。
2 结果与分析
2.1 NC89不同处理对接种烟草疫霉菌后发病的影响
以NC89CK和NC89_T为对照,接种烟草疫霉菌6 d后,NC89_P开始发病(表2);接种哈茨木霉菌的NC89_T_P处理病情指数显著低于未接种哈茨木霉菌的NC89_P,这表明哈茨木霉菌能有效提高NC89对烟草疫霉菌的抗性。
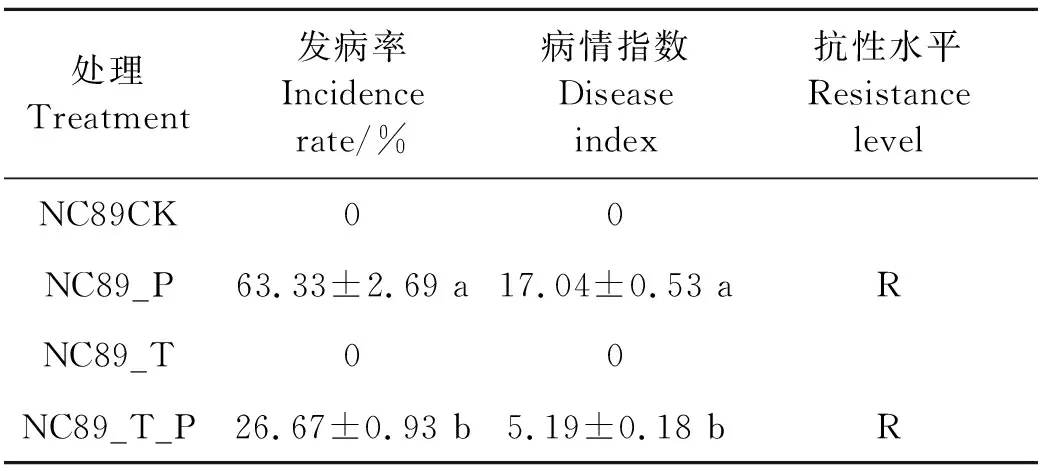
表2 不同处理接种烟草疫霉菌后的发病情况Table 2 Incidence of tobacco in different treatments inoculated with Phytophthora nicotianae
2.2 NC89各处理根茎部样品的LC/MS分析和数据预处理
正、负离子模式下NC89CK、NC89_P、NC89_T及NC89_T_P根茎部典型的基峰离子流图显示,原始质普数据经处理后,正离子模式下检测到810个代谢物(图1),负离子模式下检测到402个代谢物(由保留时间和质核比值组成的数据对表示)(图2)。
2.3 NC89各处理诱导差异代谢产物的鉴定
正、负离子模式下NC89_P和NC89CK及NC89_T_P和NC89_T的主成分分析结果(图3)表明,不同处理间存在显著差异。建立两个比较组的PLS-DA模型(模型的解释率用R2Y表示,模型的预测能力以Q2Y评价,当R2Y大于Q2Y时,认为模型建立良好),经七次循环交互验证(7-fold cross-validation)得到模型评价参数R2和Q2, R2和Q2越接近1.00,表明模型越可靠。此外,为防止模型“过拟合”,对该模型进行200次样品的分组标记、随机打乱、再次建模和预测过程,期间每次建模对应的R2和Q2值可以得到一条回归线,若模型未“过拟合”,该回归线为R2数据大于Q2数据,且Q2回归线与Y轴截距小于0[21]。对模型质量进行判别(图4和5),处理组和对照组的总体分布趋势较稳定且趋势明显,模型的解释率和预测能力较好,模型质量较高。“过拟合”验证表明:所得参数R2Y大于Q2Y(图4),且Q2回归线与Y轴截距小于0(图5),表明该模型未“过拟合”,能够有效用于对照组和处理组间的最大差异对比,因此适合进行后续分析。
2.4 不同处理间差异代谢物的鉴定
如表3所示,NC89CK与NC89_P相比,正离子模式下共筛选出188个差异代谢物,其中上调的有114个,下调的有74个;负离子模式下共筛选出120个差异代谢物,其中上调的有77个,下调的有43个。NC89_T_P与NC89_P相比,正离子模式下共筛选出的390个差异代谢物,其中上调的有215个,下调的有175个;负离子模式下共筛选出195个差异代谢物,其中上调的有121个,下调的有74个。将PLS-DA模型中VIP值大于1.40的化合物,初步认定为差异达到显著的化合物。对接种烟草疫霉菌前后差异代谢物含量的变化倍数进行比对分析(表4和5)发现,差异代谢物主要包括生物碱类化合物、黄酮及类黄酮、脂肪酸及其衍生物、苯丙烷类化合物、水杨酸、甜菜碱、萜类和泛酸等化合物,这些物质可能参与烟草对疫霉菌的抗性反应,以及哈茨木霉菌对烟草疫霉菌抗性反应的调控。此外,比较倍数变化值表明,接种哈茨木霉菌后,NC89中对烟草疫霉菌抗病反应的代谢产物含量明显提高,由此说明,哈茨木霉菌有利于提高NC89的代谢水平。
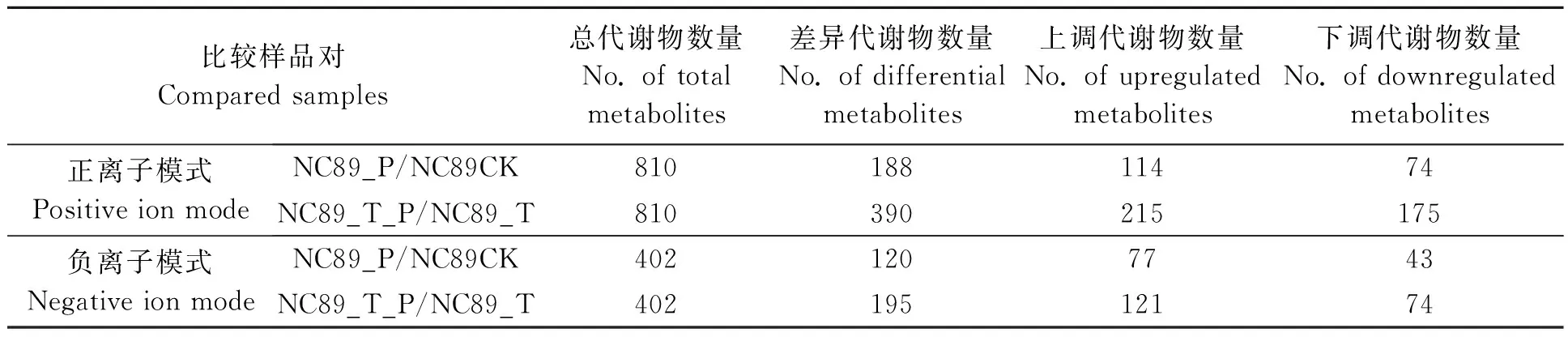
表3 差异代谢物的筛选Table 3 Screening of differential metabolites
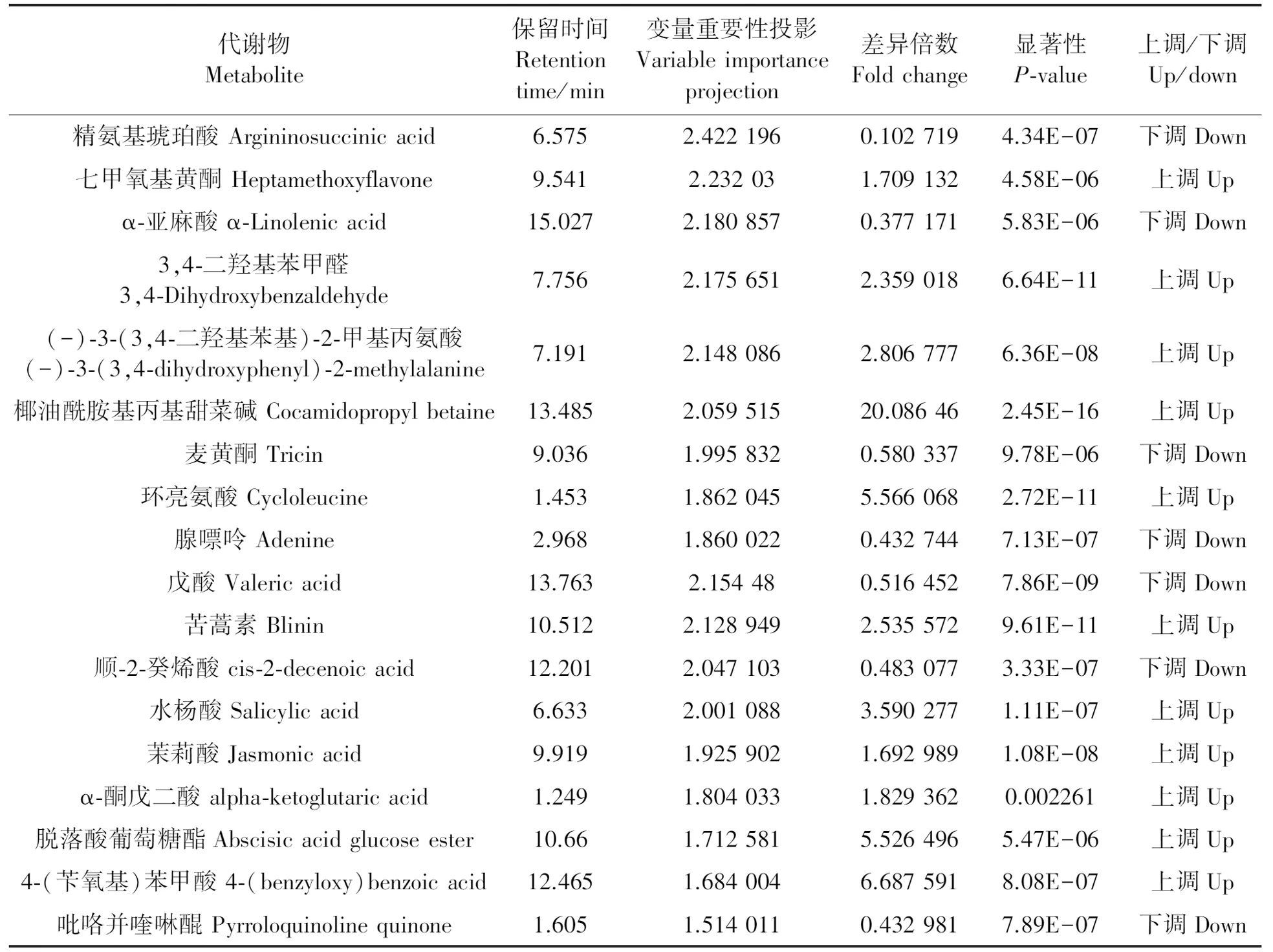
表4 NC89_P 与 NC89CK重要差异代谢物Table 4 Important differential metabolite between NC89_P and NC89CK

表5 NC89_T_P 与NC89_T重要差异代谢物Table 5 Important differential metabolite between NC89_T_P and NC89_T
2.5 差异代谢物的代谢通路分析(基于KEGG数据库)
通过富集代谢通路分析能确定差异代谢物参与的主要生化代谢途径及信号转导途径,从而解释代谢物在代谢通路中的生物学意义。用超几何检验公式[22]对NC89接种哈茨木霉菌前后抗烟草疫霉菌代谢途径中的差异代谢通路进行分析,并与所有鉴定的代谢物背景相比,得到差异代谢物富集的代谢通路或代谢途径(表6和7),并根据对比的富集结果,绘制KEGG富集气泡图(图6)。结果表明,接种哈茨木霉菌前后,NC89抗烟草疫霉菌共有的差异代谢产物主要包括脂肪酸和氨基酸类。接种哈茨木霉菌前,NC89抗烟草疫霉菌共有的代谢通路有27条,抗病相关通路为20条。接种哈茨木霉菌后,NC89抗烟草疫霉菌特有的代谢途径为:不饱和脂肪酸代谢、苯丙恶唑类化合物代谢、磷脂酰肌醇信号系统、单萜及二萜类生物合成、黄酮和类黄酮的生物合成以及亚油酸代谢、丙酮酸代谢、抗坏血酸代谢、烟酸代谢和个别氨基酸代谢。由此表明, NC89接种哈茨木霉菌后,对烟草疫霉菌的抗病响应在代谢水平发生变化,从而导致NC89对烟草疫霉菌的抗性增强。此外,研究NC89对烟草疫霉菌的抗病代谢通路发现,NC89主要通过苯丙烷类植保素、萜烯类植保素、不饱和脂肪酸及抗坏血酸和过氧化物的清除等途径来抵抗烟草疫霉菌的侵染。哈茨木霉菌还引起了氮素代谢、碳代谢和戊糖磷酸途径等基础调控代谢的差异,说明哈茨木霉菌对烟草产生了一定的促生作用。
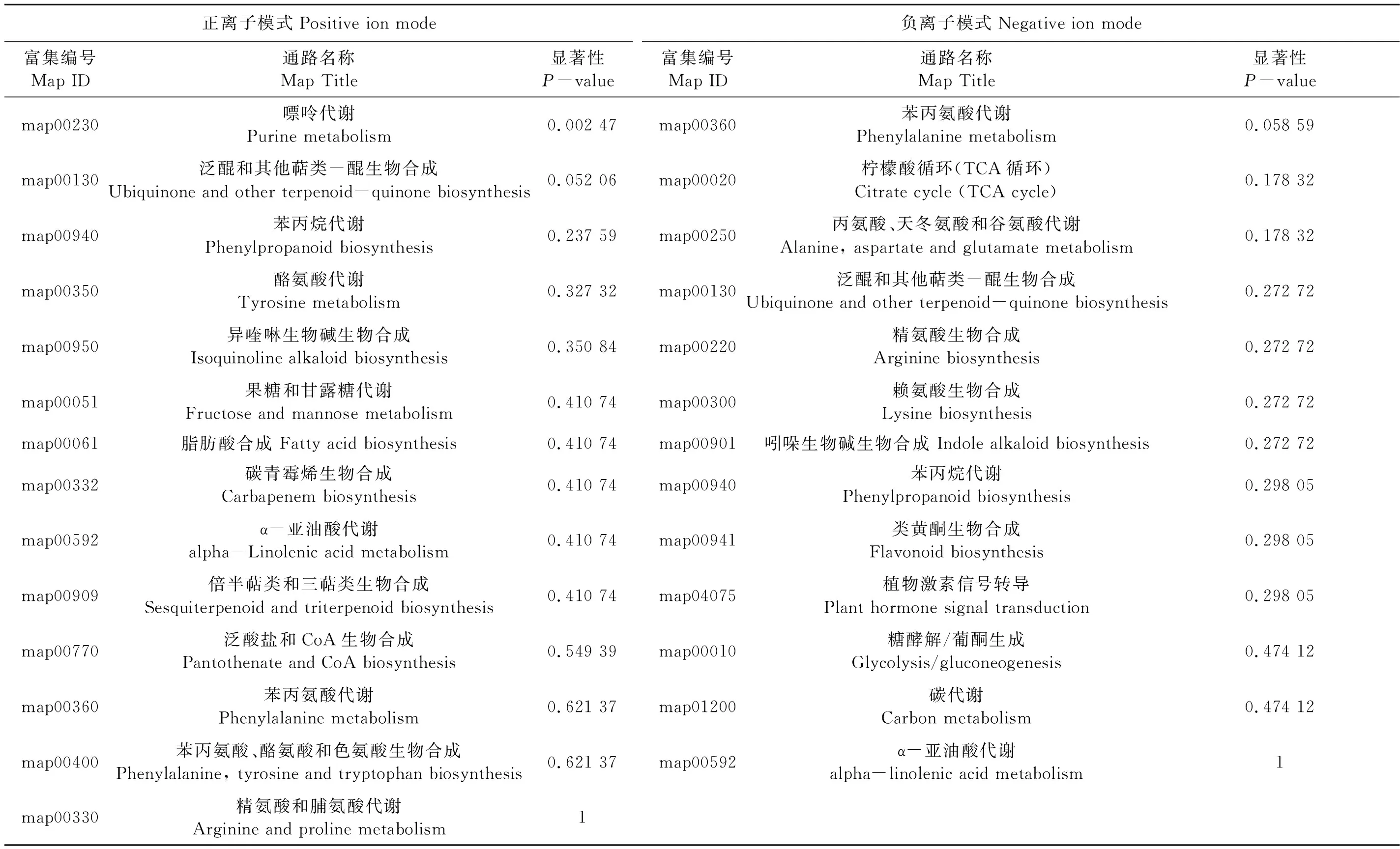
表6 NC89_P和NC89CK差异代谢通路富集Table 6 NC89_P VS NC89CK differential metabolic pathway enrichment
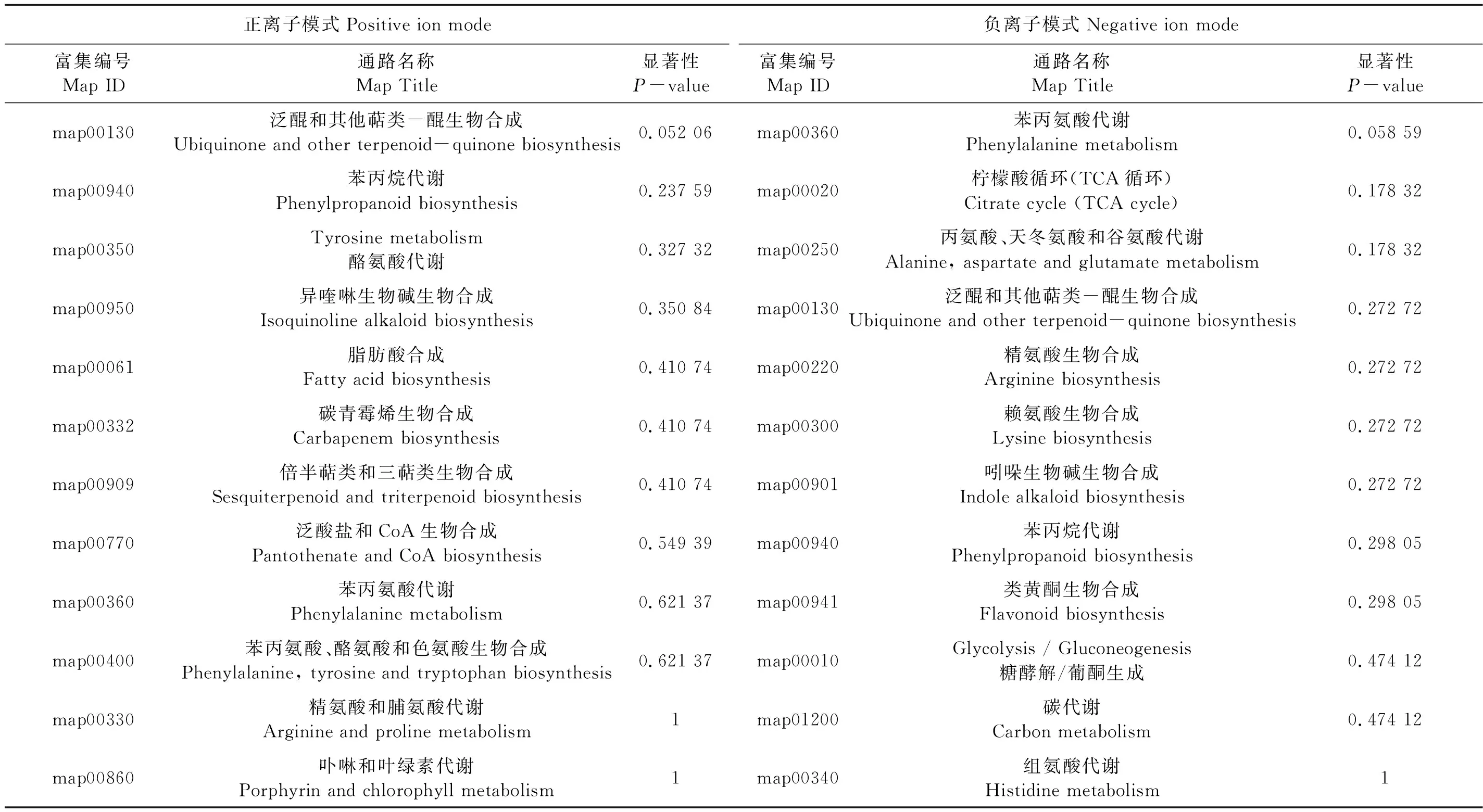
表7 NC89_T_P和NC89_T差异代谢通路富集Table 7 NC89_T_P VS NC89_T differential metabolic pathway enrichment
3 讨论
本试验以对烟草疫霉菌有一定抗性的NC89为试验材料,利用LC/MS技术探究添加哈茨木霉菌前后NC89对烟草疫霉菌抗病过程中根茎部位在代谢水平产生的变化。PLS-DA分析发现,不同处理间有明显的分离趋势,结合差异代谢物及富集通路表明,接种哈茨木霉菌后,提高了NC89对烟草疫霉菌的抗性。分析原因可能是大量抗病相关代谢物含量发生变化有助于NC89抵抗烟草疫霉菌的侵染[23-28],如生物碱类物质[28-30]、脂肪酸及其衍生物[23]、类黄酮[31]、水杨酸[32-36]、单萜及二萜[37]和泛酸[30]等。此外,接种哈茨木霉菌后还检测到了磷酸肌醇[26]及苯并恶唑嗪酮[24]等代谢物。脂肪酸及其衍生物对植物抗病信号传导具有重要作用。研究表明,甘油-3-磷酸(G3P)可诱导拟南芥(Arabidopsisthaliana)对炭疽病菌(Colletotrichumhigginsianum) 产生基础抗性[26]。植物角质层主要由脂肪酸及其衍生物构成,高度疏水的结构可有效保护植物内部组织免受细菌和真菌等病原体的侵染[23,26]。油酸(C18∶1)和亚油酸(C18∶2)能够诱导蛋白激酶C介导的烟酰胺腺嘌呤二核苷磷酸(NAD-PH)氧化酶的活化,从而诱导植物活性氧(reactive oxygen species,ROS)的产生[23]。此外,茉莉酸等脂肪酸衍生物对植物应对机械损伤、提高植物抗病性具有重要作用[32-33];丙酮酸积累是消除ROS的第一道防线;脯氨酸可清除植物在逆境胁迫下由于代谢不平衡而积累的活性氧[38];类黄酮和萜类与植物的抗病性密切相关[31,37];泛醌和其他萜类醌的生物合成途径中,致病疫霉释放的RXLR-effector AVR3a以宿主U-box泛素连接酶CMP G1为底物,通过宿主马铃薯U-box泛素连接酶StCMPG1的自泛素化反应,诱发细胞死亡[30]。
本研究对比差异代谢通路发现,氮和硫代谢也存在显著差异,可能是由于接种哈茨木霉菌对烟草产生了一定的促生作用,与前人研究结果相一致[11,39]。接种哈茨木霉菌会引起烟草对疫霉菌免疫应答过程中代谢物发生变化。结合差异代谢物与富集通路显示,接种哈茨木霉菌后,脂肪酸及其衍生物代谢途径、苯丙氨酸代谢途径及氨基酸代谢途径均检测到显著差异。差异代谢物中,赖氨酸、色氨酸和脯氨酸等不仅是生物碱合成途径的起始物质,同时还参与了对烟草疫霉菌免疫应答反应中苯丙烷类木质素和生物碱等抗病相关物质及其次生代谢产物的合成;脂肪酸及其代谢产物参与植物内源激素如茉莉酸的合成途径。研究表明,植物内源激素作为诱导植物相关防卫基因表达的信号分子,其本身也参与对病原物的免疫应答反应[32]。此外,脱落酸与植物抗逆作用相关,外源施加脱落酸可诱导茉莉酸的合成,二者在植物体内的信号转导过程也存在一定联系[40];水杨酸在植物遭遇外界伤害时,可抑制茉莉酸等物质的合成及其所诱导基因的表达,而茉莉酸能阻止病原菌侵染后造成的水杨酸累积,从而表现出一种拮抗作用[32-33]。不仅如此,脱落酸与水杨酸复合处理,能提高植物对温度胁迫的抵抗能力[34-36]。接种哈茨木霉菌后,NC89的茉莉酸代谢显著上调,这些内源性植物激素的相互协同或拮抗作用达到了一种动态平衡,显著提高了NC89对烟草疫霉菌的抗性。
通过代谢组学分析,有利于对哈茨木霉菌诱导抗性提升的抗病机理进行解析。哈茨木霉菌可诱导烟草植株在受到病害胁迫时激活抗病相关的代谢通路,产生抗病相关代谢物——包括直接代谢产物和次生代谢产物,这些产物直接或间接的增强了植物的抗病性。此外,结合基因组学和蛋白组学,还能找到哈茨木霉菌诱导烟草产生的激素代谢及信号传导相关基因的表达差异,有利于深入研究哈茨木霉菌对烟草疫霉菌的生防机理。

