模拟海水环境中8-羟基喹啉对B10铜合金 的缓蚀行为研究
张先勇,陆忠海,刘杰,李传鹏
(1.西南技术工程研究所 国防科技工业自然环境试验研究中心,重庆 400039; 2.烟台大学 化学化工学院,山东 烟台 264005)
铜合金由于具有较高的电极电位、较好的热传导性、良好的加工性以及便于开采和利用等优点,在微电子、军事及民用领域得到了普遍应用和发展[1-7]。与一些常用的金属相比,铜合金具有相对优异的耐腐蚀性,但在许多环境(如潮湿环境以及含氯介质溶液)中,铜合金依然容易受到环境侵蚀[8-10]。与电化学保护、涂层防护和氧化处理等腐蚀防护措施相比,添加缓蚀剂具有使用范围广、少量高效、操作简单、成本低、对金属基体腐蚀小等优势,因此添加合适的缓蚀剂已成为常见的防腐蚀措施之一。8-羟基喹啉(8-HQ)作为一种绿色、价廉的高效缓蚀剂,已在铜及铜合金的腐蚀防护中被广泛应用[11]。张大全等[12]采用失重法和电化学方法研究了苯并三氮唑(BTA)和8-HQ在3% NaCl溶液中对铜的缓蚀协同作用,发现8-HQ可以和Cu2+形成[Cu(Ⅱ)HQ] 络合膜,补充在[Cu(Ⅰ) BTA]膜的缺陷处,从而形成完整致密的保护膜,增强对铜的保护作用。贺甜等[13]采用循环伏安曲线、极化曲线和交流阻抗谱研究了铜经2-巯基苯并噻唑(MBT)和8-HQ钝化处理后在3.5% NaCl溶液中的电化学行为。结果发现,MBT或8-HQ在铜表面形成的络合物膜能明显改善铜在3.5% NaCl溶液中的耐蚀能力,而8-HQ与MBT之间由于协同作用,经8-HQ与MBT复配液处理后,电荷转移电阻显著增大,铜的耐蚀能力进一步提高。Cicileo等[14]研究了8-HQ在中性NaCl水溶液中对铜的腐蚀抑制作用,对Cu表面进行了XPS、FTIRS和SEM-EDX等测试分析,并评估了其相对抑制效率。结果表明,铜表面被保护膜覆盖,该保护膜由Cu(II)-抑制剂配合物聚合物层形成。目前,大多数研究主要集中于酸性介质中8-HQ对铜合金的缓蚀作用,而关于中性介质中8-HQ对铜合金的缓蚀行为研究较少,其缓蚀机理需要进一步研究。
文中以8-HQ和B10铜合金为研究对象,研究了不同浓度8-HQ在1 mol/L NaCl溶液中对铜合金的缓蚀效果,以获得对铜合金的最佳缓蚀剂浓度。同时,探究最佳缓蚀剂浓度下8-HQ对铜合金在1 mol/L NaCl溶液中的作用时效,并分析了铜合金表面的锈层成分。
1 实验
1.1 样品制备
本实验所使用的试样为B10铜合金。将铜板试样一侧用铜导线焊接引出,用AB胶水对焊接部分的四周进行涂封,其余暴露的部分浸泡在电解质溶液中。经测量,该区域四周的总面积为31.26 cm²,如图1所示。电极工作面分别用400#、800#水磨砂纸逐级打磨,然后依次用去离子水清洗、无水乙醇脱脂,再用吹风机吹干备用。B10铜合金的化学成分见表1。
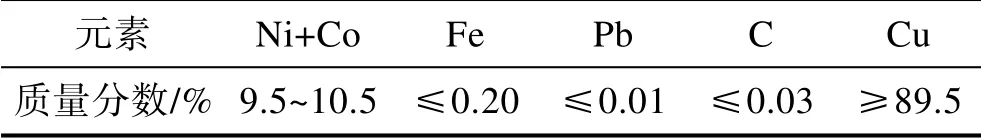
表1 B10铜合金的化学组成 Tab.1 Chemical composition of B10 copper alloy

图1 B10铜合金试样照片 Fig.1 Photo of B10 copper alloy samples
1.2 腐蚀溶液配制
腐蚀溶液共分为5组,各组溶液组成见表2。

表2 不同浓度8-HQ的腐蚀溶液 Tab.2 Corrosion solutions with different concentrations of 8-HQ
1.3 电化学测试
将铜合金试样浸泡于腐蚀溶液(恒温水浴25 ℃)30 min后,采用CS310电化学测试系统进行EIS测试,正弦波信号幅值为5 mV,测试频率范围是105~ 10–2Hz。电化学测试采用经典的三电极体系,辅助电极为直径5 mm铂铌丝,饱和甘汞电极(SCE)作为参比电极,裸露的B10铜合金为工作电极。采用ZSimpWin 3.60对EIS数据进行处理。在动电位极化曲线测量时,扫描速度为1 mV/s,扫描范围为–0.3~ 0.3 V(相对于开路电位)。
1.4 失重实验
将配制好的腐蚀溶液分别倒入250 mL烧杯中,每组溶液中放置3个平行样。将处理好的B10铜合金试样称量并标记后,分别浸入烧杯中,浸入时试样上端距离液面不小于5 cm,浸泡的工作面积为38.70 cm²,然后将烧杯放置在25 ℃的恒温水浴锅中。浸泡72 h后,将铜合金试样取出除锈,先用硬毛刷刷掉疏松的锈层,然后用除锈液(由100 mL 1∶1的HCl+5 g 1,3-二丁基硫脲按配制而成)浸泡5 min,除去内锈层。将铜合金用蒸馏水和无水乙醇清洗干净,放入干燥器中干燥24 h后,称量。
1.5 红外光谱分析
采用Frontier型(PerkinElmer,美国)傅里叶变换红外光谱仪对铜合金锈层进行红外光谱(FT-IR)测试,其扫描范围为450~4000 cm–1,设定扫描次数为32次,实际分辨率为4 cm–1。
2 结果与讨论
2.1 不同浓度8-HQ对铜合金的缓蚀效果分析
2.1.1 极化曲线分析
铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中的极化曲线如图2所示。由图2可知,与空白组相比,添加8-HQ后,铜合金的阴极极化电流变小,阳极极化电流增大,腐蚀电流下降,腐蚀电位负移。极化曲线拟合结果见表3,其中,J为腐蚀电流密度,E为腐蚀电位,ba和bc分别为腐蚀的阳、阴极塔菲尔斜率,η为缓蚀效率,可按式(1)进行计算[15]:

表3 极化曲线拟合结果 Tab.3 Fitting results of polarization curve
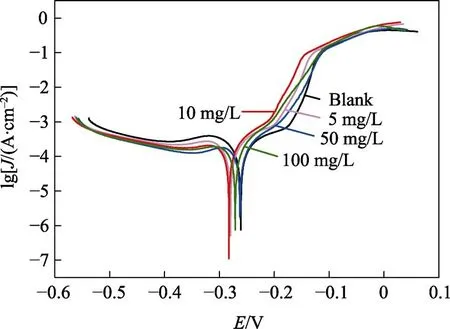
图2 铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中的极化曲线 Fig.2 Polarization curves of copper alloy in 1 mol/L NaCl solution with different concentrations of 8-HQ

式中:J0和J分别为铜合金在空白溶液和添加有缓蚀剂的溶液中的腐蚀电流密度。
由表3可知,与空白组相比,添加8-HQ后,铜合金的电位均发生负移,腐蚀电流下降,因此可以认为,8-HQ属于适度的“阴极型缓蚀剂”[12,16]。同时,与空白组相比,阴极塔菲尔斜率比阳极下降更明显,这说明该缓蚀剂对阴极反应的抑制作用较强。随着缓蚀剂浓度的增加,铜合金的腐蚀电流先减小、后增加,腐蚀电位先负移、后正移,缓蚀效率先增加、后下降。在质量浓度为10 mg/L时,缓蚀效率最高,达到37.45%。可以推测,适量的8-HQ可以和Cu2+形成[Cu(Ⅱ)H Q]络合膜,吸附在铜的表面,形成一层保护膜,抑制氧从本体溶液中向阴极移动,从而抑制铜的进一步腐蚀。同时,研究者们发现,在金属腐蚀过程中,8-HQ可以与金属离子螯合(如Cu2+、Fe2+和Mg2+等),形成金属螯合物[17-18],进一步保护金属基底,反应方程式如图3所示。

图3 Cu2+与8-HQ螯合形成Cu(8-HQ)2的反应方程式 Fig.3 The reaction equation of Cu2+ chelating with 8-HQ to form Cu(8-HQ)2
2.1.2 电化学阻抗谱分析
图4为铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中的Nyquist图和Bode图。由图4a可知,未添加缓蚀剂8-HQ时,Nyquist图在高频区表现出一个单容抗弧,在低频区表现出一条偏离45°的扩散尾。可采用图5a中的等效电路进行拟合,其中Rs为溶液电阻,Rct为电荷转移电阻,CPEdl为双电层电容,W为Warburg阻抗。此外,拟合后的相关参数见表4。与高频端所对应的时间常数来自于双电层电容和电荷转移电阻的贡献,而低频端中Warburg阻抗的出现与CuCl2的扩散有关[19]。在Cl-存在的条件下,铜的阳极溶解可能存在以下3种反应情况[20-24]:
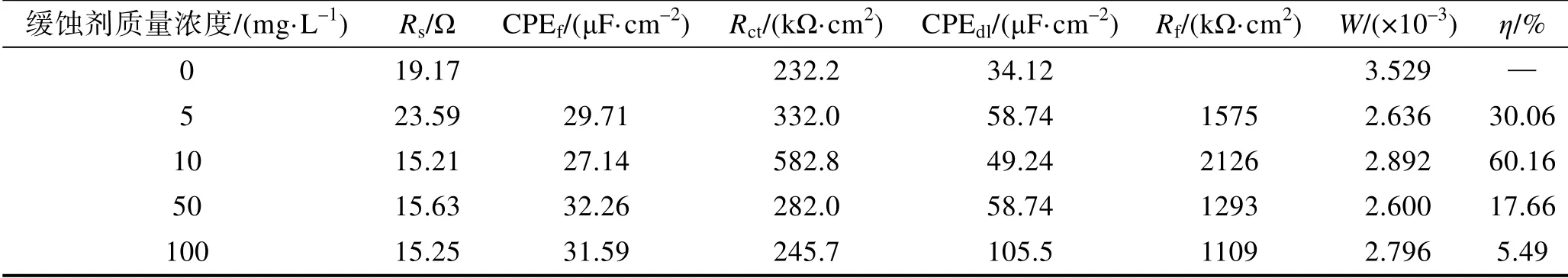
表4 铜在添加不同缓蚀剂浓度的1 mol/L的NaCl溶液中EIS曲线的拟合参数与缓释效率 Tab.4 The fitting parameters of the EIS curve and corrosion inhibition efficiency of copper alloy in 1 mol/L NaCl solution with different concentrations of 8-HQ
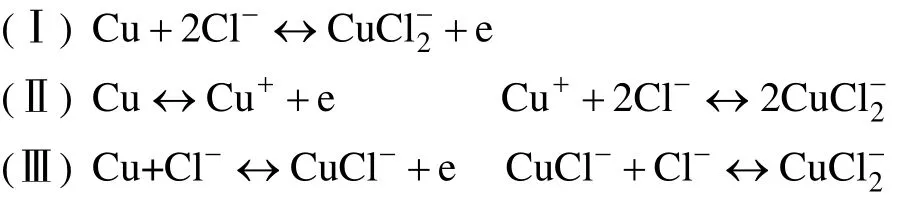
反应(Ⅰ)和(Ⅲ)显示了从Cu直接形成 CuCl-2,而反应II是首先将Cu氧化为Cu+,然后与Cl-反应形成 CuCl-2的过程。而铜在中性NaCl溶液中的阴极还原反应为:O2+2H2O+4e → 4OH-。
添加缓蚀剂8-HQ后,各组溶液的Nyquist图均由一个单容抗弧和一条偏离45°的扩散尾组成,均可采用图5b中的等效电路进行拟合,其中,Rf为膜电阻,CPEf为膜电容。同时,由图4b可知,添加缓蚀剂的铜合金的阻抗模值均大于未添加缓蚀剂的阻抗模值,这说明添加缓蚀剂对铜合金具有一定缓释作用。随着缓蚀剂浓度的增加,容抗弧半径表现为先上升、后下降的趋势。当缓蚀剂浓度为10 mg/L时,铜合金的容抗弧半径最大,对应的阻抗模值最大,该浓度下8-HQ在铜合金表面的吸附作用最强,缓蚀效果最好,这与极化曲线分析结果一致。此外,缓蚀剂的缓蚀效率可采用式(2)计算[25-26]:


图4 铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中的Nyquist图和Bode图 Fig.4 Nyquist plot (a) and Bode plot (b) of copper alloy in 1 mol/L NaCl solution with different concentrations of 8-HQ

图5 铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中的等效电路 Fig.5 Equivalent circuit diagram of copper alloy in 1 mol/L NaCl solution with different concentrations of 8-HQ
式中:R0ct为空白溶液的电荷转移电阻;Rct为添加缓蚀剂时的电荷转移电阻。由表4可知,缓蚀剂的 缓蚀效率随着缓蚀剂浓度的增加表现出先增大、后减小的趋势。当缓蚀剂质量浓度为10 mg/L时,Rct和Rf最大,缓释效率最高,达到了60.16%。这说明该浓度的8-HQ形成了具有保护性的吸附膜,最大程度地减少了铜表面的活性分子,抑制了电极表面的腐蚀,缓蚀效果最好。
2.1.3 失重法
在失重实验中,一般用平均腐蚀深度B(mm/a)来表示金属的腐蚀速率,可按式(3)进行计算。

式中:m1和m2分别为腐蚀前后试样的质量,g;A为试样暴露的表面积,cm2;t为实验周期,h;ρ为试样的密度,g/cm3。
缓蚀剂的缓蚀效率η可按式(4)进行计算。其中,B0、B分别表示空白溶液和添加有缓蚀剂的溶液中试样的腐蚀速率。

铜合金在添加不同浓度8-HQ的1 mol/L NaCl溶液中浸泡72 h后的腐蚀速率和缓释效率见表5。由表5可知,铜合金在NaCl溶液中的腐蚀速率随着缓蚀剂浓度的增加先减小、后增加,缓蚀效率先增加、后减小。当8-HQ的质量浓度为10 mg/L时,缓蚀效果最好。这与极化曲线和电化学阻抗谱的分析结果一致,进一步说明了适量的8-HQ可以抑制铜合金在NaCl溶液中的腐蚀。

表5 铜合金在不同浓度8-HQ溶液中浸泡72 h后的腐蚀速率和缓蚀效率 Tab.5 Corrosion rate and inhibition efficiency of copper alloys immersed in 8-HQ solutions of different concentrations for 72 h
2.2 8-HQ作用时效研究
图6为铜合金在添加10 mg/L 8-HQ的NaCl溶液中浸泡不同时间后的Nyquist图。由图6可知,未添加缓蚀剂时,铜合金的Nyquist图由一个高频单容抗弧和一个低频扩散尾构成,可采用图5a中的等效电路进行拟合,拟合数据见表6。对应的阻抗模值为2.69×103Ω·cm2(见图7a),并且Bode图相位角在测试区间内只有一个最大值,表现为一个时间常数特征,见图7b。当添加10 mg/L 8-HQ缓蚀剂后,在浸泡前72 h,对应的Nyquist图在高频区均表现出一个单容抗弧,在低频区均表现出一条偏离45°的扩散尾。相位角在测试范围内均表现为两个极大值,显示两个时间常数特征。此阶段均可采用图5b的等效电路进行拟合。浸泡96 h后,膜电阻较小,电极表面粗糙,电流分布不均匀,产生了弥散效应[26],并且相位角在测试范围内均表现为两个极大值,显示两个时间常数特征。而此阶段均可采用图5c所示的等效电路模型进行拟合,可得到较好的拟合结果。同时,添加10 mg/L 8-HQ缓蚀剂后,铜合金在浸泡120 h内的阻抗模值均高于未添加缓蚀剂的阻抗模值,说明缓蚀剂的添加对铜合金具有一定缓释作用,并且随着浸泡时间的延长,阻抗模值总体增大。

图7 铜合金在10 mg/L 8-HQ的NaCl溶液中浸泡不同时间后的Bode 图 Fig.7 Bode plot of copper alloy after immersed in NaCl solution with 10 mg/L 8-HQ for different time: a) impedance modulus; b) phase angle
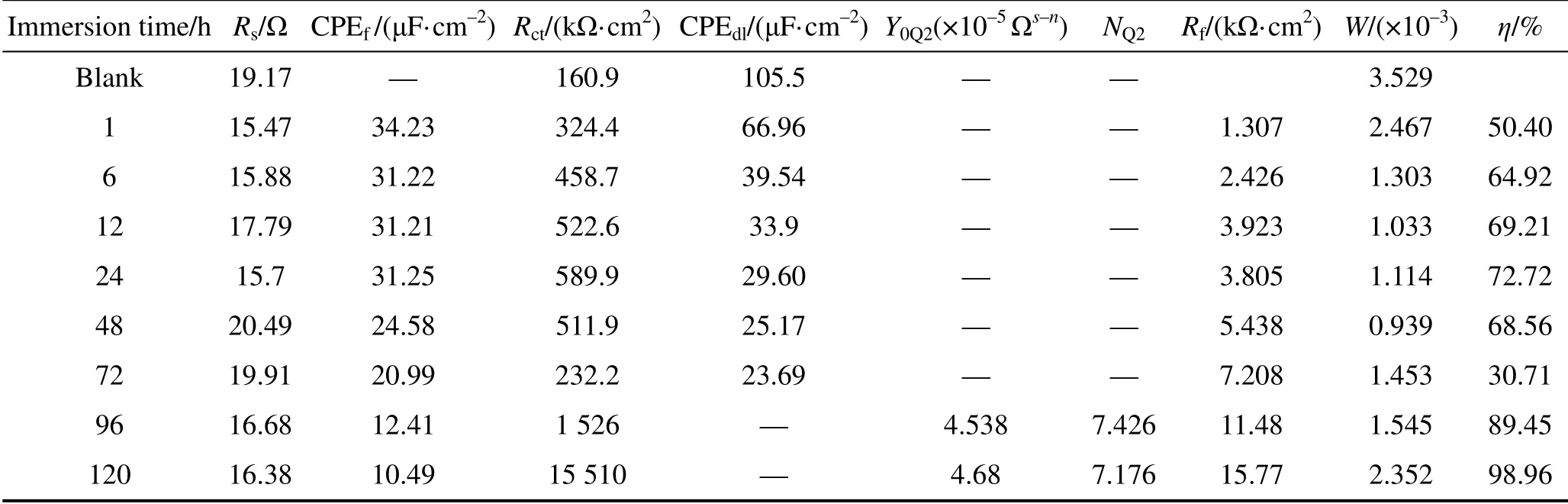
表6 B10铜合金在10 mg/L 8-HQ的NaCl溶液中浸泡不同时间后EIS曲线的拟合参数 Tab.6 Fitting parameters of the EIS curve of B10 copper alloy after immersed in NaCl solution with 10 mg/L 8-HQ for different times
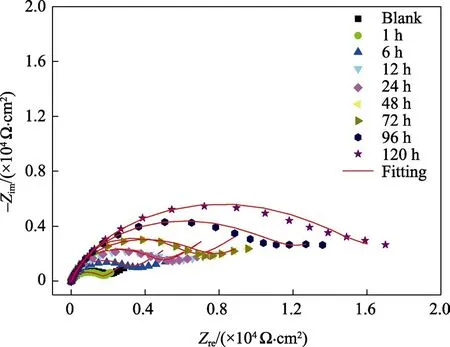
图6 铜合金在10 mg/L 8-HQ的NaCl溶液中浸泡不同时间后的Nyquist图 Fig.6 Nyquist plot of copper alloy after immersed in 10 mg/L 8-HQ NaCl solution for different time
由表6可知,随着浸泡时间的延长,Rct和Rf总体升高,CPEdl不断减小,缓蚀效率虽有波动,但总体趋势是增大的。在浸泡120 h后,8-HQ对B10铜合金的缓蚀效果仍在提升,这可能是因为8-HQ和Cu2+形成的[Cu(Ⅱ)HQ] 络合膜与不断增厚的CuCl2保护膜产生协同作用,二者吸附在铜合金电极表面,从而抑制了电极表面的腐蚀反应。
2.3 红外光谱分析
图8为铜合金在10 mg/L 8-HQ的NaCl溶液中浸泡120 h后锈层的红外光谱图。在该谱图中,3049 cm–1和1224 cm–1处的特征峰分别对应于O—H伸缩振动和O—H弯曲振动[18]。1579 cm–1处的峰是C=N伸缩振动引起的,在1501 cm–1和1470 cm–1处观察到的特征峰对应于芳族C=C的弯曲振动,1381 cm–1和1274 cm–1处分别归因于芳族胺的面内弯曲振动和变形振动[11,27]。1100 cm–1处的峰归因于C—O的伸缩振动,828 cm–1和751 cm–1处的谱带代表芳族C—H键的伸缩振动[28]。在锈层的红外光谱中,发现O—H伸缩振动和O—H弯曲振动的吸收峰随着C8-OH上H原子的去质子化而消失,并且在1274、1579、1093 cm–1的特征峰则分别移到1327、1577、1114 cm–1,这表明8-HQ与Cu2+的配位是通过亚胺基的N原子和C8-OH基团的氧原子发生的[18,29]。此外,结合图3所示的反应能更好地理解锈层Cu(8-HQ)2和8-HQ的FT-IR光谱之间的差异。上述的分析结果表明,8-HQ 可以和Cu2+形成[Cu(Ⅱ)HQ] 络合膜,吸附在铜的表面,形成一层保护膜,减少了铜表面的活性分子,抑制了铜表面的进一步腐蚀。

图8 铜合金在10 mg/L 8-HQ的NaCl溶液中浸泡120 h后锈层的FT-IR光谱 Fig. 8 FT-IR spectrum of the rust layer of copper alloy after immersed in NaCl solution with 10 mg/L 8-HQ for 120 h
3 结论
1)当B10铜合金浸泡在添加有8-HQ的NaCl溶液中时,其自腐蚀电流密度减小,阻抗模值增大。这表明8-HQ减小了B10铜合金在NaCl溶液中的腐蚀速率,这与8-HQ在铜合金表面形成了保护膜,阻止氧从溶液中向阴极区域迁移有关。
2)随着8-HQ浓度的升高,缓蚀效率表现出先升高、后下降的阶段性特征。当8-HQ的质量浓度为10 mg/L时,其对铜合金的缓蚀效果最佳。
3)当铜合金浸泡在10 mg/L 8-HQ的NaCl溶液中时,其耐腐蚀性能持续上升。主要原因是8-HQ和Cu2+形成的[Cu()HQ]Ⅱ 络合膜与不断增厚的CuCl2保护膜产生协同作用,二者吸附在铜合金表面,从而抑制了电极的腐蚀反应。

