高山植物威氏绿绒蒿种子表型及萌发特性研究
左 杰, 张国栋, 李紫倩, 浦 杰, 屈 燕, 区 智
(1.西南林业大学园林园艺学院,国家林业和草原局西南风景园林工程技术研究中心,云南省功能性花卉资源及产业化技术工程研究中心, 昆明 650224;2.大理州云龙县漕涧林场, 云南 大理 672711)
威氏绿绒蒿(MeconopsiswilsoniiGrey-Wilson)是罂粟科(Papaveraceae)绿绒蒿属(Meconopsis)的多年生草本植物,绿绒蒿为绿绒蒿属植物的总称,是云南八大名花之一,被欧洲人称为世界名花,其花朵硕大,花色丰富,具有很高的药用价值,是亟待开发的园林植物与药用植物[1],威氏绿绒蒿花大且多,呈蓝紫色至紫红色,高可达1.5 m,常分布于海拔3 000 m以上区域,属珍稀濒危物种,具有巨大的育种潜力[2]。
目前,有关绿绒蒿无性繁殖研究报道较少,技术尚不成熟,主要靠种子进行繁殖。与植物的其他营养器官相比,种子的发育一直处于相对封闭的环境中,其表面特征受环境影响较小[3],应用体视镜和扫描电镜分别对种子外部形态及种皮的微形态特征进行初步观察研究,旨在丰富、完善对威氏绿绒蒿植物的认识。
种子萌发的程度是影响出苗率的关键因素之一[4],在种子萌发试验之前通过测定种子的生理生化指标以及种子的基本生物学特征,能够更好地判断种子是否具备萌发的潜力。同时,进行种子萌发实验过程中提高种子的萌发率对绿绒蒿属的后续实验研究至关重要,因此迫切需要尽快找到促进绿绒蒿种子萌发的措施。植物激素对植物的生长发育有着重要作用,适宜种类与适宜浓度的激素可有效促进植物种子的萌发[5]。近年来,关于植物外源激素对种子萌发影响的研究很多,但对于不同种类外源激素处理威氏绿绒蒿种子萌发的研究鲜有报道。本实验通过对种子表型特征、生理特性及不同浓度GA3、6-BA、NAA、SA对威氏绿绒蒿种子萌发的影响进行初步研究,以期找到适宜的激素及其浓度促进威氏绿绒蒿种子萌发,为威氏绿绒蒿引种驯化和播种栽培提供理论和实践指导。
1 材料与方法
1.1 试验材料
威氏绿绒蒿种子于2019年9月22日采自云南轿子雪山(海拔4 344.1 m,102°48′49″~102°58′50″E,26°00′23″~26°10′20″N),采后放置阴凉通风处自然干燥,储存于4 ℃冰箱备用。
1.2 试验方法
1.2.1种子基本生物学特性
种子大小、千粒重测定:选用发育良好的成熟种子,分别置于体视显微镜和扫描电镜下观察,拍照。
种子含水量测定:称取1 g种子,放入80 ℃烘箱,每隔12 h称量并记录种子的质量,直到称重样品3次恒重为止。设3组重复,计算含水量,结果取平均值。
含水量(%)=[(样品烘前质量-样品烘后质量)/样品烘前质量]×100%;
种子吸水率测定:随机选取3 000粒种子,分为3组,用电子天平称重后放置于2 mL离心管,加纯水反复震荡后静置,分别于吸水2、4、6、8、10、12、14、16、18、20、22、24 h时取出种子,用吸水纸擦干种子表面水分并称量,计算平均值。
吸水率(%)=[(浸种后重量-浸种前重量)/浸种前重量]×100%。
1.2.2种子生理指标的测定
在进行种子萌发实验之前测定种子的生理生化指标。MDA含量、可溶性蛋白含量、SOD活性、CAT活性和POD活性的测定均参照李合生[6]的实验方法,稍有改动。
1.2.3种子萌发试验
随机选取2 520粒威氏绿绒蒿种子,放入装有1%的过氧化氢溶液的2 mL离心管中消毒30 s,用蒸馏水洗净残余过氧化氢。用4种激素进行处理,每种激素分别设置7个不同浓度(ck为0 mg·L-1处理)(表1),每个处理3次重复,每重复30粒种子。用相应激素处理浸种24 h,在垫有湿润滤纸的玻璃培养皿中播种,播种后放入20 ℃、光照12 h·d-1、湿度70%的培养箱中培养(前48 h做暗处理)。
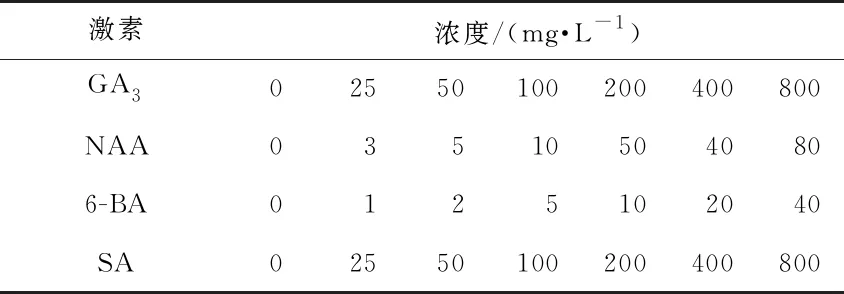
表1 不同激素及其浓度设置
每天定时统计种子萌发情况,以胚根伸出种子长度等于种子长度的1/2视为萌发。测定指标包括:发芽率、发芽势、发芽指数、平均发芽时间、发芽启动时间。
1.3 数据处理
图表绘制软件为Oringin Pro 9.0,显著性差异分析软件为SPSS 25。
2 结果与分析
2.1 威氏绿绒蒿种子表型特征
电镜及体视镜观察,威氏绿绒蒿成熟种子近肾形,种子干燥后种皮黑褐色,具有较深的、蜂窝状孔的凹陷和短条纹状、近网状皱褶。经测量,威氏绿绒蒿的种子长度为(1.19±0.11)mm,宽度为(0.73±0.12)mm;种子千粒重为(0.31±0.01)g,属于小型种子;含水量为(8.74±0.2)%(图1)。
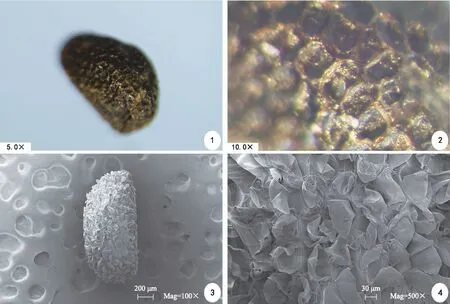
注:体视镜下种子形态(1)、(2);扫描电镜下种子形态(3)、(4)。
2.2 威氏绿绒蒿种子吸水规律
由图2可知,随着纯水浸种时间的延长,威氏绿绒蒿种子吸水速度先快后慢,呈现出3个阶段,在0~2 h为急剧吸水阶段,吸水率从0上升到36.7%,平均每小时吸水速率为18.35%。在2~12 h为缓慢吸水阶段,吸水率从36.7%上升到最大值70.07%,平均吸水速率为3.34%。12~24 h为饱和吸水阶段,吸水率维持动态恒定。
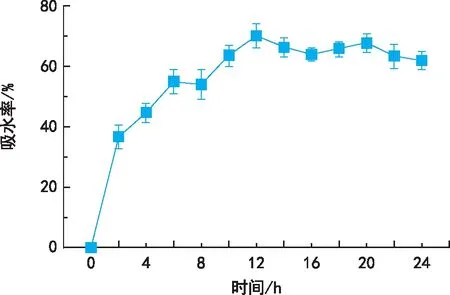
图2 威氏绿绒蒿种子吸水率随吸水时间变化规律
2.3 威氏绿绒蒿种子生理特性
经测定,未经激素处理的威氏绿绒蒿种子中丙二醛含量为(5.10±0.81)mmol·g-1;可溶性蛋白含量为(46.37±0.67)mg·g-1;超氧化物歧化酶活性为(559.33±17.80)U·g-1;过氧化物酶活性为(83.33±22.68)U·g-1;过氧化氢酶含量为(2 777.78±444.88)U·g-1。
2.4 不同浓度GA3对威氏绿绒蒿种子萌发的影响
由图3可知,100 mg·L-1、200 mg·L-1、800 mg·L-1GA3处理均能提高威氏绿绒蒿种子的发芽率,当GA3浓度为800 mg·L-1时促进种子萌发的效果最显著(p<0.05)。当GA3浓度在200~800 mg·L-1之间时均能显著提高种子的发芽势(p<0.01),400 mg·L-1和800 mg·L-1GA3浓度处理过的威氏绿绒蒿种子平均发芽时间和发芽启动时间均显著缩短(p<0.05),800 mg·L-1GA3处理显著提高了种子发芽指数(p<0.05)。总体来看,GA3处理能够促进种子萌发,800 mg·L-1GA3促进效果最显著(p<0.05),相较于ck发芽率、发芽势和发芽指数分别增加了23.89%、12.56%和2.03,但平均发芽时间缩短了8.43 d,发芽启动时间提前了5 d。
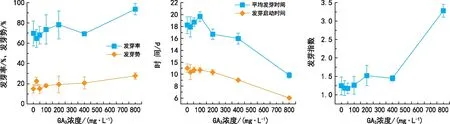
图3 不同浓度GA3对威氏绿绒蒿种子萌发的影响
2.5 不同浓度NAA对威氏绿绒蒿种子萌发的影响
由图4可知,20 mg·L-1、40 mg·L-1、80 mg·L-1NAA在一定程度上提高了种子发芽率和发芽势,80 mg·L-1NAA显著提高了种子的发芽指数(p<0.05),而3 mg·L-1、5 mg·L-1、10 mg·L-1NAA处理则降低了种子的发芽率和发芽势。各浓度NAA处理对种子平均发芽时间影响均不显著(p>0.05),40 mg·L-1、80 mg·L-1NAA处理缩短了种子的发芽启动时间。总体来看,实验设置的各浓度NAA对威氏绿绒蒿种子萌发有一定的促进作用,但都没有达到显著性差异水平(p>0.05),80 mg·L-1NAA处理更有利于种子萌发。

图4 不同浓度NAA对威氏绿绒蒿种子萌发的影响
2.6 不同浓度6-BA对威氏绿绒蒿种子萌发的影响
由图5可知,经低浓度6-BA处理后的威氏绿绒蒿种子发芽率和发芽势较ck变化不大(p>0.05),当6-BA浓度超过10 mg·L-1时,种子的发芽率和发芽势随激素浓度的增加而降低(p<0.05);在发芽指数、平均发芽时间以及发芽启动时间上,各浓度6-BA处理的种子相对于ck无显著性差异(p>0.05)。总体来看,低浓度6-BA对威氏绿绒蒿种子萌发影响不明显,当6-BA浓度达到20 mg·L-1时,开始抑制威氏绿绒蒿种子发芽率、发芽势和发芽指数,使发芽率和发芽势分别降低67.12%和6.12%,当6-BA 浓度为40 mg·L-1时对种子的发芽率和发芽势抑制更明显,分别降低了69.37%和14.7%。
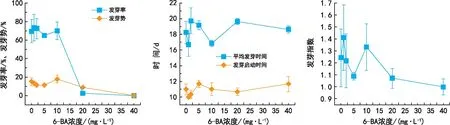
图5 不同浓度6-BA对威氏绿绒蒿种子萌发的影响
2.7 不同浓度SA对威氏绿绒蒿种子萌发的影响
由图6可知,当SA处理浓度在25~400 mg·L-1之间时,除发芽指数外其他各项测定指标均与ck无显著性差异(p>0.05),当SA浓度为800 mg·L-1时不仅降低了种子的发芽率,并且延长了种子的平均发芽时间和发芽启动时间。总体来看,低浓度SA处理对威氏绿绒蒿种子萌发的影响不明显,而高浓度的SA处理则抑制了威氏绿绒蒿种子的萌发,800 mg·L-1浓度的SA处理种子时,对种子萌发产生了明显的抑制。

图6 不同浓度SA对威氏绿绒蒿种子萌发的影响
2.8 各激素处理促进种子萌发效果综合比较
由图7可知,选取对威氏绿绒蒿种子萌发促进效果最好的激素浓度,综合比较各激素对种子萌发促进效果的差异。在发芽率的促进效果上,800 mg·L-1GA3>80 mg·L-1NAA>25 mg·L-1SA>1 mg·L-16-BA;在发芽势的促进效果上,800 mg·L-1GA3>80 mg·L-1NAA,25 mg·L-1SA和1 mg·L-16-BA降低了发芽势;在缩短平均发芽天数上,800 mg·L-1GA3>1 mg·L-16-BA>80 mg·L-1NAA>25 mg·L-1SA;在缩短发芽启动时间上,800 mg·L-1GA3>1 mg·L-16-BA>80 mg·L-1NAA,25 mg·L-1SA增加的发芽启动时间;在提升发芽指数上,800 mg·L-1GA3>80 mg·L-1NAA>1 mg·L-16-BA>25 mg·L-1SA。
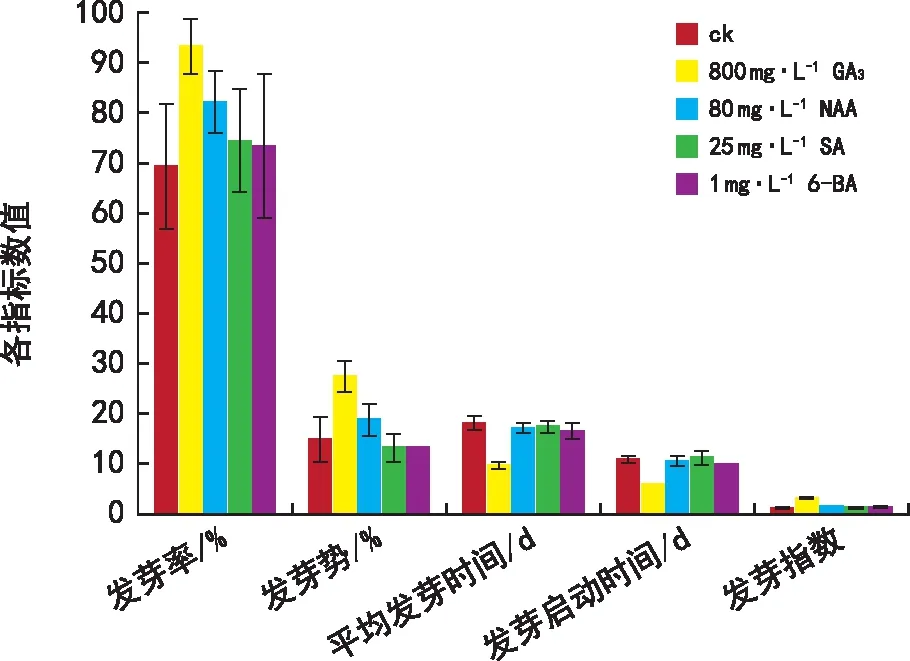
图7 各激素处理促进种子萌发效果综合比较
3 讨 论
种子作为重要的繁殖器官,在植物适应环境及繁殖过程中都具有重要作用。种子的形态特征具有相对稳定性,种子微形态结构与种子水分的吸收、种子的生活力以及种子的传播、寿命、萌发速度的快慢和萌发率有着密切的联系,种子的形态和质量还能影响种子的散布距离[2]。袁长春[7]利用扫描电镜对32种绿绒蒿种子进行观察研究,根据外种皮表面的纹饰和附属物的差异,将绿绒蒿植物的种皮纹饰分为条纹型、网纹型、褶皱型和泡状型。综合体视镜和扫面电镜的观察,威氏绿绒蒿种子近肾形,在低倍放大时,外种皮表面具有较密集的褶皱,且部分褶皱呈片块状,在高倍放大后,片块状褶皱呈杂乱状的挤在一起,并有部分细丝状物交织在一起,属于褶皱型种子。
种子从收获到播种都需要经过一段时间的储藏,随着储藏时间的增加,种子会逐渐失去活力,发芽率明显下降,甚至难以萌发。在播种之前测定种子的生理生化反应能更准确地反应出种子的活力和内在品质,也能更好的对储藏中的种子是否能顺利萌发做一个预判。目前关于种子活力的测定方法常用的有3种:第一是进行标准发芽试验;第二是测定生理生化指标;第三是复合逆境法测定[8]。本实验通过测定种子的部分生理生化指标以及进行种子萌发实验,证明威氏绿绒蒿种子在进行萌发实验前是处于正常状态且具有活力的种子。
种子休眠是指具有生活力的种子在适宜的萌发条件下仍不能萌发的现象, 大多数植物种子有或强或弱的休眠特性[9]。绿绒蒿生长于海拔2 500~5 500 m的高山上,高山上气候多变,休眠可以防止种子在不适于自身生长的外界环境条件下萌发,种子休眠可能是绿绒蒿的一种生存策略[10]。不管这种策略是否存在,种子休眠都给绿绒蒿的科研栽培和生产栽培上带来诸多不便,因此,科研和生产上都迫切需求找到破除绿绒蒿种子休眠、促进种子萌发的有效措施。
周健[11]研究表明,种子休眠可能是由于植物角质层和栅栏层的结构影响种子种皮透性所引起的。赖小连等[12]研究认为,夏腊梅萌发困难是由于种皮坚硬,透水性较弱而导致。本研究表明,威氏绿绒蒿种子吸水速度先快后慢,浸种12 h种子吸水达到饱和并趋于稳定,饱和时吸水率为67.65%,说明威氏绿绒蒿种子在萌发时不存在吸水障碍。另外,威氏绿绒蒿种子经纯水浸泡12 h后吸水率趋于饱和,这可为以后研究激素及其他物质溶液对威氏绿绒蒿种子作用效果时种子浸泡处理时间的确定提供参考。
外源激素能够对植物种子萌发起到促进或抑制的作用[13],常见的外源激素有GA3、NAA、6-BA、SA等。
GA3可促进糊粉层细胞合成淀粉酶,淀粉酶能够促进胚乳中淀粉的水解,为胚的生长发育提供物质和能量,进而促进种子萌发[14]。200~300 mg·L-1GA3处理可提高长果绿绒蒿种子发芽率、发芽势和发芽指数,缩短平均发芽时间[15],当使用200 mg·L-1的GA3处理顶果木种子时,可显著提高其发芽率、发芽势和发芽指数,但浓度提升至300 mg·L-1时对种子萌发的促进效果不如200 mg·L-1的处理好[16]。本实验表明,低浓度GA3对威氏绿绒蒿种子萌发影响不显著(p>0.05),但当GA3浓度达到800 mg·L-1时,可以极显著地提高种子的发芽率和发芽势,降低平均发芽时间和发芽启动时间(p<0.05)。但屈燕等[17]研究表明,100 mg·L-1GA3对总状绿绒蒿种子萌发促进最显著。因此可以推断,不同种类的绿绒蒿对不同外源激素处理的最适浓度不同。
NAA是一种广谱型植物生长调节剂, 能够促进植物细胞的分裂和扩大, 诱导不定根的形成[18]。研究表明,一定浓度的NAA预处理能够提高植物种子的发芽率和发芽势[19-21],也有研究表明,NAA可抑制植物种子萌发[22]。本实验表明,NAA对威氏绿绒蒿种子萌发影响不显著,80 mg·L-1NAA虽可提高种子的萌发,但未能达到显著性差异水平(p>0.05),这可能是由于促进威氏绿绒蒿种子萌发的NAA浓度高于80 mg·L-1。
6-BA是一种非植物内源的生长调节剂,可以促进细胞的分裂,浓度适宜时可促进种子的萌发,如0.1 mg·L-1、0.5 mg·L-1、1.0 mg·L-1和1.5 mg·L-16-BA均能促进花叶苋菜种子萌发,但6-BA 浓度为2 mg·L-1时则对种子萌发产生了抑制[23]。对于威氏绿绒蒿来说,1 mg·L-1、2 mg·L-1、5 mg·L-1和10 mg·L-16-BA处理的种子在发芽率和发芽势上相对于ck均无显著性差异(p>0.05),但浓度大于20 mg·L-1时反而会降低种子发芽率和发芽势,因此6-BA可能对威氏绿绒蒿种子萌发无促进作用,相反,20 mg·L-1以上浓度还会抑制种子萌发。
SA是植物界普遍存在的酚类化合物,对植物有积极的生理效应, 被认为是一种新的植物内源激素[24]。达清璟等[25]研究表明,不同浓度的SA处理能够对总状绿绒蒿种子萌发产生不同程度的促进和抑制作用。在本实验中,当SA浓度小于800 mg·L-1时对威氏绿绒蒿种子萌发影响不明显(p>0.05),当浓度提升至800 mg·L-1时,SA不仅极显著地降低了种子发芽率和发芽势(p<0.01),还增加了平均发芽时间和发芽启动时间(p<0.01),这说明总状绿绒蒿与威氏绿绒蒿种子萌发特性并不相同。
4 结 论
威氏绿绒蒿种子近肾形,属褶皱型种子。种子的休眠并不来源于吸水障碍,经过不同浓度GA3、NAA、6-BA、SA处理后,发芽率最高的是GA3处理组,当GA3浓度达到800 mg·L-1时,种子的发芽率和发芽势最高,平均发芽时间和发芽启动时间最短。因此,为提升种子萌发效率,在播种威氏绿绒蒿时,建议预先采用800 mg·L-1GA3浸种24 h处理,6-BA和SA不适宜作为威氏绿绒蒿播种时的外源添加激素。

