海洋环境中甲烷好氧氧化过程的研究进展
李晶,刘昌岭,吴能友,贺行良,孟庆国,许晓晴,3,陈烨
1. 自然资源部天然气水合物重点实验室,中国地质调查局青岛海洋地质研究所,青岛 266237
2. 青岛海洋科学与技术试点国家实验室海洋矿产资源评价与探测技术功能实验室,青岛 266237
3. 中国海洋大学环境科学与工程学院,青岛 266100
海洋作为地球的主要碳库之一,是温室气体甲烷的重要源和汇,在全球碳循环及生态环境调控中扮演着关键角色[1]。据统计,每年由海洋产生的甲烷量为85~300 Tg/a,占全球甲烷总产量的7%~25%[2],然而海洋最终向大气释放的甲烷不足10 Tg/a[3],大部分甲烷在向上运移的过程中发生了生物地球化学转化,被海洋中微生物代谢消耗(包括甲烷厌氧氧化和甲烷好氧氧化)[4](图1)。虽然长期以来甲烷厌氧氧化作用被认为是海洋拦截甲烷排放的主要因素[5-6],但最近的研究表明,无论从赋存范围还是从甲烷降解潜力来看,海洋环境中甲烷好氧氧化(Aerobic oxidation of methane,AeOM)在降解甲烷方面的贡献是不容忽视的[7-8]。
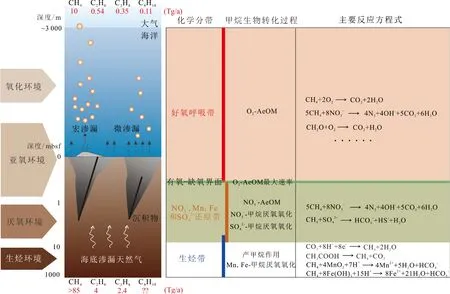
图 1 海洋渗漏甲烷的生物地球化学过程示意图[2-3,7, 15-18]Fig.1 Schematic diagram of biogeochemical processes of methane seeps in the ocean[2-3,7, 15-18]
海洋环境中AeOM主要发生于含氧的沉积物层、沉积物-水界面和水体中,其赋存环境特殊且十分复杂,例如高压、低温、少氧以及甲烷动态渗漏等[5],这些因素耦合叠加导致海洋AeOM研究难度大。随着分子生物学技术和海洋调查技术的快速发展,越来越多海底极端环境下的AeOM作用及其相关微生物证据被发现,包括超过3 000 m水深高压环境下的AeOM速率监测证据、极酸极热或缺氧环境中的好氧甲烷氧化菌迹象等[9-10]。在这些复杂环境条件下AeOM的分布特征、甲烷降解能力以及甲烷氧化菌类型和丰度等可能存在明显差异[8,11],某些极端环境下还可能存在特殊的甲烷氧化菌新菌种[12]。但目前针对海洋环境中AeOM特征还没有相关的综述对其进行总结归纳,缺乏对海洋AeOM的全面认识,制约了对甲烷生态环境功能以及海洋碳循环的深入理解。
本文综述了海洋环境中AeOM的相关研究进展,介绍了AeOM在海洋环境中的赋存位置及赋存环境特征,以及在该赋存背景下驱动氧化发生的甲烷氧化菌菌群特性及分布特征,同时总结了不同赋存环境中AeOM所发挥的甲烷降解潜力及其影响因子。另外,尝试展望了海洋AeOM研究的发展方向。
1 海洋环境中AeOM的赋存特征
1.1 海洋AeOM的赋存位置
AeOM是在好氧甲烷氧化菌介导下甲烷与氧分别作为电子供体和电子受体的氧化反应,它的赋存有反应物甲烷、氧和好氧甲烷氧化菌3个必要条件。首先,AeOM的赋存位置必然位于海底正在发生或曾发生过气体渗漏的甲烷高异常海区。位于深海沉积物中的天然气水合物[13]、常规油气资源[14]、河口海岸带的浅层气[19]以及地壳深处地幔甲烷[20]等是海底渗漏甲烷的主要来源,在地质构造活动、人为勘探开发等因素的扰动下,甲烷会以冷泉或热液流体的形式沿海底断裂、泥底辟、气烟囱等运输通道在海底发生渗漏[21],从而形成海底甲烷浓度高异常。据统计,目前已发现的海底冷泉数量可达数千个,主要分布于大陆边缘及边缘海盆地[22],而海底热液活动则主要分布在洋中脊、弧后盆地等构造活动部位,已发现的热液喷溢区达数百个[23]。另外,河口海岸带区域的浅层气分布同样十分可观[24],这些正在发生甲烷渗漏或存在潜在渗漏风险的环境可为AeOM的赋存提供必需的甲烷条件。
当甲烷达到一定浓度时,甲烷氧化菌及其好氧氧化作用是否存在则受海底含氧量的直接影响。除了缺氧环境中在特殊甲烷氧化菌NC10门介导下与反硝化作用耦合发生的AeOM[25]之外,大部分AeOM所利用的氧分子主要指直接来自海水或沉积物孔隙水的溶解氧。传统观念认为AeOM仅局限于含氧量相对较为丰富的浅水海域,但事实上,近年来随着人类对深海环境的不断探索,越来越多的研究表明AeOM还存在于含氧量极低的深海环境。例如,在Amon和Håkon Mosby等多个水深大于1 000 m的海底冷泉中,均检测到了明显的AeOM作用,甲烷氧化速率为13~36 mmol/m2/d[26-27]。在水深超过3 000 m的Cheops泥火山(水深3 005 m)和REGAG麻坑(水深3 160 m)中,发现了AeOM作用的存在,氧化速率最大可达289 mmol/m2/d。另外,一些学者还从微生物及其相关生物标志物角度进一步证实了AeOM在深海的广泛发育。例如,Li等[28]发现了水深约2 000 m的 Guaymas 热液喷口附近水体中的烃类好氧氧化菌,Talbot等[29]发现了位于Congo深水扇北部(ODP 1075站位)水深达2 996 m的沉积物中与AeOM相关的生物标志物。目前,AeOM的水深赋存极限仍在持续探索中,这些已有的以及未来可能发现的深海赋存证据,将拓展人类对AeOM在海底极低氧、超高压等极限环境中的认知。
除了含氧量的影响之外,AeOM在沉积物中的赋存位置还与有机质含量有关。在海底高有机质沉积区,沉积物中的好氧氧化通常赋存于水体-有氧沉积物交界处至1 m深的微含氧沉积物层范围内[7]。而在海底寡营养区,已有研究表明具有活性的需氧微生物可以纵深至86 Ma的沉积物基底[30]。因此,AeOM作用在沉积物中的赋存深度也可能远超我们的预期,其赋存深度极限可能还需要进一步探索。
海底甲烷垂向渗漏时,在厌氧沉积物层发生的NO3−-AeOM与甲烷厌氧氧化可能存在重叠(图1),而常规AeOM通常发生在厌氧氧化作用之后,因此,AeOM的赋存还与气体渗漏强度、厌氧氧化程度密切相关。在典型的以扩散控制为主和低/中通量平流控制的渗漏海域,甲烷厌氧氧化菌能够在气体上升至含氧沉积物之前,通过厌氧氧化作用把甲烷浓度降低到可以忽略的水平,此时AeOM的作用微乎其微;而在高气体通量或气体穿过厌氧氧化带后继续上涌的渗漏海域中,AeOM是调节甲烷通量的另一种重要手段[31-32]。
1.2 海洋AeOM的赋存环境
海洋AeOM的赋存环境特征与其赋存位置息息相关。从海底AeOM赋存位置的纵深角度来看,AeOM可跨越厘米-米级沉积物表层和百米-千米级上覆水体中,赋存环境从海水表面的常压、常温、常氧纵深至海底沉积物表层的高温/低温(分别对应热液和冷泉系统)、高压、高盐、低氧、寡营养等极端环境[33],由此可见氧化作用的赋存环境条件十分宽泛。例如,在深海海底高压、低温、低氧等极端环境下,已报道AeOM可赋存的较大水深约为3 000 m,对应约30 MPa和4 ℃的温压环境,其氧浓度亦相对较低[9];在热液喷口等高温环境下,AeOM的赋存温度可达约260 ℃[34]。另外,在海底极端酸碱环境中也发现有AeOM的存在[10]。
除此之外,海洋AeOM通常伴随于渗漏甲烷垂向上的动态运移过程,因此甲烷动态渗漏是AeOM赋存的特殊环境特征。不同渗漏背景下甲烷来源不同,根据形成成因差异可将甲烷分为两类,一是生物成因甲烷,即通过微生物或热分解作用(微生物成因和热成因)由有机化合物转化而成,碳、氢同位素范围分别为−90‰~−20‰、−400‰~−100‰,主要以冷泉流体形式发生渗漏或以扩散的形式通过沉积物-水界面进入水体[14,35];另一类是地壳中的无机(非生物)成因甲烷,其同位素标准尚未完全确定,可与地球化学标准一致(碳同位素值高于−25‰),也可能与微生物成因甲烷的同位素值重叠(碳同位素值低于−50‰),无机成因甲烷分布于地壳深处,可随热液流体在海底渗漏溢出[36]。随着流体渗漏速率原位测量或底栖室流体连续取样分析等甲烷渗漏监测技术的不断发展,大量监测数据显示甲烷渗漏通量在时间上和空间上具有多变性,其物理、化学和生物特征也随之变化[37-38]。在空间上,不同渗漏系统或单个渗漏系统的不同部位甲烷渗漏强度可能存在差异。基于气体渗漏通量数据并结合气体渗漏尺寸和可见度,Etiope[14]将甲烷渗漏系统分为宏渗漏系统(Macro-seeps)和微渗漏系统(Microseepage)(图1),甲烷渗漏通量跨度为672 ~1.2 L/m2/d。在Cascadia水合物脊喷口的不同位置甲烷渗漏强度亦存在差异,渗漏通量从0.6 mmol/m2/d变化至11.5 mmol/m2/d[38]。在时间上,任一固定位置的甲烷渗漏可能存在不规律性的时间变化特征。例如,Bush Hill渗漏系统近10年的海底观测数据显示,从渗漏前期到晚期整体经历了高速、中速及低速3个渗漏阶段,其天然气渗漏通量为0.59~55 kg/m2/a[39-40]。
2 海洋环境中驱动AeOM的氧化菌菌群特征
2.1 好氧甲烷氧化菌的菌群类型
好氧甲烷氧化菌(aerobic methane-oxidizing bacteria, MOB)是一类以甲烷和甲醇为主要代谢物质的功能性细菌,属于甲基氧化菌的一个分支[41]。传统分类的MOB属于变形菌门,根据甲醛同化途径、磷脂脂肪酸组成等特征的不同,MOB可分为I型(γ-变形菌)和Ⅱ型(α-变形菌)两种类型。随着分子生物学技术和海底勘探技术的日益发展,对海洋MOB多样性的认识更加全面深刻。目前,海洋环境中已发现的好氧甲烷氧化菌主要属于I型MOB(γ-变 形 菌)[8],例 如Methylothermaceae科[34]、Methylocicrobium属[42]、Methylococcales目中的Methylococcus属和Methylocaldum属[43]等。同时,前人在海洋环境中还发现了MOB新菌种,例如由大气氮作为唯一氮源的Methyloprofundus sedimentigen. nov.,sp. nov.[12]、携带镧系元素依赖型XoxF5-甲醇脱氢酶的I型MOB[44]等。Wasmund等[31]在澳大利亚Timor海甲烷喷口表层沉积物中检测到的MOB中大多数为新菌种,它们的pmoA基因序列与公共数据库中已知序列的相似度均小于91%,这些数目可观的新菌种可能能够构成海洋专属的MOB谱系。相对而言,海洋环境中II型MOB分布较少[45],且前人发现一些II型MOB菌株的携带基因特征较为特殊,它们并未携带MOB普遍具有的由pMMO编码的pmoA基因[44]。除了传统变形菌门MOB之外,海底还存在特殊的疣微菌门MOB和NC10门MOB[16,46]。
2.2 好氧甲烷氧化菌的菌群分布
不同海洋环境中MOB的分布存在明显差异。首先,MOB菌群丰度存在差异。MOB菌群丰度的高低与气体渗漏强度、溶解甲烷浓度等环境因素息息相关。在甲烷喷口或甲烷高异常海域附近MOB的丰度明显高于正常海水区,其pmoA基因拷贝数的量级范围一般为105~106copies/g,正常海水甲烷背景区的pmoA基因拷贝数通常仅为103~104copies/g[8]。其次,MOB在海水及沉积物中的分布也存在差异,某些类型的MOB对海水或沉积物环境存在明显偏向性。例如在海水中检测发现的OPU1、OPU3和Group-X菌群(图2),与通常从富含甲烷的海洋沉积物中报道的MOB类型不同,它们喜好海水中浮游的生活方式,被认为是海洋水体中甲烷的重要消耗者,其中OPU1和OPU3广泛分布于110~2 000 m水深的中深海区域,而Group-X菌群目前主要发现于加州大陆边缘[47]。另外,海洋II型MOB可赋存于包括热液喷口[48]、正常沉积海区[44]等多种海域生态环境,在这一点上与I型氧化菌相比并未显示出特异性。但海水或沉积物孔隙水中的CH4、O2及微量金属元素等环境参数对两类MOB的分布影响是十分显著的,例如海洋I型MOB偏好赋存于CH4高浓度异常环境,II型MOB则与之相反,这一分布特征与土壤MOB相似[49]。此外,特殊MOB中疣微菌门氧化菌不仅可赋存于热液喷口等极酸、极热环境,还可繁殖在富甲烷-富铁-贫氧的海底环境中[46],而NC10门MOB通常多见于海底NO3-还原带或海水最小含氧层中[16]。

图 2 海洋水体中的MOB新菌种OPU1、OPU3和Group-X菌群系统发育树[47]Fig.2 Phylogeny of new putative aerobic methanotrophs (OPU1, OPU3 and Group-X) in marine water column[47]
3 海洋AeOM的甲烷降解潜力及其影响因子
3.1 海洋AeOM的甲烷降解潜力
海底任一甲烷渗漏系统都不是恒久存在的,其气体渗漏必然存在一个时间起点。当气体渗漏逐渐开始或突然爆发之初,海底正常沉积海水中以低丰度存在的MOB及其产生的氧化作用需要多久发挥效用,是需首先关注的关键问题之一。研究表明,海底MOB可以对大规模甲烷输入深海做出快速响应,响应时间大约为几天到几个月不等[49-50]。例如,在2010年4月底墨西哥湾“深海地平线”漏油事故发生后,5月到6月初海水中携带pmoA基因的MOB丰度即达到最大值,对应最大氧化速率高达5 900 nM/d,最终在7—8月将大部分的泄露甲烷(泄露总量高达50万吨)几乎消耗殆尽[49]。另外,实验室微生物富集培养研究中同样发现了甲烷输入状态下MOB迅速的生长繁殖反馈。当人为给予实验体系一定量的甲烷碳源时,好氧氧化菌在24 h内最高可暴增至初始丰度的约213%,在细菌类群中占比增至约68%[15],相较于甲烷厌氧氧化古菌的倍增时间(1.1~7.5个月)而言明显迅速了很多[51]。
在海底甲烷发生泄漏后,MOB控制下的甲烷氧化速率通常由以下方式获取:①由野外监测获得的甲烷浓度、甲烷碳同位素、水流速度等数据代入同位素动力学模型进行计算;②结合稳定同位素(13CCH4)或放射性同位素(14C-CH4、3H-CH4)示踪技术,通过室内微生物培养方法还原甲烷氧化过程[11,52-53];③利用充分耦合物理、生物和化学过程的AeOM生物地球化学模式,目前常用的AQUASIM软件借助偏微分输运-反应方程进行AeOM模拟[54-55]。综合前人所获数据可以发现(表1),受海底甲烷渗漏特征的影响,甲烷好氧氧化强度亦存在强烈的时空变化。首先,在正常海水沉积背景下甲烷好氧氧化速率通常为0.0001~0.1 nM/d,海底渗漏区的氧化速率明显高于这一背景值,且不同渗漏区的氧化强度具有较大差别。例如,美国哈德逊峡谷甲烷渗漏处海水中的氧化速率为22.8±17 nM/d[11],非洲REGAB麻坑某一渗漏点的甲烷氧化速率高达28.9×104nM/d[7],相差4个数量级。其次,同一渗漏区不同位置的氧化速率可能不同。仍以非洲REGAB麻坑为例,其不同喷口位置的氧化速率跨度为6~289 mM/d,相差近50倍之多[9]。另外,渗漏喷口上方不同纵深层位的气体氧化速率也存在明显差异。通常在甲烷浓度较高的层位中气体氧化速率相对较大,例如,Steinle等[32]在对北海北部某甲烷喷口的研究中发现(图3),喷口上方凹坑水体中甲烷氧化速率最大(498 nM/d),对应甲烷浓度42 097 nM,而其余层位中最小氧化速率仅为0.03 nM/d,对应的甲烷浓度也最低(21 nM)。另外,Steinle等[32]还发现海水温跃层中甲烷的氧化速率也普遍偏高,可达262 nM/d。最后,海底渗漏喷口不同时刻的氧化速率也在不断变化中。墨西哥湾“深海地平线”钻井平台爆炸事故发生后,Crespo-Medina等[49]对该区域进行了长达9个月的长期观测,记录了甲烷氧化速率由0.014 nM/d暴增至最大5 900 nM/d后逐渐回落到3~5 nM/d的变化轨迹。甲烷氧化速率随时间的变化除了受甲烷浓度显著影响之外,还与氧化菌消亡以及营养物质、微量金属元素缺乏等生理或环境因素紧密相关。
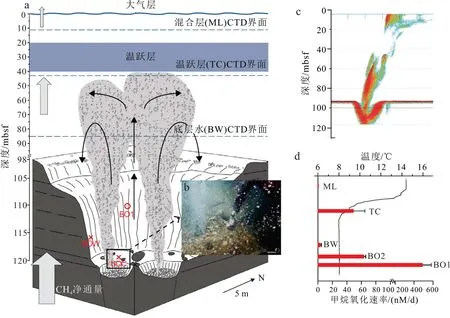
图 3 北海北部某一气体渗漏喷口甲烷渗漏和氧化情况a.喷口示意图,b. 喷口实景照片,c. 喷口上方渗漏气体的声纳图像,d. CTD温度剖面及不同层位的甲烷好氧氧化速率[32]。Fig.3 Methane leakage and oxidation at a man-made gas blowout in the North Seaa. schematic representation of a gas blowout crater in the northern North Sea, b. photograph of the center of the crater, c. sonar image of the blowout gas flare,d. temperature profile and average water-column methane oxidation rates[32].
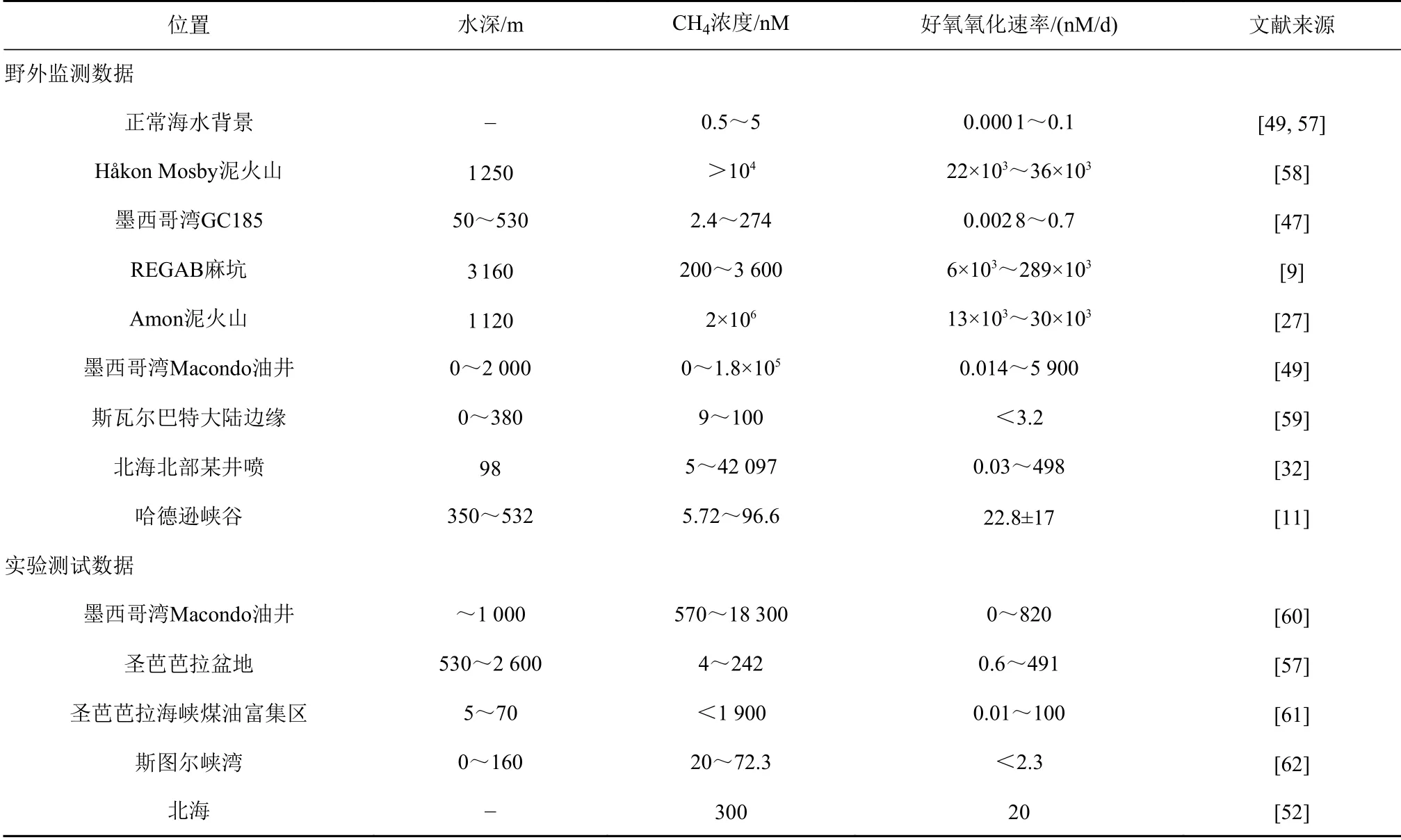
表 1 由野外监测及室内培养方式获取的海洋甲烷好氧氧化速率数据统计Table 1 Statistics of marine aerobic methane oxidation rates obtained by field investigation and laboratory culture experiment
相较于“变化多端”的甲烷氧化速率,MOB产生的甲烷截滤效率(filter efficiency)是决定微生物发挥效用进而评估甲烷的好氧氧化通量及最终排放通量的重要参数,它指的是一段渗漏时期内气体氧化量与气体渗漏总量的比值,需依赖于甲烷氧化速率的长期监测。纵观整个海洋生态系统发现,海底微生物好氧及厌氧氧化作用所产生的截滤效率可达90%以上[56],但海底各甲烷渗漏系统的气体截滤效率却存在显著差异。在针对海底沉积物的相关报道中,好氧与厌氧氧化作用共同产生的甲烷截滤效率通常无法有效区分,两者产生的截滤总效率从4%到100%均有报道,其中38组数据中截滤效率大于60%的仅为18组[7,43]。当渗漏气体输入海水后,甲烷截滤效率基本由AeOM单独完成,其数值跨度同样较大。例如,Eel River Basin的甲烷截滤效率仅为0.2%~0.4%,而Hudson Canyon的截滤效率可达63%[11]。因此,了解甲烷截滤效率存在差异的原因,同时建立甲烷微生物产生有效截滤效果所需的时间范围[43],将有助于科学评估水合物分解、泥火山喷发、大规模石油泄露等海底扰动所带来的生态环境后果。
3.2 海洋AeOM的影响因子
海洋AeOM所赋存的环境条件特殊且十分复杂,具有温度、甲烷浓度、氧浓度、微量金属元素等多种环境因子差异,这些环境因子变量不仅影响着MOB的生长繁殖,而且还将进一步影响AeOM过程。关于这些影响因子差异下的AeOM规律已有相关报道,且多采用模拟实验手段以某一环境因子为实验变量进行AeOM过程研究。但对于海洋AeOM所面临的某些特殊环境条件目前研究尚不深入,例如海底压力、甲烷的动态运移状态等。其中,海底高压环境是AeOM需面临的一个特殊环境条件。随着好氧甲烷氧化菌及其相关生物标志物记录在深海海域的广泛报道[29],对海洋AeOM的压力赋存极限认知也在不断突破。近年来,地下煤层瓦斯的AeOM实验研究发现,压力是影响AeOM的重要因素,压力越大越有利于甲烷的氧化降解[63],但其并未从微生物层面深入探讨其中缘由,且最大设计压力(5 MPa)与深海AeOM赋存压力(可达30 MPa左右)存在较大差距,无法准确推测海洋AeOM的氧化特征。还有一些学者利用深海环境样品开展了原位高压状态(≤10 MPa)实验研究,阐明了高压状态下的氧化菌类型及好氧氧化速率[64],但对压力如何影响AeOM过程仍缺乏了解。
另外,海底甲烷动态运移是海洋AeOM的另一特殊环境条件。海洋环境中参与AeOM的甲烷气体不是静止的,而是以一定渗漏速率在沉积物表层及海水的长距离运移过程中发生好氧氧化作用[65-66],并且底甲烷的渗漏运移速率差异较大,目前已测得的速率范围为672 ~1.2 L/m2/d,可达4个数量级[14]。在甲烷厌氧氧化的实验研究中,已有报道证实了甲烷动态运移是影响厌氧氧化过程的重要因素[67],并阐明了不同运移速率下厌氧氧化速率和氧化菌菌群的显著差异[68]。然而,目前对海洋AeOM的研究仍多侧重甲烷静止状态下的氧化过程,包括静态AeOM的碳同位素分馏机制、氧化菌菌群特征等[69-70]。
最近的一些研究虽已考虑甲烷运移状态下AeOM的动态情境[71],但关于甲烷运移状态对AeOM的影响研究目前并未涉及,甲烷氧化菌的群落多样性及群落丰度有何表征,不同渗漏状态下气体氧化潜力如何,氧化潜力与渗漏状态之间是否存在相关关系,这些问题尚未探究清楚。
4 结论与展望
(1)海洋AeOM可赋存于超3 000 m水深的深海海底、热液喷口等极端环境,相对于陆地生态系统而言,海底高压、深部甲烷渗漏运移等是甲烷好氧氧化所面临的特殊环境特征。
(2)海洋环境中I型好氧甲烷氧化菌最为常见,沉积物、水体两种赋存环境以及孔隙水中甲烷、微量金属元素浓度等环境条件是影响I型和II型氧化菌赋存分布的重要因素。
(3)海洋环境中AeOM强度具有显著时、空差异,受温度、甲烷浓度、氧浓度和微量金属元素等环境因子影响显著,但海底特有的高压、甲烷渗漏运移等环境因子影响下的AeOM特征尚缺乏研究。
随着人类深海探索之路的不断延伸,深海极端环境下的生命现象与过程一直是持续的研究热点。深海极端环境的主要特点是高压、低温(大洋沉积物表层)或高温(海底深部沉积物和洋壳)、没有阳光、缺氧、局部高盐或高酸碱度等。在这样的“生命禁区”中,甲烷好氧氧化菌的生存极限可能会不断刷新我们的认知,进一步完善人们对甲烷氧化菌生理生态特征的认识。同时,结合不断发展的分子生物学技术,海底更多极端嗜压、耐低氧的甲烷氧化新菌种可能会被发现,并可能形成海洋专属的进化分支,丰富传统已有的分类方案。
目前,现有研究在特殊且复杂的海洋环境中AeOM规律及其影响因子研究仍存在一些问题尚未探究清楚,尤其对海底高压、渗漏甲烷的动态运移等特殊环境因子影响下的AeOM规律认识不清。单纯依靠海底原位的长期监测及连续采样,操作难度大且成本高昂,借助实验模拟手段还原海底高压渗漏状态下的动态氧化过程,可能是探究以上问题的重要途径。海洋环境中AeOM规律及其影响因子的深入研究将有助于进一步理解海洋中甲烷的生物地球化学过程,对深刻揭示甲烷迁移转化机制、科学评估甲烷生态环境效应具有重要意义。

