无创脑血流搏动磁感应相移评价方法
陈镜伯,梁华友,张茂婷,殷圣童,梁婷婷,孙 建,秦明新
(1.陆军军医大学 生物医学工程与影像医学系,重庆 400038;2.中国空气动力研究与发展中心低速所,四川 绵阳 621000;3.重庆理工大学 药学与生物工程学院,重庆 400054)
中风已成为全球公共健康的威胁。近年来,出血性卒中的发病率逐渐下降,而缺血性卒中的发病率呈爆发式增长[1]。2018年,美国心脏协会/美国中风协会指出,维持大脑中动脉(middle cerebral artery,MCA)正常血流供应水平是缺血性中风治疗的关键[2]。脑血流(cerebral blood flow,CBF)的实时连续监测具有重要的临床意义,可以为合理治疗和提升预后提供指导。
临床实践中尚无安全且被广泛接受的方法可开展脑血流的实时连续监测。目前,医院中常用CT、MRI等影像学方法进行评价。然而,影像学设备体积庞大,无法实现床旁的连续监测。一般情况下,患者是根据医生的判断或安排的检查时间表来接受影像学检查,容易错过最佳的诊疗时机[3]。颅内压(intracranial pressure,ICP)监测可间接反映脑血流的变化。然而,脑卒中发作后,颅内代偿机制可使颅内压维持在一个相对恒定范围[4-5]。只有当卒中病程进入中后期诱发大面积梗死时,颅内高压才会迅速出现。此外,双源多普勒容积超声虽然可以手工操作,但长期监测难度较大。经颅多普勒(transcranial doppler,TCD)着重关注脑血管内的脑血流速度(cerebral blood flow velocity,CBFV)并以此作为中动脉CBF的评价指标,常用于间歇监测[6-7]。然而,当交感神经刺激或输注血管活性药物引起测量的大脑中动脉直径变化时,TCD结果的准确性会受到影响。皮质激光多普勒流量计也可以测量血管内的血流速度。但其探测深度有限,需要暴露脑组织[8],并且结果易受环境因素影响。近红外光谱(near-infrared spectroscopy,NIRS)通过测量血管中血氧和脱氧血红蛋白的变化,可以实现对CBF的连续无创监测[9-10]。但这一方法的前提是近红外光的散射程度保持不变,测量的衰减仅由吸收率变化引起。然而,随缺血性脑卒中病程发展,颅内组织的病理生理改变会改变测量条件。
磁感应相移(magnetic induction phase shift,MIPS)是一种新的电磁测量方法[11]。这一技术通过在生物组织上施加一个低频磁场来产生感应的次级磁场。初级磁场和次级磁场之间存在一个特定的相位差,即MIPS。MIPS与生物组织的电导率和体积变化相关。考虑到脑血流灌注呈周期性变化,脑血管血流动力学相关的几何参数也会发生变化。因此,MIPS方法有望对CBF开展监测。Oziel等[12]研究了MIPS测量CBF体积变化的可行性。然而,该研究中的实验设计采用了特殊的仰卧位,需要进行Valsalva呼吸刺激,这与实际监测场景不同。Griffith等[13]提出了一种测量自谐振频率变化的无源皮肤贴片传感器。物理模型和志愿者实验表明:它可以无创地监测脑组织体积的变化。但该方法只能作为CBF的间接辅助诊断方法。陈明生等[14-15]通过家兔进行MIPS监测和MRI成像的平行实验,发现MIPS信号可以定量检测脑出血不同阶段的脑脊液、脑血液等脑组织主要成分的变化。许佳等[16]搭建了一个基于多通道天线的便携式MIPS检测系统。他们还通过动物实验验证了其区分出血性中风和缺血性中风的可行性。李根等[17-19]在创伤性脑损伤(traumatic brain injury,TBI)动物模型中发现了MIPS与ICP之间的特殊关系,并利用特征提取和机器学习建立了颅内高压的分析模型。上述研究为MIPS在脑疾病诊断和监测中的应用提供了有力的证据。然而,以往的磁感应测量更多地关注大脑的整体变化,鲜有研究关注具体的CBF的检测问题。
本研究结合了中动脉血流动力学理论与MIPS检测原理,构建了一个脑血流搏动(cerebral blood flow pulsation,CBFP)的实时测量系统。在此基础上,本研究设计了一个流速可调的脑血流搏动物理模型,并进行了MIPS检测实验。然后采用频谱分析、小波分解和滤波器等信号处理和分析方法进行分析。最后,研究了CBF搏动相关参数与MIPS信号时频特性的关系。本研究为无创、连续、准确地监测脑血流搏动提供了一种新的解决方案。
1 方法论
1.1 测量原理
磁感应相移测量的原理如图1所示。当自由空间中的一个线圈中通以一个正弦波激励V时,线圈会在其周围空间产生一个交变初级磁场,记为B。若线圈附近有生物组织,初级磁场B会在生物组织中产生涡流,进而产生次级磁场,记为ΔB。根据Griffiths等[20-21]的研究可知,在激励线圈的对侧位置,次级磁场和初级磁场之间存在如下比例关系:
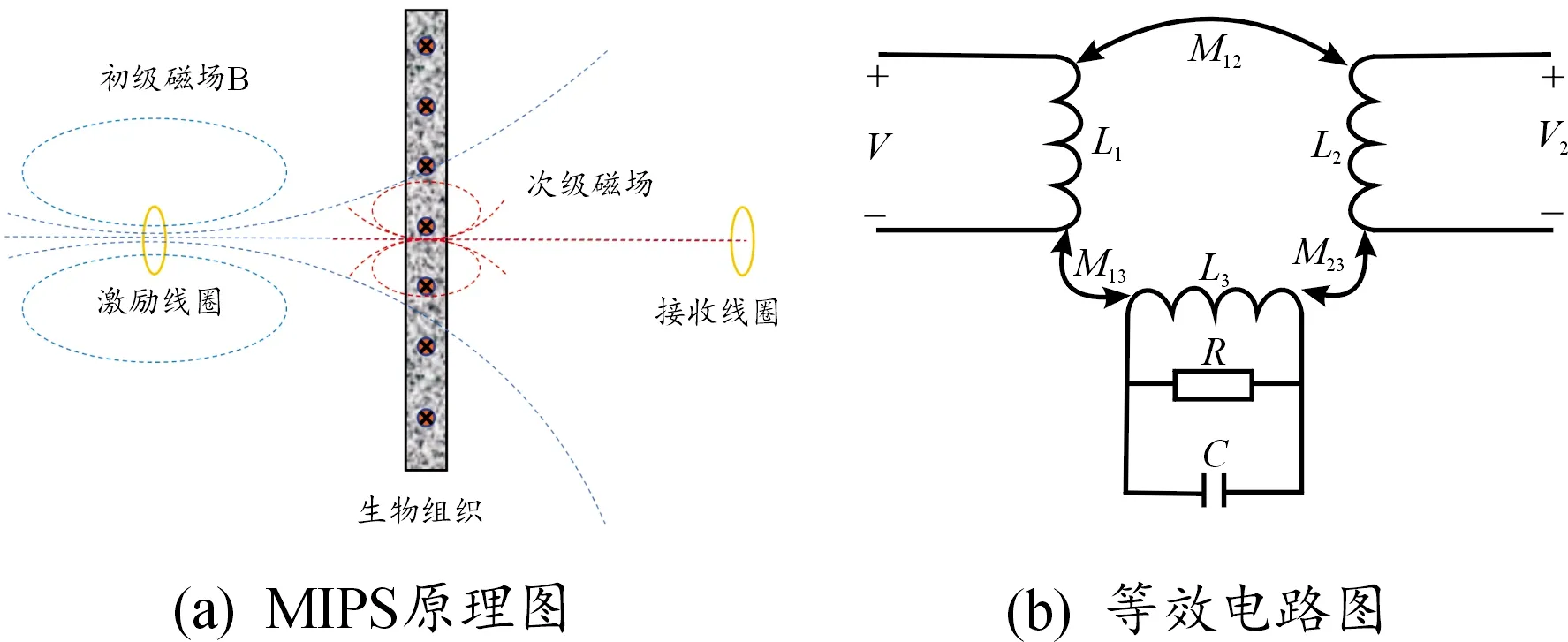
图1 磁感应相移测量原理示意图
(1)
式中:ω为激励信号角频率;ε0为真空介电常数;σ、εr和μr分别为生物组织的电导率、相对介电常数和相对磁导率;P,Q是与生物组织几何尺寸相关的常数。当激励线圈对侧放置一接收线圈时,接收线圈会同时接收B及ΔB,从而产生感应电压V1和ΔV(V2=V1+ΔV)。由Griffiths等[22-24]对上述关系进行了进一步简化推导。考虑到生物组织的相对磁导率近似为1,则上式中Q(μr-1)=0。此外,在低频段(1~10 MHz),生物组织的相对介电常数为102~103量级,电导率为0.1~10 S/m,则有ωε0εr≤σ。因此,接收线圈的感应电压与磁场之间存在如下的比例关系:

(2)
则ΔV滞后于激励信号90°,由矢量关系V2=V1+ΔV可知,接收线圈的总感应电压V2相比于激励信号滞后一个相位角,记为φ,也即MIPS。MIPS信号与被测生物组织的几何尺寸P,电导率σ和激励信号角频率ω相关。
脑血流通过脑血管的收缩、舒张和搏动节律来维持一个相对恒定水平。根据MIPS与几何参数P之间的相关性,脑血管的这种变化将对MIPS信号产生特定的信号调制。当选取适当的分析方法时,就有望提取出CBF的变化信息。
1.2 测量系统
测量系统包括:信号源(AFG3252,Tektronix),激励-接收单元,信号采集卡 (PCI-5124,National Instruments),PC(i7 2600k)。信号源输出两路同频同相的正弦波信号(f=3.52 MHz,θ=0),其中1端口接激励线圈,信号电压为Vpp=5 V,2端口接信号采集卡的2端口,其信号作为参考信号,信号电压为Vpp=1 V。本研究中使用了2个PCB螺旋线圈组成激励-接收单元,线圈参数如下:匝数N=15,线圈内径rinner=19 mm,外径router=25 mm,线径l=0.2 mm,线间距d=0.2 mm。激励线圈接信号源的1端口,接收线圈接信号采集卡的1端口。采集卡参数设置如下:采样率100 MHz,采样点数100 000个,输入阻抗50 Ω。采集卡收集1、2端口信号并输出采样数据到PC端口。PC通过FFT计算两路端口的相位数据得到MIPS信号。MIPS信号的初始采样间隔为0.013 s。
1.3 中动脉物理模型搭建
本研究搭建了一个简化的MCA模型来模拟CBF的节律性搏动。Elting等[25]的研究中指出:基于微血管或大血管的脑自主调节(cerebral autoregulation,CA)功能的评估结果是相似的。考虑到大血管的搏动节律更明显,本文着重对大血管模型进行建模。大脑中动脉有左右两侧,共分为5段(M1~M5)。在这些分段中,M1水平段的血管相对较大,相比于其他分段较为平直。最容易闭塞和形成血栓的2个主要分支均发源于M1段。当这些分支梗阻时,会影响M1段的脑血流速度CBFV。
基于上述解剖学基础,本研究采用直径与大脑中动脉相似的硅胶管(内径Dinner=2.6 mm,外径Douter=6 mm)制作物理模型。该物理模型如图2所示。硅胶管从烧杯中引出并通过蠕动泵(ZNB-XY1,KellyMed),蠕动泵齿轮总长度L=50 mm。而后,软管自下而上穿过脑模型,并用泡沫块固定在M1段位置。最后,软管从前额眉心处引出并回到烧杯。硅胶管末端进行结扎并用细针扎出数个针孔。烧杯中装有0.9%的生理盐水(σ=1.54 S/m)。蠕动泵流速vflow可调,设蠕动泵的齿轮在1 h内转动N个周期,记搏动频率(蠕动频率)为fp。1 h内泵入量为V,则:

图2 大脑中动脉的物理模型示意图
N=fp*3 600
(3)
V=π(Dinner/2)2LN
(4)
1.4 物理实验
本研究通过调节蠕动泵流速vflow来模拟不同的脑供血水平。调节范围设定为[0,2 000]mL/h,步长200 mL/h。则共有11个流速组,依次记为0,200,400,…,2 000 mL/h。实验步骤如下:首先,测量系统开机预热半小时;然后,依次设置流速(0 mL/h组只需手动控制蠕动泵工作,待硅胶管内充满生理盐水后停止);参数设定后,等待30 s,随后开始测量5 min;最终将MIPS信号重新采样,间隔为0.1 s。
1.5 数据处理及分析
本研究中的数据处理通过Matlab R2015a(MathWorks Inc.)完成。首先,分别在时域和频域定性观察MIPS信号与不同vflow的关系。然后,利用小波变换和高通/低通滤波器对所模拟的搏动信号进行提取。数据处理和分解流程如图3所示。

图3 数据处理和分析流程框图
2 结果
图4为MIPS结果。图4(a)为5 min内各流速组的MIPS时域信号。由图可知,各组MIPS的基线(平均值)不同,且存在不同程度的基线漂移和杂波干扰。图4(b)是不同vflow组在5 min内MIPS数据的箱线图,可以看出MIPS随vflow的加快呈近似线性上升趋势。对MIPS基线值和流速vflow进行线性拟合可得MIPS=1.71e-3vflow+110.72,结果具有统计学意义(P<0.05,R2=0.937)。考虑到硅胶管的末端已经结扎,硅胶管内液体的压力在不同流速下是不同的,这将造成不同程度的硅胶管形变,流速越快,形变越大。由式(2)可知:MIPS与几何参数P相关,这一变化趋势与理论相符;另一方面,线性拟合的误差可能由系统误差所引起。在该模型中,vflow与硅胶管壁的压力的关系并不线性相关,因为蠕动泵齿轮的周期性蠕动和电机驱动的注射泵在轴向直接施加外力二者之间存在差异。此外,每一流速组中都有一个非常小的搏动信号,随着vflow的加快,搏动信号也逐渐加快。这一搏动信号是由硅胶管的节律性搏动引起。蠕动泵通过驱动多个齿轮周期性地挤出硅胶管中的液体,这种周期性的蠕动会在vflow中产生非常微弱的搏动节律。因此,硅胶管也发生了节律性的搏动形变。

图4 MIPS在各vflow中的变化趋势曲线
图5为MIPS的时域和频域信号曲线。图5(a)随机选取了1 000 mL/h组在10 s内的MIPS时域信号。由图可知,MIPS信号中有一明显的搏动分量。图5(b)和5(c)分别绘制了1 000 mL/h组和0 mL/h组MIPS的频谱。图5(b)在1 Hz处有一个明显的频率分量,表明硅胶管中的搏动频率在该流速下为1 Hz。在0 mL/h的参考组中,其频谱图中没有明显的频率分量。当fp=1 Hz时,由式(3)(4)可得V≈956 mL。由于ZNB-XY1蠕动泵的准确度为±10%,可得这一结果是正确的。这表明MIPS信号中确实存在搏动信号分量,因此,可以通过FFT分析定量观察信号中的搏动信号分量,滤除干扰。

图5 MIPS的时域及频域信号曲线
图6为MIPS在各流速下的频谱分析结果。随着流速加快,各组分别存在0.2~2 Hz、0.2 Hz等间隔升高的信号分量。实验结果表明:MIPS能有效地检测出搏动并反映搏动速度变化。因此,本文首先使用db4小波5层分解并选取低频重构后第5层来滤除基线漂移;随后根据谱分析结果,对各速率组的MIPS信号分别选择截止频率为fp+0.2的低通滤波器和截止频率为fp-0.2高通滤波器来提取搏动信号分量,得到结果如图7所示。

图6 各流速下MIPS信号的频谱分析结果曲线
图7为经过滤波后的MIPS信号曲线。时间轴仅示出了30~40 s内的结果。由图可知,硅胶管中的生理盐水存在正弦节律的搏动。图8为滤波后MIPS信号的频谱曲线。图7、8进一步说明,通过信号滤波等手段,MIPS能够准确地反映搏动变化。

图7 各流速下滤波后MIPS时域信号曲线

图8 各流速下滤波后MIPS信号的频谱曲线
3 讨论
脑自主调节功能(CA)的异常对预后有重要影响。CA是大脑在脑灌注压(cerebral perfusion pressure,CPP)发生变化的情况下维持稳定CBF的能力[26]。CA的评价有静态CA和动态CA两种[27]。静态CA指血压(blood pressure,BP)和CBF之间的稳态关系。动态CA指的是大脑的一种内在保护机制,其在动脉血压(arterial blood pressure,ABP)或CPP波动的情况下能维持相对恒定的CBF。CA评估对预测缺血性脑卒中患者预后具有重要作用[28-31]。研究表明:脑缺血后CA会受损,从而引发脑水肿、颅内压增高等继发性状态[28,32]。在重症患者中甚至可能导致脑移位和脑疝,最终导致严重的不可逆神经损伤甚至死亡。Biesbroek-JM等[33]在系统回顾和meta分析的基础上研究了CT灌注(CT perfusion,CTP)诊断缺血性中风的敏感性和特异性。该研究纳入了共计1 107例患者,结果显示其敏感性为80%,特异性为95%。也有证据表明,及时对患者进行CTP有助于再灌注治疗和改善预后。Kiking-Ritarwan等[34]对缺血性中风患者的TCD和血液学参数进行了对比研究,发现90例患者的大脑中动脉搏动指数与NIHSS评分呈正相关。研究缺血性脑卒中供血信息的检测方法及这些信息与病理生理变化和预后的关系一直是临床医生关注的问题之一。
由于影响CBF的生理参数众多,寻找一种合适的CBF估计方法是非常困难的。CTP设备体积大,不能用于连续床边监测,存在延误风险。此外,由于位移敏感性过高、造影剂延迟到达靶血管而引起的测量误差大、辐射剂量过大等问题,使得临床上这一手段难以成为常规的检查方法,尤其对于重症患者。TCD是临床上最常用的诊断方法。但TCD经常用于间歇测量,其精度很大程度上取决于操作人员的经验。此外,TCD的探针还需要直接接触皮肤,这就限制了使用场景。目前,常用的指标除TCD外,主要包括脑血流和脑氧合。ABP的改变导致血管运动张力的改变,进而引起颅内血容量的变化,从而导致颅内压的变化。然而,ICP监测作为有创手段也存在一定的使用限制。用近红外光谱法测定颅内血红蛋白可以估计脑血容量,但这是一种更间接的CBF估计方法。近年来的研究发现:基于脉搏血氧测定原理,利用近红外光谱测量脑血氧饱和度是一种很有前途的脑血流动力学估计方法[35-36]。然而,当缺血性脑卒中发病时颅内组分会发生剧烈变化,从而会削弱近红外光吸收和散射的一致性。
本研究结果说明:MIPS方法可以直接获取供血信息。MIPS测量可以有效地打破CTP成像的时间窗,对患者的中动脉进行床旁监测,评价患者的供血水平,从而有效地克服延迟治疗的风险。与超声相比,MIPS方法具备更广泛的适用性,无需专业的操作经验即可获得准确的结果。此外,本研究中使用的MIPS测量系统也有望实现进一步的系统集成。本文采用的CBF物理模型通过设置不同的蠕动泵流速,成功地模拟了CBF搏动。结果表明:MIPS不仅能区分不同的供血水平,而且能捕捉CBF的轻微搏动,这一方法有望为CBF的诊断提供更直接、更充分的信息。缺血性中风发作后,在交感神经的刺激和血管活性药物作用下,一些大血管的直径会发生改变。这一供血水平可以从MIPS的基线值得到。此外,通过频谱分析和特定的信号滤波分析,还可以提取颅内大血管在调节代偿机制下的周期性搏动,从而评价CA的细微动态变化。
当然,本研究仍存在一定的局限性。本研究中的物理模型模拟的正弦频率的搏动,而实际的CBF搏动是一种非标准信号。此外,MCA的供血水平与搏动模式的关系更为复杂。在后续的志愿者实验中,需要设定特定的信号分析和特征提取方法。
4 结论
1) MIPS信号受血管的电导率和几何参数调制,包含了丰富的CBF信息。
2) MIPS与模拟CBF供血水平呈有统计学意义的线性关系。
3) 通过信号分析,可以成功地提取出不同流速下的微小搏动信号。
4) 这项实验研究为MIPS在无创、综合监测CBF的应用提供了有力证据,为后续定量CBF评估奠定了研究基础。

