葡萄球菌脂磷壁酸对糠秕马拉色菌诱导的HaCaT细胞IL-6及IL-1β的影响
韩阳,李晓东
(沈阳医学院附属中心医院,辽宁 沈阳 110000)
皮肤表面定植着大量的菌群(包括细菌、真菌、古细菌等),皮肤表面的菌群受宿主的免疫状态、遗传易感性、皮肤屏障状态及菌群相互作用等多因素调控,在共生性和致病性间转化。菌群与宿主之间的相互作用可参与多种皮肤疾病的发生与发展[1]。马拉色菌与葡萄球菌是皮肤常住菌群,研究发现马拉色菌可诱导多种宿主细胞分泌不同的细胞因子介导炎性反应。Baroni等[2]发现,马拉色菌可与角质形成细胞表面Toll样受体(TLR)2结合,诱导白细胞介素(IL)等细胞因子的分泌。不同种类的马拉色菌诱导产生的细胞因子也不相同,其中,厚皮马拉色菌、合轴马拉色菌和斯洛菲马拉色菌与角质形成细胞共培养后,培养上清中可测到IL-6、IL-1β、IL-8和肿瘤坏死因子(TNF)-α的表达。经厚皮马拉色菌刺激后,角质形成细胞分泌的细胞因子水平最高[3]。这些细胞因子在角质形成细胞的形态学改变和细胞调亡过程中扮演重要角色,可能参与马拉色菌相关皮肤疾病作用的发生。葡萄球菌存在于皮肤表面,其作为一种微生物群的功能尚未得到广泛的研究。近几年研究表明,葡萄球菌细胞壁及细胞质膜的成分—脂磷壁酸(Staphylococcal lipoteichoic acid,LTA)可参与免疫调节反应[4]。磷壁酸是革兰氏阳性菌细胞壁重要组分,是由核糖醇和甘油残基经由磷酸二键相互连接而形成的多聚物,带有弱酸性,占细胞壁质量的10%~50%,根据磷壁酸在细胞壁表面上的结合部位可以分为2种类型,膜磷壁酸和壁磷壁酸,膜磷壁酸又称作LTA[5]。葡萄球菌LTA可抑制多种炎性反应的发生[6-7],但其对马拉色菌诱导的炎性反应有无影响尚不清楚。本研究首先观察糠秕马拉色菌对角质形成细胞细胞因子的表达的影响,进一步探究葡萄球菌LTA对于对糠秕马拉色菌引起炎性因子的表达的影响。
1 材料与方法
1.1 材料 人角质形成细胞系(HaCaT细胞)购于江苏凯基生物技术股份有限公司,糠秕马拉色菌(ATCC®14521TM)购于美国ATCC公司,DMEM培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、胰酶(美国 HyClone公司),Cell Proliferation Assay、miRNeasy Mini Kit试剂盒、GoScript®Reverse Transcription System、GoTaq®qPCR Master Mix(美国 Promega公司),RIPA裂解液、BCA蛋白浓度测定试剂盒、蛋白标准品(上海碧云天公司),预制胶、SDS-PAGE蛋白上样缓冲液(6×)、预染蛋白质分子量标准、NuPAGE®MES(20×)、NuPAGE®LDS Sample Buffer(4×)、NuPAGE®Reducing Agent(10×)、半干转膜、ECL(美国 Life Technologies公司),Protein Ladder(美国Thermo公司),10XTBST(上海生工公司),脱脂奶粉(美国BD公司),Human IL-6酶联免疫吸附测定(ELISA)Kit、Human IL-1β ELISA Kit(美国 R&D Systems公司),葡萄球菌LTA购于美国Sigma公司。
1.2 方法
1.2.1 HaCaT细胞培养 ①复苏:液氮中取出冻存的细胞,快速放入37℃的水浴中,不停晃动,使其快速解冻。
②将细胞悬液移入离心管中,加等体积的DMEM培养基,室温离心1 000 r/min,离心半径10 cm,离心3 min,弃上清液,重悬细胞沉淀,计数后移入培养瓶中,37℃,5%CO2静置培养。
③细胞长满瓶底70%左右时,胰酶消化并传代细胞。
④以3×105个细胞/孔接种到6孔板中,分3组,分别为对照组、糠秕马拉色菌处理组、LTA和糠秕马拉色菌处理组。每组3个附孔,待细胞贴壁后换液(培养基不含抗生素),LTA和糠秕马拉色菌处理组细胞换含有20 μg/mL LTA的培养基,培养12 h。
⑤弃上清,PBS洗2次,准备与糠秕马拉色菌共培养,对照组直接加入细胞培养基。
1.2.2 糠秕马拉色菌与HaCaT细胞共培养 将糠秕马拉色菌接种于改良Dixon培养基,传代后培养72 h用血细胞计数仪计数,无菌PBS洗2次后,用细胞培养基重悬糠秕马拉色菌,按细胞与糠秕马拉色菌(10∶1)比例将糠秕马拉色菌加入到LTA和糠秕马拉色菌处理和糠秕马拉色菌处理组中,与HaCaT细胞共培养。
1.2.3 单溶液细胞增殖检测试剂盒(MTS)检测细胞活性 ①取对数生长期的HaCaT细胞,接种于96孔板中,每孔约为5×103个细胞,共4组,每组细胞5个复孔。重复4次,即共接种于4块96孔板中,在5%CO2,37℃培养箱中常规培养过夜。细胞贴壁后,加入不同浓度比例(糠秕马拉色菌与HaCaT细胞的比例为 20∶1、10∶1、5∶1)的糠秕马拉色菌。分别于培养后的第0、1、2、3天进行检测,加入MTS溶液20μL,5%CO2,37℃培养箱中孵育4 h。
②另取对数生长期的HaCaT细胞,接种于96孔板中,每孔约为5×103个细胞,共2组,每组细胞5个复孔。重复4次,即共接种于4块96孔板中,与5%CO2,37℃常规培养过夜,细胞贴壁后,实验组每孔加入20 μg/mL LTA。分别于培养后的第0、6、12、24 h 进行检测,加入 MTS 溶液 20 μL,5%CO2,37 ℃培养箱中孵育4 h。
③检测吸光度OD490nm值。
1.2.4 RNA的提取 ①向对照组、糠秕马拉色菌处理组、LTA和糠秕马拉色菌处理组细胞中加入QIAzol®lysis裂解液,每孔 700 μL,震荡混匀后室温静置5 min。
②继续加入140 μL氯仿,涡旋混合震荡15 s,室温孵育静置3 min。
③4℃ 12 000 r/min,离心半径 10 cm,离心15 min。
④将上层水相移入另一个新的EP管中,加入525 μL无水乙醇,充分混匀。
⑤吸取700 μL液体移置RNeasy Mini柱中,室温离心8 000 r/min,离心半径10 cm,离心15 s,弃废液。
⑥重复上述步骤,将剩余样品全部转移至过滤柱内。
⑦加入700 μL Buffer RWT,室温离心10 000 r/min,离心半径10 cm,离心15 s,弃废液。
⑧加入500μL Buffer RPE,室温离心8000r/min,离心半径10 cm,离心15 s,弃废液。
⑨重复步骤⑧,室温离心1 000 r/min,离心半径10 cm,离心 2 min。
⑩将离心柱放入新的收集管,12 000 r/min,离心半径10 cm,离心1 min。
[11]将离心柱置入新的去RNA酶EP管,加40μL RNase free H2O,10 000 r/min,离心半径 10 cm,离心1 min。
[12]测定其浓度及纯度,-80℃保存备用。
1.2.5 反转录合成cDNA ①逆转录反应体系见表1。

表1 逆转录反应体系
RT-Mix配好后,混匀,每份RNA样本加入12μL RT-Mix,用Nuclease-Free Water将体系补足至20μL。
②反应条件:
延伸 42℃ 15 min
反转录酶灭活 70℃ 15 min
cDNA临时存储 4℃
1.2.6 实时荧光定量聚合酶链反应(Rt-PCR) 采用SYBR-Green法进行RT-PCR扩增。
①引物设计见表2。

表2 引物序列
②荧光实时定量反应体系见表3。
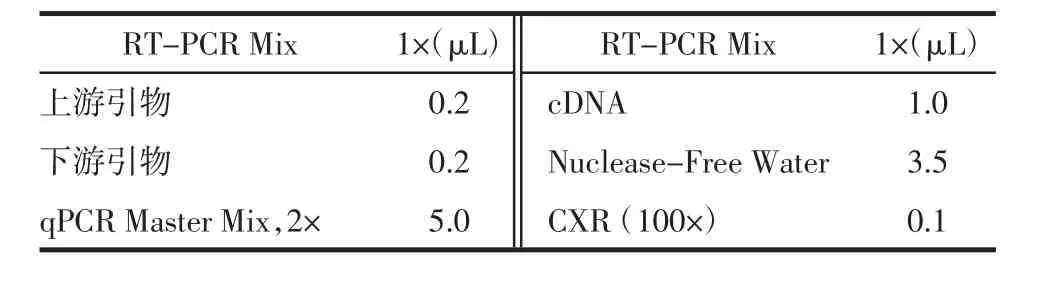
表3 PCR反应体系
③RT-PCR反应条件:
95℃ 2 min
95℃ 15 s 40个循环
60℃ 2 min
④溶解曲线。
1.2.7 ELISA ①从已经平衡至室温的密封袋中取出微孔板。
②先将标准品稀释成不同浓度的工作液,按照标准曲线中的浓度加入孔中。分别将对照组、糠秕马拉色菌处理组、LTA和糠秕马拉色菌处理组细胞的培养上清加入孔中,每组3个附孔,每孔100 μL,用封板胶纸封住反应孔,室温孵育2 h。
③将板内液体吸去,使用洗瓶、多通道洗板器或自动洗板机洗板。每孔加洗涤剂400 μL,然后板内洗涤液吸去。重复操作4次。
④在每个微孔内加入200 μL酶标检测抗体。用封板胶纸封住反应孔,室温孵育2 h。
⑤重复洗板操作。
⑥在每个微孔内加入200 μL显色底物,室温孵育20 min。在每个微孔内加入50 μL终止液1,孔内溶液颜色会蓝色变为黄色。
⑦加入终止液1后20 min内,使用酶标仪测量OD450nm值,设定OD540nm作为校正波长。
⑧每一个标准品及样品的复孔校正吸光值(OD450nm-OD540nm)取平均值,再减去标准曲线零点的OD值。绘制线性标准曲线,曲线横坐标为标准曲线点的人细胞因子的浓度值,纵坐标为标准曲线点的OD平均值。通过样本的OD值,依据标准曲线上得到检测样本中细胞因子的浓度。
1.2.8 统计学分析 应用GraphPad Priam 6.0软件对数据进行分析及图表绘制,每组样本采用均值±标准误(Mean±SEM)来表示,2组比较采用非配对t检验,组间比较采用单因素方差分析。P<0.05时为差异有统计学意义。
2 结果
2.1 糠秕马拉色菌及LTA对HaCaT细胞细胞活性的影响 MTS实验结果显示,当共培养的糠秕马拉色菌与HaCaT细胞比例在20∶1以下时,糠秕马拉色菌对HaCaT细胞活性无明显影响。当糠秕马拉色菌与HaCaT比例达到20∶1时,会抑制HaCaT细胞的细胞活性,特别是在共培养后的第1天(P<0.05),在共培养的第2天及第3天,HaCaT细胞活性下降(P>0.05),见图1A。由于糠秕马拉色菌与HaCaT细胞比例在10∶1共培养时,对细胞活性无影响,笔者选择10∶1(糠秕马拉色菌:HaCaT)这个比例进行后续实验。
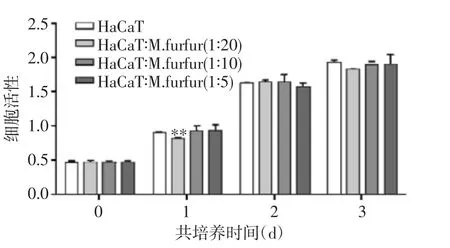
图1A 糠秕马拉色菌对HaCaT细胞活的影响
通过MTS实验发现,与正常培养的细胞相比,20 μg/mL的LTA对HaCaT细胞的细胞活性在作用的24 h内无影响,见图1B,故采用该浓度进行后续实验。
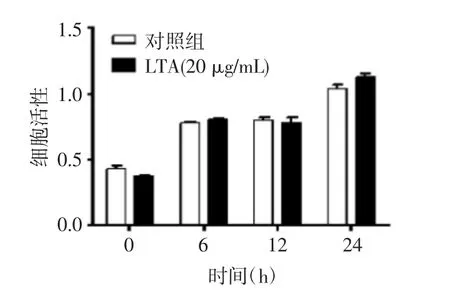
图1B 20 μg/mL的LTA对HaCaT细胞的细胞活性影响
2.2 糠秕马拉色菌对HaCaT细胞炎性因子表达的影响 将糠秕马拉色菌与HaCaT细胞按照10∶1的比例共培养后,在 1、2、4、8、12、24 h 提取 mRNA。Rt-PCR结果显示HaCaT细胞细胞因子TNF-α mRNA表达水平在8 h下降(P<0.05)。IL-8 mRNA表达水平在8 h升高,在24 h升高约4倍(P<0.001)。IL-6 mRNA表达水平在1 h升高约6倍(P<0.01),之后逐渐下降。IL-1β mRNA 表达水平在1 h(P<0.05)和2 h升高约2倍(P<0.01),见图2。综上,笔者发现糠秕马拉色菌可在1 h内诱导HaCaT细胞细胞因子IL-6及IL-1β mRNA表达上调。
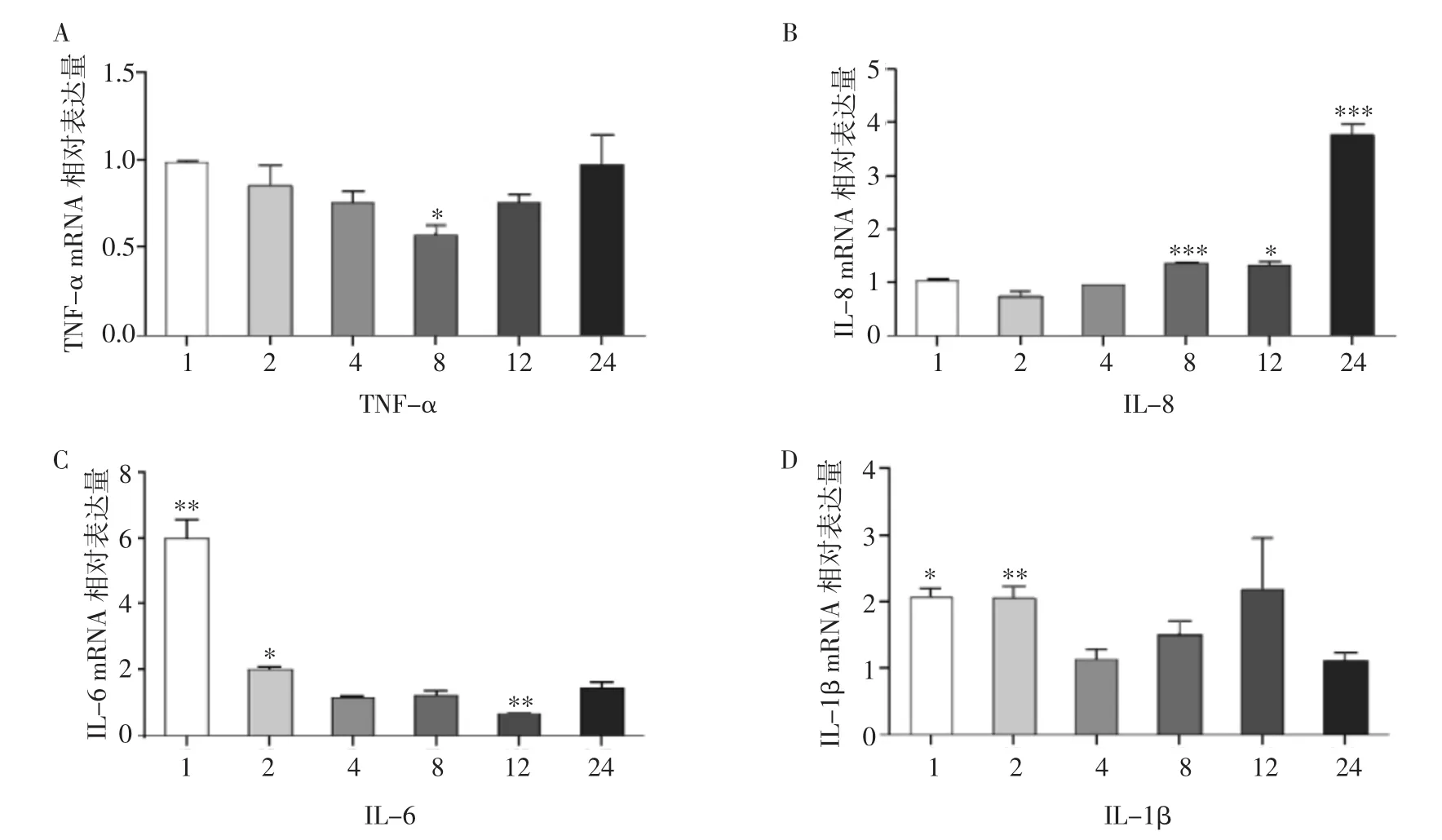
图2 糠秕马拉色菌对HaCaT细胞细胞因子(TNF-α、IL-8、IL-6、IL-1β)mRNA表达的影响
2.3 葡萄球菌LTA抑制糠秕马拉色菌诱导的IL-6及IL-1β mRNA表达 HaCaT细胞经过LTA预处理12 h后,将糠秕马拉色菌加入,共培养1h后检测HaCaT细胞IL-6及IL-1β mRNA表达。结果显示,与糠秕马拉色菌处理组相比,LTA和糠秕马拉色菌处理组HaCaT细胞IL-6及IL-1β mRNA的表达下降(P<0.05),见图3。
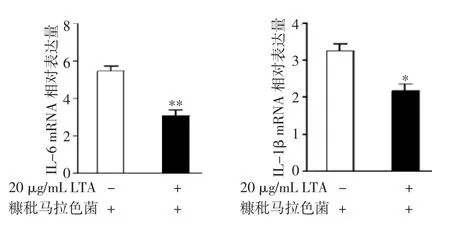
图3 LTA对糠秕马拉色菌诱导IL-6(A)及IL-1β(B)mRNA表达的影响
2.4 糠秕马拉色菌和LTA对HaCaT细胞上清中IL-6及IL-1β分泌的影响 通过ELISA方法检测上清细胞因子,与正常培养的HaCaT细胞相比,糠秕马拉色菌可以诱导HaCaT细胞分泌IL-6。在糠秕马拉色菌与HaCaT细胞共培养的第4 h,IL-6浓度最高(P<0.001)。经过LTA预处理的HaCaT细胞,与糠秕马拉色菌共培养后,与糠秕马拉色菌处理组相比较,IL-6分泌明显减少(P<0.001),见图4A。在糠秕马拉色菌与HaCaT细胞共培养的多个时间点提取的上清中,前12 h未能检测到IL-1β的分泌。在共培养24 h后,可以检测到IL-1β低浓度的分泌,见图4B。
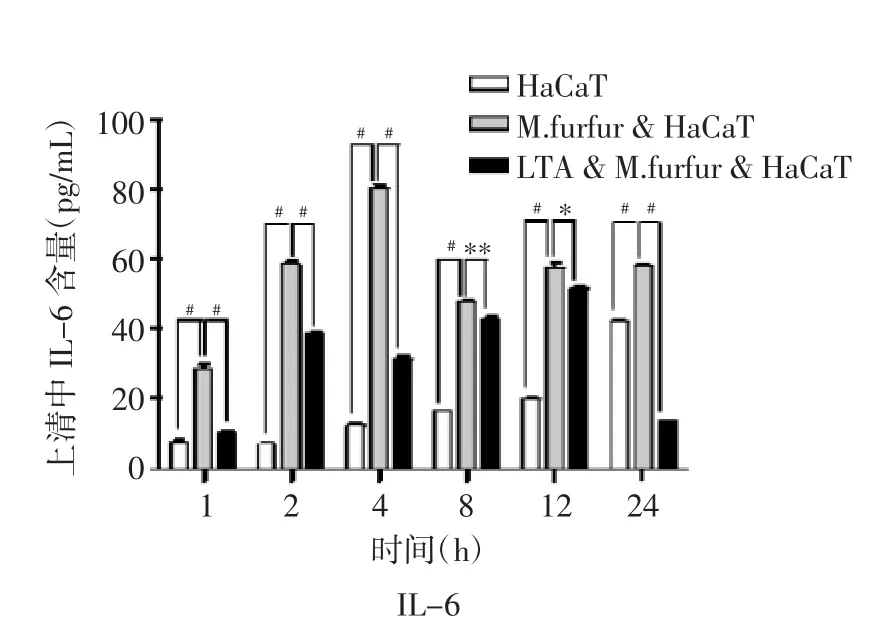
图4A LTA和糠秕马拉色菌(10∶1)对HaCaT细胞分泌的IL-6的影响(M.furfur为糠秕马拉色菌)
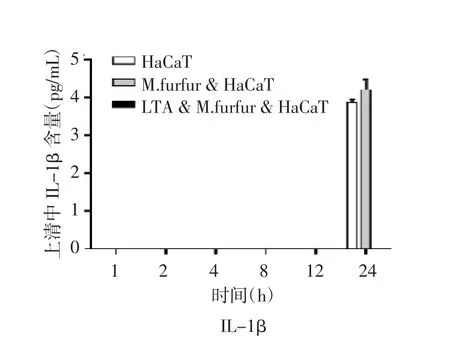
图4B LTA和糠秕马拉色菌(10∶1)对HaCaT细胞分泌的IL-1β的影响(M.furfur为糠秕马拉色菌)
3 讨论
马拉色菌是人体和温血动物皮肤表面的常住菌,也是一种条件致病菌。尽管马拉色菌的致病机制还没有被完全揭开,目前获得较多支持的2种学说是:①以脂肪酶为媒介发挥致病作用。②诱导宿主细胞产生炎性因子介导炎性反应。马拉色菌可诱导角质形成细胞产生多种细胞因子,参与介导炎性反应[8]。本研究发现,糠秕马拉色菌可在短时间内诱导HaCaT细胞IL-6和IL-1β mRNA表达上调,共培养8 h后可以上调IL-8 mRNA表达,共培养后的上清中可检测到IL-6分泌增多。IL是一个有α螺旋结构、22~28 kDa磷酸化和不同程度糖基化的多功能细胞因子,在疾病急性期反应、炎性反应、造血、骨代谢以及癌症恶化等方面起重要作用[9]。IL-6与TNF-α和IL-1一同可引起急性炎性反应。IL-1β是一种重要的介导炎性因子的细胞因子,可由人的HaCaT细胞大量表达,在皮肤的免疫应答中处于较上游的环节,可以诱导多种趋化因子的合成,并可加强T细胞增殖和B细胞生长与分化,有广泛的免疫调节作用[10-11]。IL-8是一种常见的炎性因子和趋化因子,其可趋化中性粒细胞或单核细胞参与局部炎性反应[12]。笔者研究发现糠秕马拉色菌与HaCaT细胞共培养后可诱导HaCaT细胞多种炎性因子表达上调。葡萄球菌是在人体皮肤表面的定植的正常菌群,其与皮肤之间存在着紧密的联系。表皮葡萄球菌细胞壁的LTA成分,在多种疾病中发挥抗炎作用。研究发现,表皮葡萄球菌LTA能够激活角质形成细胞的TLR2产生肿瘤坏死因子受体相关因子(TRAF)1,其可被TLR3激活的丝氨酸蛋白酶Caspase-8切割并释放出有活性的N端(N)-TRAF1,N-TRAF1可与TLR3信号通路中的关键分子Toll/IL-1受体结构域接头分子(TRIF)相结合,发挥抑制TLR3信号通路的作用,从而减轻创伤部位TLR3引起的炎性因子[6]。Xia等[7]研究发现在痤疮发病中,痤疮丙酸杆菌通过诱导角质形成细胞TLR2表达促进IL-6和TNF-α的表达,引起炎性反应,而表皮葡萄球菌LTA可以在激活TLR2表达的同时,通过高表达的TLR2诱导miR-143表达,miR-143靶向作用于 TLR2的3’-非翻译区(3’UTR),降低TLR2 mRNA的稳定性,最终抑制TLR2表达,减轻痤疮丙酸杆菌通过TLR2引起的细胞因子的表达,减轻炎性反应。通过本研究,笔者发现葡萄球菌LTA可以抑制糠秕马拉色菌诱导的炎性因子IL-6、IL-1β mRNA表达,抑制糠秕马拉色菌诱导IL-6分泌。
在皮肤常驻菌群中,表皮葡萄球菌占细菌菌群总量最大,马拉色菌占真菌菌群总量较大。在脂溢性皮炎/头皮屑皮损处,这2种菌群均出现定植比例失衡[13],对2种菌群相互作用的研究有助于进一步了解菌群失衡相关皮肤疾病的病因及发病机制。有报道在特定的环境下,马拉色菌可通过改变其本身酶活性影响表皮葡萄球菌的增殖[14],本研究发现葡萄球菌LTA可以抑制糠秕马拉色菌诱导的炎性因子的表达,从菌群相互作用的角度揭示了这2种菌群新的互作方式,但其机制有待进一步研究。

