柑桔黄龙病菌的重组酶聚合酶扩增(RPA)检测
段 玉,马志敏,许建建,宾 羽,宋 震,周常勇
(西南大学柑桔研究所/中国农业科学院柑桔研究所,重庆,400712)
柑桔黄龙病(Citrus Huanglongbing,HLB)最先由泽田兼吉[1]报道在我国台北发生,1919年Reinking[2]报道该病在我国广东潮州亦有发生,迄今已有百余年发生史。柑桔黄龙病病原为韧皮部杆菌,属革兰氏阴性细菌(CandidatusLiberibacter)[3],在田间自然传播主要通过媒介——亚洲柑桔木虱(DiaphorinacitriKuwayama)[4]进行,能为害几乎所有的柑桔种类。柑桔黄龙病的病原目前仍不能分离纯培养,植株染病后也无有效治疗药剂,其有效防控手段为及时清除病树、种植无病苗木和集中大面积防治传播媒介[5]。因此,通过建立快速简便的黄龙病菌检测方法,实现黄龙病的早发现、早诊断,对该病的防控具有重要意义。
针对柑桔黄龙病菌,研究人员已建立了多种分子检测方法,如利用黄龙病菌16 S rRNA、β-操纵子(rplKAJL-rpoBC)和外膜蛋白(omp)基因等保守基因序列设计特异性引物建立了聚合酶链式反应(Polymerase Chain Reaction,PCR)[6]、Nested-PCR[7]、实时荧光PCR[8]、数字PCR[9]等检测方法。这些检测方法除对仪器要求高和耗时长外,对操作者也有一定的技术要求。环介导等温扩增法(Loop-Mediated Isothermal Amplification,LAMP)突破了仪器障碍[10],但探针和6对引物的设计较复杂。近年来,一种新型的等温核酸扩增技术——重组酶聚合酶恒温扩增(Recombinase Polymerase Amplification,RPA),因具备快速、灵敏、操作简便的特点而受到关注,并且已经广泛应用于动植物的病害检测,如产单核细胞李氏杆菌的RPA-LF[11]、小肠结膜炎耶尔森氏菌的实时荧光RPA[12]。
柑桔黄龙病菌的RPA荧光检测技术也已建立[13],其在对柑桔核酸进行粗提取后,运用重组聚合酶对目的基因片段进行恒温快速扩增,加入稀释后的荧光试剂在15 min内完成可视化检测。然而,本实验室在运用该方法的过程中发现,其效果不佳,具体表现为:健康对照和水对照背景荧光强烈;当黄龙病菌的核酸浓度较低时,在荧光判定上会出现检测人员的主观偏差;为避免粗提取的DNA被降解,在核酸粗提取过程中需要操作连贯迅速,对试验技术的要求较高。因此,该方法有进一步优化的必要。
本研究根据黄龙病菌株psy62全基因组的保守基因序列设计引物,建立黄龙病菌的RPA快速检测法,避免了检测判断偏差问题,同时兼顾了检测速度、检测灵敏度和操作简便性。
1 材料与方法
1.1 供试材料、试剂及仪器样品材料:柑桔衰退病毒(Citrustristezavirus,CTV)、柑桔黄化脉明病毒(Citrusyellowveinclearingvirus,CYVCV)、柑桔裂皮类病毒(Citrusexocortisviroid,CEVd)、柑桔碎叶病毒(Citrustatterleafvirus,CTLV)和温州蜜柑萎缩病毒(Satsumadwarfvirus,SDV)材料由西南大学柑桔研究所提供,柑桔溃疡病(病原Xanthomonascitrisubsp.citri,Xcc)材料来自于重庆的柑桔送检样品,柑桔黄龙病(病原CandidatusLiberibacter asiaticus,CLas)疑似样品分别来自云南、四川、广西和江西赣州等地的柑桔送检枝叶。
主要试剂:Biospin全能型植物基因组DNA提取试剂盒;多糖多酚植物总RNA提取试剂盒,购自天根生化科技(北京)有限公司;2×Taq PCR MasterMix,购自Novoprotein;GoTaq®qPCR Master Mix,购自Promega;英国TwistDx Inc公司的重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)试剂盒;其余试剂均为分析纯。
1.2 引物设计根据黄龙病菌株psy62全基因组中的单拷贝tufB-secE-nusG-rplKAJL-rpoB基因簇序列和5拷贝核糖核苷酸还原酶β亚基基因(ribonucleotide-diphosphatereductasesubunitbeta,nrdB)序列(NC_012985.3),通过Premier 5.0软件分别设计了2对和3对引物(见表1)。设计引物时退火温度宽泛,避免发生错配、二聚体和发卡结构,引物长度在30~35 bp之间,扩增产物在130~180 bp之间。
1.3 阳性样品制备取50 mg疑似黄龙病柑桔样品,按照DNA提取试剂盒的说明书提取总核酸,用OI1/OI2c引物进行检验,将阳性样品核酸保存于-20 ℃备用。
1.4 特异性引物筛选RPA检测体系:模板核酸2.5 μL,上下游引物各2.4 μL,primer-free rehydration buffer 29.5 μL,加无酶水补足47.5 μL,充分混匀;加入280 mmol/L醋酸镁(MgOAc)2.5 μL,充分振荡混匀,瞬时离心10 s,39 ℃ 20 min;加入上述反应体系等体积的三氯甲烷,充分混匀,离心2 min;吸取10 μL上清产物,用2.5%的琼脂糖凝胶电泳分析。将设计的5对引物按照RPA检测体系进行筛选。
1.5 检测特异性评价根据RNA提取试剂盒的说明提取CTV、CYVCV、CEVd、CTLV和SDV侵染植株的核酸,根据DNA提取试剂盒提取Xcc和CLas侵染植株的总核酸,用“1.4”建立的RPA方法进行检测,评价检测特异性。
1.6 RPA产物序列分析将检测为黄龙病菌阳性的RPA反应产物进行测序,由华大基因公司完成。将测序结果与NCBI中随机选取的6个黄龙病菌株的相应基因序列进行比对分析。
1.7 检测灵敏度评价选取黄龙病菌阳性样品的核酸为模板,按10倍梯度稀释,分别采用试验建立的RPA、普通PCR及实时荧光PCR检测方法进行平行检测,比较检测灵敏度。RPA检测体系参考“1.4”中的检测体系。普通PCR引物OI1/OI2c及检测体系参考Jagoueix等[6],略有改动:核酸2 μL,10 μmol/L的OI1和OI2c各0.3 μL,2 × Taq PCR Master Mix 5 μL,加无酶水补足10 μL。94 ℃ 5 min;94 ℃ 30 s、64 ℃ 30 s、72 ℃ 90 s,35个循环;72 ℃ 10 min,12 ℃保存。
实时荧光定量PCR引物HLBas/HLBr及体系参考钟晰[9]的实时PCR体系,略有改动:核酸2 μL,GoTaqμqPCR Master Mix 10 μL,10 μmol/L的HLBas/HLBr各0.4 μL,加无酶水补足20 μL。95 ℃ 5 min;95 ℃ 5 s、60 ℃ 30 s、72 ℃ 30 s,荧光收集15 s,35个循环。
1.8 田间样品检测验证来自四川、云南、江西和广西等地的柑桔送检样品共87份,品种类型包括沃柑、爱媛38(红美人)、春见、尤力克柠檬和一些未标明品种的杂柑、甜橙和柚。根据DNA提取试剂盒提取上述样品总核酸,采取“1.7”的反应体系同时进行RPA、PCR和实时荧光PCR检测,统计比较不同检测方法的黄龙病菌检出率。
2 结果与分析
2.1 RPA引物筛选以黄龙病菌阳性核酸为模板,并设立健康对照和水对照,用设计的5对引物按照“1.4”的体系进行RPA扩增。结果显示,引物对RPAHF2/RPAHR2和RPAHF5/RPAHR5均能从所有阳性样品中扩增出单一特异条带,RPAHF1/RPAHR1和RPAHF4/RPAHR4仅能从1个阳性样品中扩增出目标条带,RPAHF3/RPAHR3无扩增条带,清水和健康对照无目标条带(图1)。故选择引物对RPAHF2/RPAHR2和RPAHF5/RPAHR5分别进行后续试验。
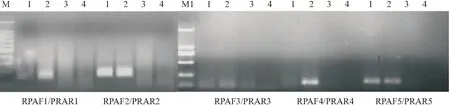
注:M:100 bp标准分子量;M1:2 000 bp标准分子量;1~2:黄龙病菌阳性核酸;3:健康对照;4:水对照。图1 供试5对引物用于柑桔黄龙病菌阳性核酸RPA的电泳结果
2.2 RPA检测体系的特异性评价利用引物对RPAHF2/RPAHR2和RPAHF5/RPAHR5分别对Xcc、CEVd、CTLV、CYVCV、CTV、SDV和CLas的阳性核酸样品进行RPA检测。电泳结果显示,引物对RPAHF5/RPAHR5能特异性检出CLas,而其他柑桔病原物(Xcc、CEVd、CTLV、CYVCV、CTV和SDV)样品检测呈阴性;引物对RPAHF2/RPAHR2在CEVd、CYVCV和SDV处有非特异条带(图2)。因此,引物对RPAHF5/RPAHR5的特异性较好,用于后续的黄龙病菌检测。
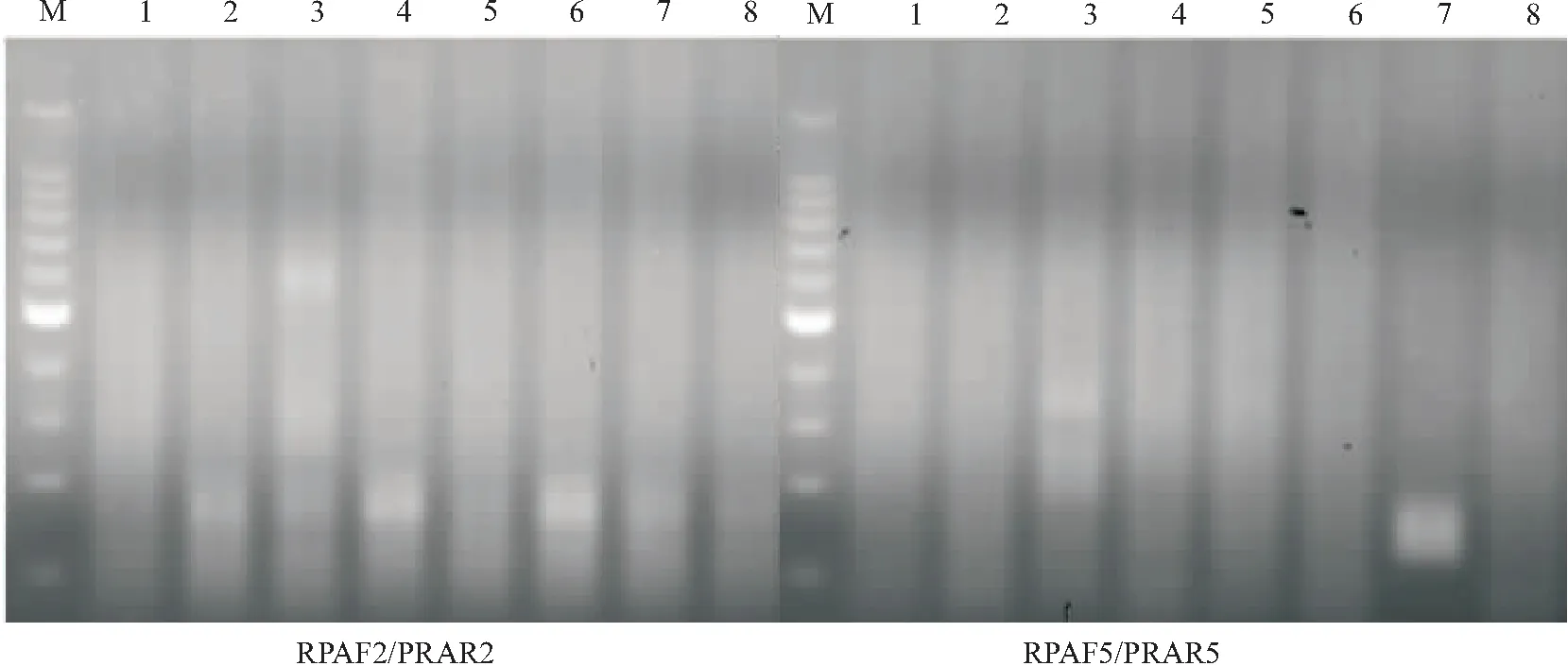
注:M:100 bp标准分子量;1:柑桔溃疡病;2:柑桔裂皮类病毒;3:柑桔碎叶病毒;4:柑桔黄化脉明病毒;5:柑桔衰退病毒;6:温州蜜柑萎缩病毒;7:柑桔黄龙病;8:水对照。图2 RPA检测体系的特异性评价
2.3 RPA扩增产物序列分析将采用RPAHF5/RPAHR5进行RPA扩增出的产物,经电泳分离和切胶纯化,送公司测序。结果表明,RPA产物为145 bp,与目标片段大小吻合。将所获序列与在NCBI中随机选取的6个黄龙病菌株的相应序列(A4,CP010804.2;AHCA1,CP029348.1;JXGC,CP019958.1;Ishi-1 DNA,AP014595.1;gxpsy,CP004005.1;psy62,CP001677.5)进行比对的结果表明,本试验所扩增序列与其他6个序列的同源性为99.31%,为黄龙病菌(CLas)的目标序列(见图3)。

图3 基于RPAHF5/RPAHR5的RPA产物序列与NCBI中多个黄龙病菌株基因序列的比较
2.4 RPA灵敏度检验将柑桔黄龙病阳性样品HLB-1核酸进行梯度稀释,通过普通PCR检测,选取稀释29倍的HLB-1核酸,经检测其浓度为1.8×102μg/μL。以上述浓度的HLB-1核酸为模板,10倍梯度稀释后开展检测的结果表明,RPA可检测的最低核酸浓度为1.8×10-3μg/μL(见图4中),与实时荧光PCR相同(见图4右),普通PCR可检测的最低核酸浓度为1.8×10-1μg/μL(见图4左)。可见,RPA与实时PCR的检测灵敏度相同,均为普通PCR检测灵敏度的100倍。
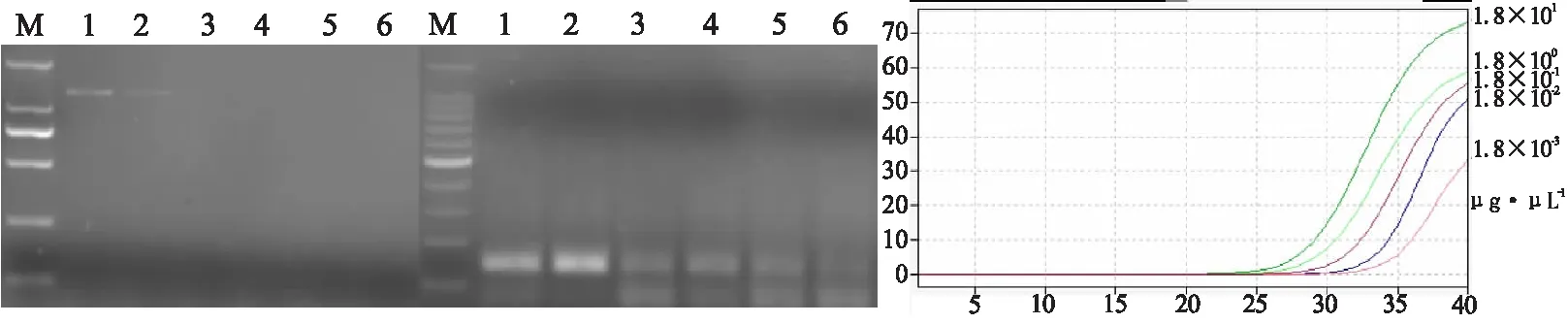
注:图左:PCR检测;图中:RPA检测;图右:实时荧光PCR检测;M左:2 000 bp标准分子量;M中:100 bp标准分子量;1~6:浓度为1.8×102 μg/μL黄龙病阳性核酸按10倍数梯度稀释后的核酸模板;坐标轴横轴:实时荧光PCR的循环数;曲线标注为黄龙病菌亚洲种核酸的浓度。图4 RPA检测体系的灵敏度
2.5 田间样品检测验证将来自四川、云南、江西和广西的87份疑似黄龙病样品提取核酸后,采用RPA、实时荧光PCR和普通PCR 3种方法进行平行检测。结果表明,不同来源地的样品,RPA和实时PCR检测结果一一对应,而普通PCR存在漏检现象(见表2)。可见,建立的RPA检测方法稳定可靠,灵敏高效。
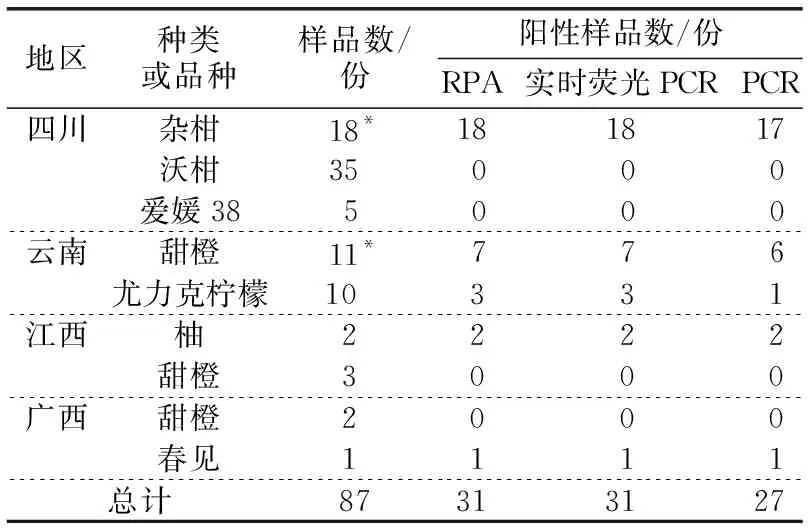
表2 来自不同产地的柑桔样品采用不同方法进行黄龙病检测的结果
3 讨论
快速准确检测柑桔黄龙病,是该病田间防控和实验室研究的基础。黄龙病RPA荧光检测技术[13]实现了柑桔黄龙病的田间检测的可视化,但在健康对照和水对照上存在较强的背景荧光信号,在对阴性和柑桔黄龙病含量较低样品检测时,存在受检验者主观判断偏差影响。本研究建立的RPA检测方法,检测结果清晰明确,对黄龙病菌含量较低的样品也能精准检测,很好的避免了检测人员主观判断偏差的问题;与目前黄龙病菌检测普遍使用的普通PCR法和实时荧光PCR法相比,耗时短,操作简单,不需要精密仪器,并且检测特异性强,灵敏度和实时荧光PCR相当(比普通PCR高100倍);与恒温检测黄龙病菌的环介导等温扩增(LAMP)法相比,RPA法更省时,反应温度更低,引物设计更为简单。本研究建立的RPA快速检测方法丰富了国内柑桔黄龙病菌的检测方法。
郑正[14]在对nrdB基因的研究中发现,nrdB是黄龙病菌基因组中拷贝数最多的基因之一。几乎所有已经发表的黄龙病菌株(SGCA5菌株除外)的基因组上均含有5拷贝nrdB基因,且nrdB基因在柑桔黄龙病菌株的系统分类鉴定上和16S rRNA基因具有相对稳定的进化关系,可以用于该病原菌的检测。与基于单拷贝基因设计的引物相比,基于nrdB基因设计的引物在黄龙病菌检测上具有更高的灵敏度。本研究根据黄龙病菌基因组保守序列设计了5对引物,筛选出1对以多拷贝nrdB基因序列为靶标的特异性引物RPAHF5/RPAHR5,建立了黄龙病菌的RPA检测方法。
在本研究中,黄龙病阳性样品大多来自四川和云南。其中,四川18份杂柑样品是从宜宾市送检的356份样品中筛选出的有明显黄龙病症状的样品,故检出率100%,因此,不能据此认为四川黄龙病发病率高。为了更好地检验本研究建立的RPA检测法的适用性,今后应进行更多地区和更多样品的检测。
本研究筛选的引物RPAHF5/RPAHR5对柑桔黄龙病菌(CLas)的特异性强,不会和柑桔其他6种常见病害发生非特异性反应,在田间样品的检测中也未发生非特异性反应现象。需要注意的是,在PCR反应中只需要几个DNA分子做模板就可以大量扩增[15],而RPA比普通PCR灵敏100倍,故RPA也可能带来假阳性问题。在混匀反应液的过程中,RPA试剂盒是八连管设计,在开盖和关盖的过程中八连管的密封性容易降低,特别是在震荡混匀过程中极易爆盖而导致样品污染。建议采用将样品多次上下颠倒混匀后瞬时离心15 s,以取代震荡混匀过程。这样可有效地避免因震荡过程中样品管盖子爆开导致的污染问题。
4 结论
本研究建立了基于特异性引物RPAHF5/RPAHR的黄龙病菌RPA快速检测方法,通过特异性、灵敏度和田间样品检测验证了该法具有特异性强、灵敏度高、检测结果可靠等特点,且不需特殊仪器设备,对操作者的技术要求较低,适宜用于基层人员对黄龙病菌的快速检测。

