皮肤软组织感染耐甲氧西林金黄色葡萄球菌SCC mec分型和同源性分析
汪轩轩,黄 颖,胡媛媛,陈 鹤,王中新,徐元宏
皮肤软组织感染(skin and soft tissue infections,SSTI)是化脓性病原菌感染表皮、真皮及皮下组织引起的炎症性疾病,包括从浅表性感染至坏死性感染。有研究表明坏死性SSTI截肢率为12%~20%,死亡率为6%~33%。引起SSTI最常见致病菌是金黄色葡萄球菌,其中25%为耐甲氧西林金黄色葡萄球菌(MRSA)。MRSA中的葡萄球菌染色体mec盒(SCC mec)是一个可移动的遗传元件,包含两个基本的遗传成分(mec基因复合体和ccr基因复合体)。根据mec和ccr基因复合体组合SCCmec可分为 I~V型。SCC mec中含有多种耐药基因和位于mec基因复合体的甲氧西林耐药(mecA)基因,与MRSA的传播和多重耐药密切相关。通过SCC mec类型可区分医院获得性MRSA(HA-MRSA)和社区获得性MRSA(CA-MRSA)。因此,SCCmec分型做为一种分子工具是了解MRSA分子流行病学的基础。现对SSTI住院患者分离的MRSA菌株进行SCC mec分型并了解其耐药情况,同时分析菌株间的同源性,为临床合理规范使用抗生素及医院感染控制提供依据。
1 材料与方法
1.1 菌株来源
收集2019年6月-2020年9月安徽医科大学第一附属医院检验科保存的从SSTI患者中分离的MRSA共44株,剔除同一患者相同部位分离的重复菌株,其中HA-MRSA 40株,CA-MRSA 4株。阴性质控菌株为ATCC25923,阳性质控为ATCC43300。CA-MRSA的判断标准根据《耐甲氧西林金黄色葡萄球菌感染防治专家共识》:从门诊、住院48 h内的患者中分离的MRSA菌株,既往无MRSA感染和定植病史,无留置导管或经皮的医疗装置,无血透和手术史,1年内未住入医院、养老院。不符合上述标准判断为HA-MRSA。1.2 仪器与试剂
1
.2
.1
主要仪器 东胜龙ETC 811基因扩增仪(苏州东胜兴业科学仪器有限公司);MULTIFUGE X1R高速冷冻离心机、HERAcell-240i CO培养箱(美国赛默飞世尔科技公司); DYY-60型电泳仪(北京六一生物科技有限公司);JS-2000紫外线凝胶成像仪(上海培清科技有限公司); Vitek 2 Compact全自动细菌鉴定及药敏分析仪、Vitek MS质谱仪(法国梅里埃公司)。1
.2
.2
主要试剂 Mlutiplex PCR Kit(德国QIAGEN生物公司);2×Pro Taq Master Mix含染料、GL DNA marker 2000、GoldView核酸凝胶染料、琼脂糖凝胶(湖南艾科瑞生物有限公司);哥伦比亚血平板(合肥天达诊断试剂有限公司); GL DNA marker 1000(山东思科捷生物技术有限公司);药敏纸片(英国Oxoid公司);引物购自上海生工生物公司。1.3 方法
1
.3
.1
MRSA鉴定及药敏分析 菌株复苏后四区划线接种在哥伦比亚血平板上,37 ℃培养箱培养16~18 h,挑取单个菌落用Vitek MS质谱仪重新鉴定。药敏结果采用头孢西丁药敏纸片扩散(K-B)法和革兰阳性球菌药敏卡片在Vitek 2 Compact仪器上分析。结果判读根据2018年美国临床和实验室标准化协会(CLSI)推荐的执行标准。1
.3
.2
提取模板DNA 挑取单个菌落5~8个于200 μl无菌去离子水中,在漩涡混合器上振荡混匀20 s,置于干式恒温器中100 ℃加热20 min,高速离心机15 000 r/min离心10 min,取100 μl上清液转移至新的无菌EP管中即为DNA模板。1
.3
.3
检测mecA基因 采用PCR方法检测模板DNA的mecA基因,引物序列参考文献见表1。反应体系为25 μl,包括2×Pro Taq Master Mix 12.5 μl,上下游引物(10 μmol /L)各1 μl,模板DNA 4 μl,无菌去离子水6.5 μl。反应条件为94 ℃ 30 s预变性;98 ℃ 10 s变性、50 ℃ 30 s退火、72 ℃ 1 min退火,35个循环;72 ℃ 2 min最终延伸。PCR产物进行1.2%琼脂糖凝胶电泳,置于紫外凝胶成像仪下观察,阳性菌株确证为MRSA。
表1 mec A基因和SCC mec分型引物序列表
1
.3
.4
SCC mec分型 采用多重PCR方法对模板DNA进行SCC mec分型,各引物序列参考文献见表1。反应体系为25 μl,包括2×QIAGEN Mlutiplex PCR Master Mix 12.5 μl,引物混合液(2 μmol /L)2.5 μl,模板DNA 4 μl,无菌去离子水6 μl。反应条件为95 ℃ 15 min预变性;94 ℃ 30 s变性、57 ℃ 90 s退火、72 ℃ 90 s延伸,35个循环;72 ℃ 2 min最终延伸。PCR产物进行1.5%琼脂糖凝胶电泳,置于紫外凝胶成像仪下观察结果。1
.3
.5
基质辅助激光解吸电离飞行时间质谱(MALDI-
TOF MS)同源性分析 菌株复苏后接种在哥伦比亚血平板上,37 ℃培养箱培养16~18 h,无菌接种环挑取少量菌落厚薄均匀涂布于靶板上,在菌膜未干燥时用1 μl CHCA基质液均匀覆盖菌膜表面,自然晾干后置于Vitek MS质谱仪上采用RUO模式检测。通过LaunchPad获得质谱,结果实时发送至SARAMIS,并通过VITEK MS SARAMIS Premium软件查看。将获得的图谱导入图谱数据库进行聚类分析,相似度< 70%的结果认为是不同的质谱型别。1.4 统计学处理
采用WHONET 5.6软件分析药物敏感性试验结果,SPSS 19.0进行数据统计分析,卡方检验确切概率法比较不同SCC mec类型MRSA耐药率的差异,P
<0.05 表示差异有统计学意义。2 结果
2.1 SSTI患者一般临床资料
44例SSTI患者中男性30例,女性14例,男女比例为2.1 ∶1。年龄为10个月~80岁,平均(42.59±21.96)岁,感染类型中术后切口感染17例(38.63%)、烧伤感染14例(31.82%)、皮疹和皮肤脓疱疮7例(15.90%)、外伤创面感染3例(6.82%)、骨髓炎2例(4.54%)、受压区压疮1例(2.27%)。2.2 mecA基因检测结果
44株MRSA进行经PCR扩增后mecA基因均为阳性,结果见图1。
图1 mecA检测结果M:GL DNA Marker 2000;1~6:随机抽取的菌株标本;7:阳性质控ATCC43300;8:阴性质控ATCC25923
2.3 SCC mec分型结果
经过多重PCR扩增后共分出Ⅱ、Ⅲ、Ⅳa三种类型。其中Ⅱ型5株(11.36%)、Ⅲ型12株(27.27%)、Ⅳa型8株(18.18%)、未分型19株(43.18%),各分型电泳结果见图2。已分型的25株MRSA中包含22株HA-MRSA和3株CA-MRSA,HA-MRSA中Ⅱ型5株(22.73%)、Ⅲ型11株(50.00%)、Ⅳa型6株(27.27%),CA-MRSA中Ⅲ型1株(33.33%)、Ⅳa型2株(66.67%)。
图2 SCC mec检测结果A、B、C:SCC mec Ⅲ、Ⅱ、Ⅳa型电泳条带;M:GL DNA Marker 1000;1~4:各型别随机抽取的4株标本
2.4 MALDI-TOF MS同源性分析
通过VITEK MS SARAMIS Premium软件对44株MRSA的蛋白图谱进行聚类分析并构建发育树。根据各菌株间相似度小于70%为不同类型的标准进行判别,44株MRSA分为两大簇;21号菌株为一簇,其他43株标本为另一簇,结果见图3,其中不同相似度的菌株科室分布见表2。
表2 不同相似区间的菌株科室分布表

图3 44株MRSAMALDI-TOF MS同源性分析
2.5 不同SCC mec类型的MRSA耐药结果
不同SCC mec类型MRSA对青霉素、苯唑西林、头孢西丁等β-内酰胺类抗生素均表现为耐药,对利奈唑胺和万古霉素均表现出敏感。3种类型的MRSA对环丙沙星、左氧氟沙星、庆大霉素和莫西沙星的耐药率差异有统计学意义。见表3。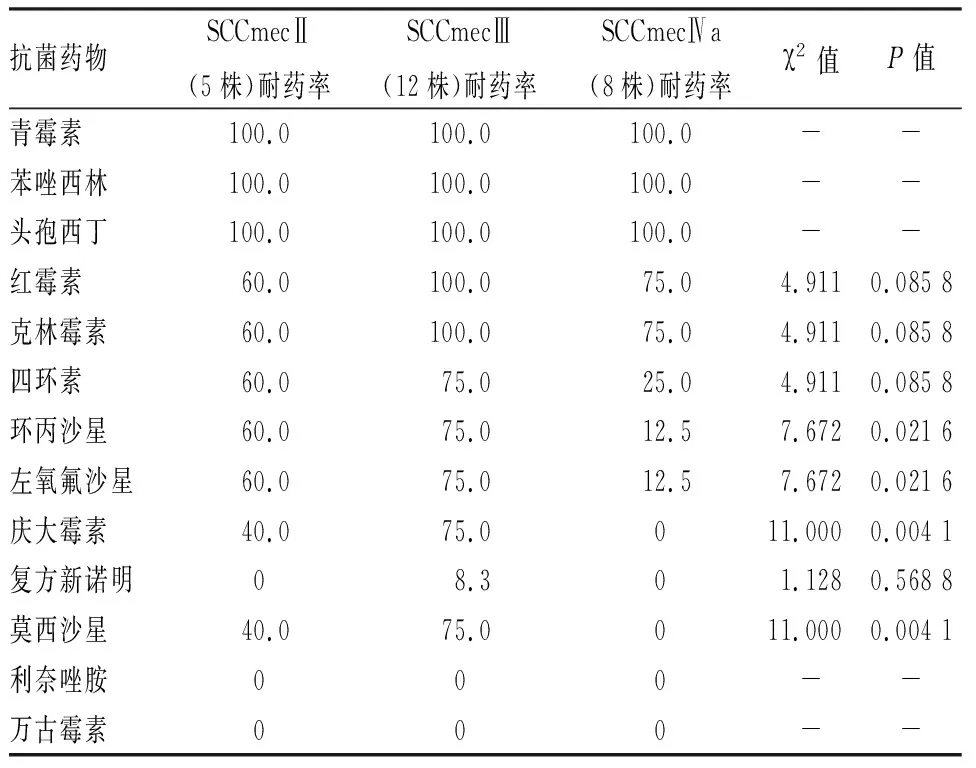
表3 不同SCC mec类型MRSA的耐药率(%)
3 讨论
本研究44例住院患者中38.63%为术后切口,38.63%为烧伤感染,主要由于皮肤屏障破坏,创面微环境形成了感染的温床,部分患者同时存在免疫力低下、糖尿病、慢性肾功能不全等高危因素。早期识别MRSA SSTI的高危人群并采取合理的治疗措施至关重要。
SCC mec基因目前主要分为 Ⅰ~Ⅴ型,本研究结果以Ⅲ型(27.27%)为主,其次为Ⅳa型(18.18%)和Ⅱ型(11.36%),与国内相关文献报道一致。但国内部分地区和日本以Ⅱ型为主,说明不同国家和地区有较大的差异。本研究中未分型菌株占43.18%,高于国内部分报道,可能与以下原因有关:① 由于部分菌株保存条件不当导致耐药基因缺失;② 随着不同抗菌药物的使用导致SCCmec出现新的型别或者亚型,目前实验条件尚未检测到,需要实验进一步验证。
本研究中共有HA-MRSA 40株,CA-MRSA 4株,说明本院以HA-MRSA感染为主。虽然研究表明HA-MRSA以SCCmec Ⅰ-Ⅲ型居多,CA-MRSA以SCCmec Ⅳ、V型居多,但本院SSTI患者中HA-MRSA Ⅳa型的比例(27.27%)超过了Ⅱ型(22.73%),CA-MRSA中也出现了Ⅲ型(33.33%),可见随着患者在社区和医院之间不断流动,HA-MRSA 与CA-MRSA 差异逐渐缩小。我国也有文献报道由Ⅳ、V 型引起的医院获得性感染正逐年增加,有超过由Ⅲ型引起医院获得性感染的趋势。其机制尚不明确,可能和以下原因有关:① Ⅳ、V型携带的耐药基因小,更容易对抗生素做出适应性改变;② Ⅳ、V型更有可能携带杀白细胞素(PVL)基因;③ Ⅳ、V型和 Ⅰ-Ⅲ型菌株相比,可表达更高水平的RNA Ⅲ,它是辅助基因调节系统(Agr)效应器,调节多种毒素的表达,在未接触抗生素的情况下保持毒力,接触抗生素后可用Agr活性来换取对甲氧西林的耐药性。
本研究显示SCCmec Ⅲ型和Ⅱ型总体耐药率较高,Ⅳa型相对较低,三种类型的MRSA对环丙沙星、左氧氟沙星、庆大霉素和莫西沙星的耐药率差异均有统计学意义。原因是Ⅱ型和Ⅲ型由于分子结构长,携带多种耐药基因呈多重耐药性,而 HA-MRSA中的Ⅳ型除 mecA 以外携带其他耐药基因较少。
本研究采用MALDI-TOF MS进行同源性分析将44株MRSA分为两大簇,其中43株均在一簇,仅21号菌株在另一簇,表明本院SSTI患者中的MRSA具有高度同源性。本研究中有7株MRSA相似度达到100%,并分布在不同病区,说明可能存在同一菌株在不同病区之间相互传播。从表2可以看出在不同相似区间,来自烧伤科的菌株均多于其他病区,因此烧伤科更应提高医务人员和患者控制感染的意识,严格执行消毒隔离制度,加强病区病原菌监测,避免细菌院内爆发感染。
4株CA-MRSA编号分别为33、14、29、3,其中33号菌株在70%~80%相似区间,14号菌株在80%~90% 相似区间,29号和3号菌株在90%~100%相似区间。查阅病史29号、3号菌株患者近两个月均有规律的医疗机构接触史,可能是造成与HA-MRSA菌株相似度较高的原因。MALDI-TOF MS技术是基于蛋白质水平对菌株鉴定分析,对不同菌株间同源性分析迅速,为判断是否发生院内感染提供依据。但其检测受多种因素影响,目前利用MALDI-TOF MS进行同源性分析仍属于研究阶段。脉冲场凝胶电泳(PFGE)分型通过检测染色体上所有酶切位点的变化反映全部基因的相关性,被认为是基因分型的“金标准”。本研究中利用MALDI-TOF MS同源性分析后期仍需要PFGE分型验证,以便进一步探讨MALDI-TOF MS技术在细菌同源性分析中的价值。

