西藏野生垂穗披碱草EnPLA1基因克隆与表达分析
姜惠娜, 敬 松, 李晗玉, 佘木子, 张新飞, 呼天明, 付娟娟*, 苗彦军
(1. 西北农林科技大学草业与草原学院, 陕西 杨凌 712100; 2. 西藏农牧学院动物科学学院, 西藏 林芝 860000)
温度是影响植物生长发育和产量形成的重要环境因子[1]。在全球气候变暖的大趋势下,气温变化异常,极端天气频繁出现,植物的寒冻灾害也日趋严重。细胞膜是植物感受外部环境刺激并作出反应的部位,同时也参与细胞感受外界环境刺激和信号传递[2]。低温胁迫导致细胞膜透性增大,膜脂过氧化作用加剧,细胞内活性氧积累,细胞代谢紊乱,严重时会造成植物的死亡[3-4]。
垂穗披碱草(ElymusnutansGriseb.)是寒冷地区草牧业发展的重要草种,广泛分布于青藏高原的野生居群,是研究抗逆机理的理想材料[5-6]。α-亚麻酸是ω-3系统的不饱和脂肪酸,在响应植物生长发育和生物与非生物胁迫应答方面具有重要的作用[7-8]。许多研究表明α-亚麻酸是茉莉酸合成的前体物质,茉莉酸能够通过核心转录因子(C-repeat binding factors,CBFs)依赖的信号途径诱导细胞内保护性物质如多胺、谷胱甘肽、花青素等积累,从而积极地调控植物的低温应答[9-10];而且茉莉酸也可能与乙烯、脱落酸、赤霉素等其他植物激素相互作用调控植物的非生物胁迫响应[11-12]。前期研究发现,α-亚麻酸(18∶3)代谢通路和茉莉酸信号在西藏当雄野生垂穗披碱草低温应答中发挥重要作用,其中磷脂酶A1(Phospholipase A1,PLA1)是该信号通路中的重要酶,可水解磷脂的sn1位置生成不饱和脂肪酸α-亚麻酸(18∶3)[13],该不饱和脂肪酸积极地调控植物的低温和干旱等非生物胁迫应答[7,14]。然而关于高寒植物西藏野生垂穗披碱草中EnPLA1基因调控的α-亚麻酸(18∶3)在植物非生物胁迫应答中的机理尚不明晰。
本研究从当雄野生垂穗披碱草中克隆了EnPLA1基因的编码序列(Coding sequence,CDS)全长序列,对其进行生物信息学、基因表达模式和亚细胞定位分析,并采用外源添加的方法分析α-亚麻酸在西藏野生垂穗披碱草低温适应中的作用,为后续研究EnPLA1调控植物α-亚麻酸(18∶3)通路在植物非生物胁迫应答中的机理奠定基础。
1 材料与方法
1.1 试验材料及处理
本研究供试野生垂穗披碱草种子于2016年10月采自西藏当雄县(30°28.535′ N,91°06.246′ E,海拔4 618 m)。垂穗披碱草种子用2.5% NaClO消毒5 min后,蒸馏水清洗4~5次,播种到育苗盘上,待幼苗长至3 cm左右时,转移到培养钵中,每钵5株,于人工气候箱内培养(光强12 000 lx,光周期16 h/8 h,昼/夜温度23℃/20℃,相对湿度60%),期间每2 d更换一次Hoagland营养液。将培养28 d的幼苗于低温培养箱进行低温(4℃)处理,取样时间点为低温胁迫0 h,12 h,24 h,48 h,72 h和1周,设置3次重复。
1.2 基因克隆与亚细胞定位载体构建
亚细胞定位载体pCAMBIA1302由本实验室保存,采用EcoRI单酶切线性化载体。根据普洛麦格Eastep®Super总RNA提取试剂盒(NO. LS1040)的方法提取垂穗披碱草叶片中RNA,采用酶标仪测定OD260/280,检测RNA提取效果。采用TAKARA反转试剂盒(NO. 6210A)将RNA反转成cDNA模板。根据RNA-Seq获得的序列,利用NCBI官网上的BLAST进行同源比对;采用primer 5软件设计引物(EcoR1-EnPLA1-F:5′-tcgagctcaagcttcgaattcATGTCGTTCCTC-CCGATCCC-3′;EcoR1-EnPLA1-R:5′-gtaccgtcgactgcagaattcGATGTGCTTGAAGTCTTGGAGCG-3′);以上述cDNA为模板,采用诺唯赞phanta高保真酶(No. P511-01)进行片段扩增。反应液包括2 μL上游引物(10 μM),2 μL下游引物(10 μM),2 μL模板cDNA,25 μL 2×Phanta Master Mix和19 μL ddH2O。PCR程序为预变性95℃ 3 min,然后30个循环的变性95℃ 10 s、退火60℃ 30 s、延伸72℃ 90 s,最后彻底延伸72℃ 5 min。PCR产物经1%琼脂糖凝胶电泳检测后,回收目的条带,重组到pCAMBIA1302 载体上,转化大肠杆菌DH5α感受态,挑单克隆,采用1300GFP-F:5′-CGCACAATCCCACTATCC-3′和1300GFP-SEQ-R:5′-CGCCCTTGCTCACCAT-3′引物进行菌检PCR,菌检正确后,送菌液测序,测序和引物合成由擎科生物技术有限公司完成。
1.3 生物信息学分析
利用ORF Finder(http://www.bioinformatics.org/sms2/orf_find.html)查找目的基因的开放阅读框,应用TMpred (https://embnet.vital-it.ch/software/TMPRED_form.html)预测EnPLA1蛋白质可能存在的跨膜区,利用Protparam (https://web.expasy.org/protparam/)来分析其理化性质,根据NCBI中的Conserved Domains (https://www.ncbi.nlm.nih.gov/Structure/cdd/docs/cdd_search.html)分析其功能结构域。将EnPLA1基因的cDNA序列在NCBI数据库中的BLASTx进行同源性比对,利用DNAMAN和MEGA6软件分析EnPLA1蛋白与其他植物的PLA1蛋白的进化关系,构建分子进化树。
1.4 EnPLA1在低温胁迫下的表达模式分析
生长至28 d的幼苗分别进行低温(4℃)处理0 h,12 h,24 h,48 h,72 h和1周,以不进行胁迫处理为对照,每个处理设置3个重复。采用Light Cycler 480实时荧光定量PCR仪进行实时定量PCR扩增。采用primer 5软件设计F和R引物(F:5′-CACAATCTCGAGTGCTACCTAC-3′;R:5′-GCTATGTCACGGTCTACCTCTA-3′),以根、根茎、叶片的cDNA为模板,采用诺唯赞定量酶(No. Q311-02)进行片段扩增,以Tublin作为内参基因。采用2-ΔΔCt方法计算EnPLA1基因的相对表达量。
1.5 EnPLA1亚细胞定位分析
利用ClonExpress® MultiS试剂盒(诺唯赞)将EnPLA1基因连接到经酶切线性化的GFP双元表达载体(pCAMBIA1302)上,将构建好35S:EnPLA1-GFP融合基因的重组载体转化农杆菌GV3101感受态细胞。通过注射法将农杆菌侵染4周龄的本氏烟草叶片上,暗培养24~48 h。在激光共聚焦显微镜下观察亚细胞定位。初步确定亚细胞定位后,提取烟草叶片的原生质体,进一步确定EnPLA1的亚细胞定位。
1.6 α-亚麻酸处理及指标测定
将培养14 d的幼苗,进行根部注射不同浓度α-亚麻酸处理,早晚各注射一次,每盆幼苗共注射4 mL,对照注射蒸馏水,5 d后进行低温(4℃)处理。每个处理设置3次重复,胁迫5 d后取样分析各项指标。沿植株根茎部位将地上部剪下来,分别测定株高和根长,用分析天平称其鲜干重;根据李合生[15]方法,采用电导率仪测定叶片相对电导率;氧自由基产生速率采用分光度法,测定OD530下的吸光度[16]。
1.7 数据分析
所有数据均用Microsoft Excel 2003 录入并作图,采用SPSS 22.0 软件对数据进行单因素方差分析,采用Duncan’s法对平均值进行多重比较。
2 结果与分析
2.1 EnPLA1基因的克隆
通过同源克隆我们获得大约1 300 bp左右的目的片段(图1)。将目的片段回收,连接pCAMBIA1302载体,挑选阳性克隆测序,结果表明EnPLA1的CDS序列为1 305 bp,与转录组测序结果一致。

图1 垂穗披碱草EnPLA1基因的克隆Fig.1 Cloning of EnPLA1 gene in E.nutans
2.2 EnPLA1编码的氨基酸序列比对及理化性质分析
利用ExPASyProt软件分析发现EnPLA1编码434个氨基酸(图2A)。通过Protparam分析其理化性质,推测EnPLA1蛋白的分子式为C2128H3286N582O621S15,其相对分子量为47 439.93,等电点(Isoelectric point,pI)为6.05,不稳定系数为47.59,属于不稳定蛋白。EnPLA1蛋白中相对含量较多的氨基酸是缬氨酸Val(10.4%,45个),异亮氨酸Leu(9.0%,39个)和丙氨酸Ala(8.8%,38个),亲水性平均数(Grand average of hydropathicity,GRAVY)为—0.082,属于亲水性蛋白,其脂肪系数为86.45(图2B)。应用TMpred对EnPLA1蛋白质跨膜区进行预测分析显示其存在4个跨膜结构域(图2C),分别位于第120~146,252~278位氨基酸之间[方向为膜内侧到膜外侧(i→o)]和第117~146,253~279位氨基酸之间[方向为膜外侧到膜内侧(o→i)],其中只有o→i的第117~146位氨基酸分数为694(分数>500为显著跨膜结构),为显著跨膜结构。二级结构分析表明,EnPLA1中主要包括α-螺旋(Alpha helix,36.41%)、无规则卷曲(Random coil,43.32%)、延伸链(Extended strand,16.59%)和β-转角(Beta turn,3.69%)(图2E)。根据EnPLA1编码氨基酸序列在NCBI中BLAST同源检索与比对,获得相似度较高的不同植物的氨基酸序列。利用DNAMAN6.0软件将野生垂穗披碱草中的EnPLA1编码氨基酸序列与与粗山羊草(Aegilopstauschiisubsp. Tauschii),单倍体小麦(Triticumturgidumsubsp. Durum),大麦(Hordeumvulgaresubsp.Vulgare),二穗短柄草(Brachypodiumdistachyon)、南荻(Miscanthuslutarioriparius),高粱(Sorghumbicolor),柳枝稷(Panicumhallii),谷子(Setariaitalica),洋地黄(Digitariaexilis),黍(Panicummiliaceum) 等多个物种的PLA1的氨基酸序列进行多重比对(图3A),结果显示上述氨基酸序列的相似性高达80.76%,都含有1个高度保守的Lipase (class 3)功能结构域(图2D,图3A)。
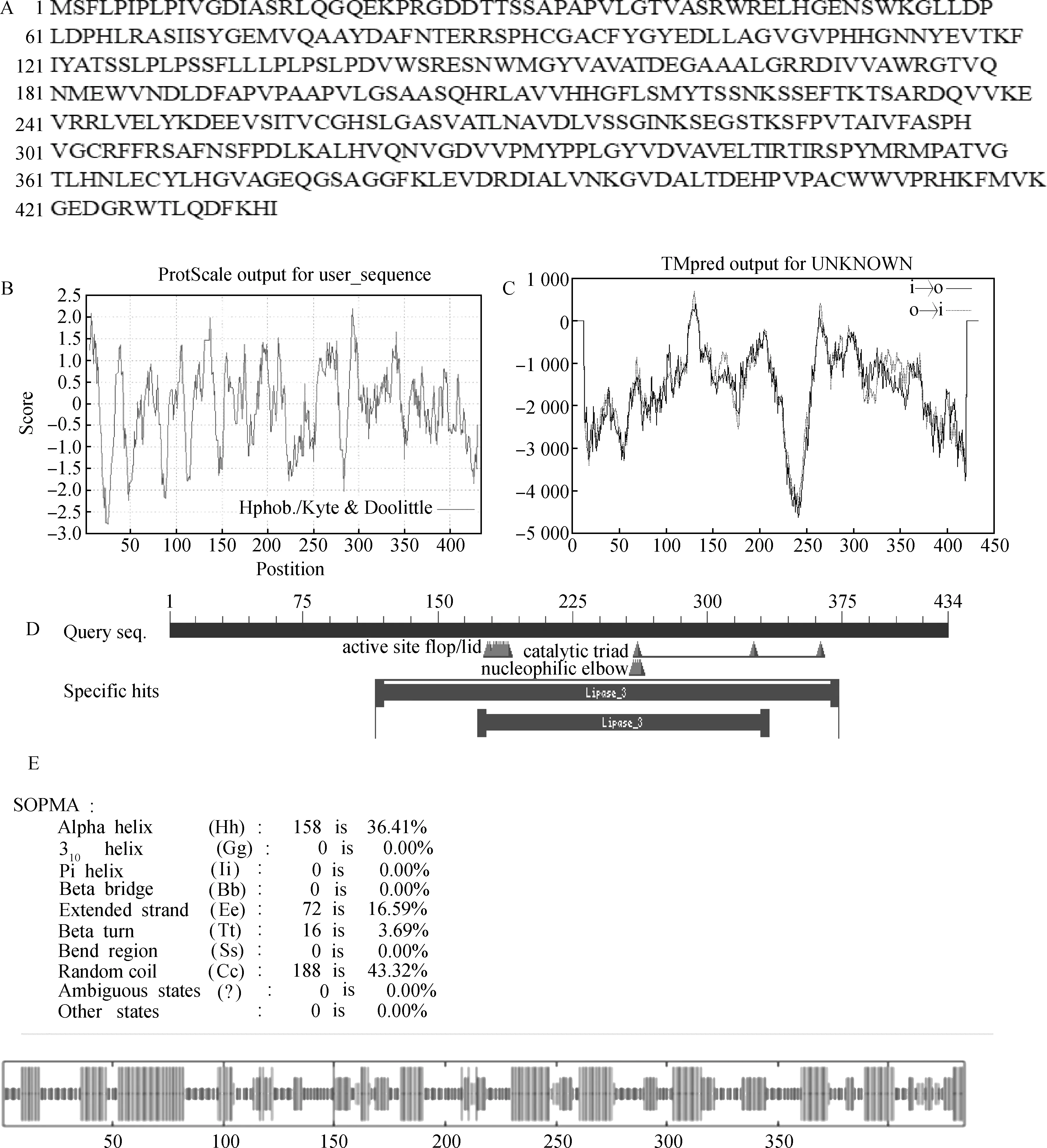

图2 垂穗披碱草EnPLA1的氨基酸序列(A),亲/疏水性(B),跨膜结构域(C),保守结构域(D)和二级结构(E)分析Fig.2 Analyses of amino acid sequence (A),hydrophilicity/ hydrophobicity (B),transmembrane domain (C),conserved domain (D) and secondary structure (E) of EnPLA1 in E.nutans
2.3 EnPLA1的系统进化树构建
利用MEGA7.0构建系统进化树,结果显示,西藏野生垂穗披碱草(E.nutans)PLA1基因编码的氨基酸序列与单倍体小麦、粗山羊草和大麦亲缘关系较近,高达80.76%,其次是二穗短柄草(图3B)。

图3 垂穗披碱草EnPLA1编码的氨基酸与其他物种氨基酸序列的多重比对(A)和系统进化树(B)Fig.3 Multiple alignments of amino acid sequences (A) and phylogenetic tree (B) between the amino acids encoded by EnPLA1 gene in E.nutans and other species
2.4 EnPLA1的亚细胞定位分析
在烟草中瞬时表达EnPLA1,激光共聚焦显微镜下观察,发现EnPLA1-GFP融合蛋白的荧光信号主要定位在在细胞质(图4A,B),与通过WoLF PSORT(https://wolfpsort.hgc.jp/)进行亚细胞定位预测的结果基本一致。

图4 EnPLA1蛋白在烟草叶片表皮细胞(A)和原生质体(B)中亚细胞定位分析Fig.4 Subcelllular localization analysis of EnPLA1 in epidermal cells (A) and a mesophyll protoplast (B) isolated from Nicotiana benthamiana leaves注:标尺为10 μmNote:Scale bar,10 μm
2.5 EnPLA1基因的表达分析
在不同组织中的实时定量表达分析结果显示,EnPLA1在根、茎、叶中均有表达,其中在叶中表达高于茎和根中(P<0.05);低温胁迫诱导叶和茎中EnPLA1基因显著上调表达,在低温处理72 h时EnPLA1的表达量最高,与对照相比分别增加6 513.05%和7 681.33%(P<0.05);而低温对根系中该基因的表达影响较小,仅在低温胁迫12 h时上调表达(图5A,B)。
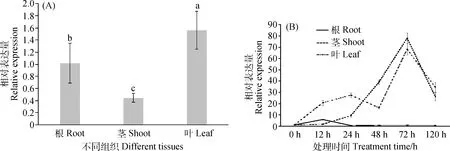
图5 不同组织中EnPLA1相对表达量(A)及低温胁迫下不同时长不同组织中EnPLA1相对表达量(B)Fig.5 Relative expression levels of EnPLA1 in different tissues (A) and in different duration under low temperature stress (B)注:不同小写字母表示差异显著(P<0.05),下同Note:Different lowercase letters indicate significantly differences at the 0.05 level,the same as follow
2.6 α-亚麻酸对低温胁迫下垂穗披碱草幼苗生长和细胞膜稳定性的影响
25~500 μM的α-亚麻酸处理能够不同程度地改变低温胁迫下垂穗披碱草幼苗的生长,其中株高、根长和鲜干重在浓度为25 μM时最大,与对照相比,分别增加11.91%,21.05%,54.55%和29.09%(图6A-D)。

图6 α-亚麻酸对低温胁迫下垂穗披碱草幼苗株高(A)、根长(B)、鲜重(C)、干重(D)Fig.6 Effects of α-linolenic acid on plant height (A),root length (B),fresh and dry weight (C,D) of E.nutans seedlings under cold stress
低温胁迫下不同浓度α-亚麻酸处理导致叶片相对电导率及自由基含量的影响也呈动态变化,25 μM的α-亚麻酸处理下叶片相对电导率和氧自由基含量与对照相比分别降低了18.71%和93.70% (图7)。综上表明,浓度为25 μM的α-亚麻酸能够缓解低温对垂穗披碱草幼苗的造成的氧化损伤。

图7 α-亚麻酸对低温胁迫下垂穗披碱草幼苗相对电导率(A)和氧自由基含量(B)的影响Fig.7 Effects of α-linolenic acid on the relative electrical conductivity (A) and oxygen free radical content (B) of E.nutans seedlings under cold stress
3 讨论
细胞膜是植物感受外部环境刺激的首要部位,同时也参与细胞感受外界环境刺激和信号传递[2]。α-亚麻酸是细胞膜的重要组成物质,当植物遭遇生物与非生物胁迫时其水平增加,从而调节细胞膜的流动性[7-8]。本课题组前期的转录学研究发现α-亚麻酸在西藏野生垂穗披碱草低温胁迫适应中具有积极的调控作用[17],而且通过外源添加试验表明25 μM的α-亚麻酸处理能够显著地提高垂穗披碱草的抗寒性。与之相似,Li等[7]和李东等[14]在山茶(Camelliajaponica)和水稻(Oryzasativa)上的研究也表明α-亚麻酸(18∶3)能积极地调控植物的低温和干旱等非生物胁迫应答。为了进一步阐明高寒植物西藏野生垂穗披碱草中EnPLA1基因调控的α-亚麻酸(18∶3)通路在植物非生物胁迫应答中的机理,本试验首次从西藏野生垂穗披碱草克隆了α-亚麻酸合成酶基因EnPLA1的全长CDS序列,生物信息学分析发现EnPLA1蛋白与粗山羊草、单倍体小麦、大麦、二穗短柄草、高粱、柳枝稷、谷子等禾本科植物的蛋白相似度高达80%以上,表明PLA1蛋白在禾本科植物进化上存在高度的保守性。
磷脂酶在植物中普遍存在,在植物生长、发育和胁迫应答等过程中都扮演着重要的角色[18]。其中,磷脂酶A1(PLA1)为α-亚麻酸(18∶3)合成途径的关键酶[19]。Seo等[20]发现辣椒(CapsicumannuumL.)中CaPLA1蛋白在sn-1位点催化磷脂水解产生α-亚麻酸(18∶3)。本研究为进一步探究EnPLA1依赖的α-亚麻酸途径调控西藏野生垂穗披碱草低温适应的机制,分析了EnPLA1蛋白的亚细胞定位情况。研究结果表明EnPLA1蛋白定位在细胞质中,这与Singh等[21]研究结果一致,该研究指出PLA1分为I,II和III各亚型,其中PLA1-II亚型定位在细胞质。表达模式分析表明,EnPLA1基因主要在叶中表达,这与Park等[22]研究结果一致。随着低温时间的延长,低温胁迫诱导叶和茎中EnPLA1基因显著上调表达,而根中该基因表达受低温影响较小,说明EnPLA1基因可能参与调控植物的低温胁迫应答。本研究结果为深入阐明EnPLA1基因调控的植物非生物胁迫应答的机制提供理论支撑。
4 结论
综上所述,本研究成功克隆了EnPLA1基因的CDS序列,发现其ORF为1 305 bp,编码434个氨基酸,分子量为47.44 KD,等电点为6.05,该蛋白为亲水性蛋白且偏酸性。EnPLA1编码的蛋白与粗山羊草,大麦等具有较高的相似性,含有1个高度保守的Lipase (class 3)功能结构域,存在4个跨膜结构域,EnPLA1蛋白主要定位细胞质。EnPLA1基因在垂穗披碱草的根茎叶中均有表达,且叶茎中该基因能够积极地响应低温胁迫,表明PLA1可能参与调控植物的低温胁迫应答。外源α-亚麻酸能够显著地提高垂穗披碱草的抗寒性,然而关于EnPLA1基因调控的α-亚麻酸通路在植物非生物胁迫应答中的机理需要进一步挖掘。

